Supratrigeminal Bilaterally Projecting Neurons Maintain Basal Tone and Enable Bilateral Phasic Activation of Jaw-Closing Muscles[1]
Introduzione I muscoli della mandibola partecipano a una varietà di comportamenti essenziali, tra cui masticare, bere, leccare, respirare e parlare, e devono coordinarsi tra loro e con altri muscoli della lingua e del viso. La disfunzione dell'attività muscolare mandibolare contribuisce a numerosi disturbi orofacciali, tra cui bruxismo notturno, distonia orofacciale, disturbi dell'articolazione temporo-mandibolare e altri [2]. Nei mammiferi, i movimenti mandibolari fluidi richiedono un'attività coordinata tra i muscoli mandibolari di destra e di sinistra, poiché la mandibola è unita sulla linea mediana. Un modo semplice per consentire tale coordinazione è che i neuroni premotori proiettino bilateralmente ai motoneuroni mandibolari di sinistra e di destra. Infatti, il nucleo sopratrigeminale (SupV) e i nuclei reticolari parvicellulari e intermedi, situati dorsalmente al nucleo motore facciale (Rt-MoVII), contengono neuroni che proiettano assoni bilateralmente ai nuclei motori trigeminali (MoV), che a loro volta contengono i motoneuroni che chiudono la mandibola [3]. Recentemente abbiamo fornito prove che alcuni di questi neuroni sinaptano direttamente sui motoneuroni del muscolo massetere bilateralmente [4].
Studi precedenti hanno dimostrato che i neuroni di SupV e Rt-MoVII ricevono input sensoriali orofacciali [5], e input dai fusi neuromuscolari mandibolari [6]; questi neuroni rispondono alla pressione sui denti, allo stiramento passivo della mandibola e agli stimoli sensoriali applicati sulla lingua [7]. La stimolazione del nervo sensoriale che innerva la mandibola inferiore attiva i neuroni SupV e Rt-MoVII, portando all'inibizione dei motoneuroni nel MoV e nel nucleo motorio facciale centrale [8]. Questi risultati hanno portato all'ipotesi che i neuroni in SupV e Rt-MoVII mediano la componente di inibizione motoria dei riflessi di dolore mandibolare.
Tuttavia, SupV e Rt-MoVII non contengono solo neuroni GABAergici e glicinergici che potrebbero mediare l'inibizione motoria, ma anche neuroni glutammatergici [9]. Studi di fisiologia hanno indicato che l'attivazione di queste regioni induce potenziali inibitori ed eccitatori nei motoneuroni trigeminali [10]. Inoltre, i neuroni di SupV e Rt-MoVII sono fortemente interconnessi con altri neuroni premotori intorno al MoV [11], e solo un sottoinsieme di neuroni SupV risponde agli stimoli sensoriali orofacciali, suggerendo che i ruoli dei neuroni in queste regioni potrebbero essere più complessi [12]. Infatti, molti neuroni in entrambe queste regioni sono attivi in modo ritmico durante i movimenti ritmici della mandibola [13], e potrebbero trasmettere informazioni ritmiche ai motoneuroni mandibolari. È possibile che sottopopolazioni distinte di neuroni in SupV e Rt-MoVII medino ciascuno di questi effetti. Tuttavia, ci sono stati pochi studi che abbiano valutato il ruolo di queste sottopopolazioni di neuroni in animali in movimento libero. Abbiamo deciso di caratterizzare i neuroni che proiettano bilateralmente (BPNs), i quali innervano simultaneamente sia il MoV di sinistra che quello di destra, e di investigare come questi neuroni influenzano l'attività muscolare mandibolare nel topo sveglio e in movimento. Un importante ostacolo per la conduzione di tali studi è stata la mancanza di tecnologia per isolare e manipolare selettivamente i BPNs. In questo studio, sfruttiamo un sistema split-Cre mediato da inteine, sviluppato nel nostro laboratorio [14], in combinazione con lentivirus retrogradi per localizzare e manipolare i BPNs, e identificare i loro schemi di proiezione.
L'ibridazione in situ e la fisiologia assistita da Channelrhodopsin-2 (ChR2) su fette cerebrali hanno rivelato che i BPNs sono una popolazione mista di neuroni eccitatori e inibitori, capaci di indurre potenziali postsinaptici inibitori (IPSCs) e eccitatori (EPSCs) nei motoneuroni del MoV. Abbiamo silenziato permanentemente i BPNs in topi liberi in movimento utilizzando la catena leggera della tossina tetanica (TeNT), scoprendo un ruolo per i BPNs di SupV nel mantenere un livello adeguato di attivazione del massetere durante i comportamenti di masticazione e rosicchiamento. Per approfondire questo effetto, abbiamo inibito o attivato temporaneamente i BPNs di SupV durante l'attività naturale della mandibola utilizzando l'optogenetica, identificando due ruoli distinti per i BPNs di SupV nel movimento di chiusura mandibolare: consentire l'attivazione fasica bilaterale dei muscoli e ridurre il tono basale del muscolo massetere.
Materiali e Metodi Tutti i protocolli sperimentali sono stati approvati dal Duke University Institutional Animal Care and Use Committee.
Virus. I lentivirus rivestiti con FuGB2 contenenti Cre-N (RG-LV-Cre-N) e Cre-C (RG-LV-Cre-C) sono stati prodotti e concentrati come descritto precedentemente [15]. Brevemente, le cellule HEK293T sono state transientemente trasfettate con pLenti-hSynapsin-CreN o pLenti-hSynapsin-CreC insieme a psPAX2 e FuGB2 utilizzando il polietilenimmina “MAX” (PEI MAX) (Polysciences 24765). Quarantotto ore dopo la trasfezione, il mezzo di coltura cellulare è stato raccolto, centrifugato a 3000 rpm per 15 minuti, e il surnatante è stato filtrato con un'unità filtrante da 0,45 μm (Millipore, SCHVU01RE). Il surnatante contenente il virus filtrato è stato caricato in provette per centrifuga con 3 ml di cuscino di saccarosio al 20% sul fondo, centrifugato a 25.000 rpm con il rotore Beckman SW-28 per 2 ore a 4°C. Il pellet è stato risospeso in un volume appropriato di PBS senza calcio e magnesio (PBS, −Ca2+, −Mg2+), aliquotato e conservato a −80°C. Il titolo virale è stato stimato a 1 × 10^8 unità infettive per millilitro.
I virus AAV8-hsyn-Flex-GFP e AAV8-hSyn-Flex-TeNT-P2A-GFP sono stati generati e concentrati come descritto in precedenza [16]. In breve, le cellule HEK293T sono state trasientemente trasfettate con pAAV-hSyn-Flex-GFP o pAAV-hSyn-Flex-TeNT-P2A-GFP, insieme al plasmide del sierotipo AAV8 e pAd.DELTA F6 utilizzando PEI MAX (Polysciences 24765). Settantadue ore dopo la trasfezione, il mezzo di coltura cellulare è stato scartato, le cellule sono state raccolte in PBS, congelate e scongelate tre volte utilizzando un bagno di ghiaccio secco/etanolo, e centrifugate a 3000 rpm per 30 minuti. Il DNA contaminante nel surnatante è stato rimosso aggiungendo benzonasi e incubato a 37°C per 30 minuti. La soluzione virale grezza è stata filtrata attraverso un filtro da 0,45 μm (Millipore) e centrifugata a 25.000 rpm per 90 minuti utilizzando un rotore Beckman SW-28. Il pellet è stato risospeso in 4 ml di PBS, filtrato successivamente attraverso un filtro da 0,45 μm e da 0,22 μm. La soluzione virale grezza è stata concentrata a 200–250 μl utilizzando l'unità di filtro Amicon Ultra-4 (100 KDa), lavata una volta con 4 ml di PBS e concentrata a un volume appropriato. La soluzione virale è stata ulteriormente purificata utilizzando un'unità di filtro centrifugale Ultrafree-MC da 0,22 μm (Millipore, UFC30GV0S), le aliquote sono state conservate a −80°C fino all'uso.
Animali. Sono stati utilizzati topi adulti maschi e femmine Ai14 (Jackson Laboratories, stock 007914) che esprimono una proteina Cre-dipendente tdTomato per la marcatura iniziale dei BPNs, la tracciatura delle proiezioni dei BPNs, esperimenti di ibridazione in situ (n = 4 topi, 2 sezioni/regione/topo per un totale di 8 sezioni per condizione), e sono stati utilizzati anche come controlli per esperimenti optogenetici (n = 4 topi). I topi maschi e femmine C57B/L6 (Jackson Laboratories, stock 000664) sono stati utilizzati per gli esperimenti con TeNT [n = 5 topi, 2 canali elettromiografici (EMG)/topo] e animali di controllo (n = 4 topi, 2 canali EMG/topo). I topi maschi e femmine Ai32 che esprimono un ChR2 Cre-dipendente (Jackson Laboratories, stock 024109) sono stati utilizzati per esperimenti ChR2 (n = 5 topi, 2 canali EMG/topo) e per esperimenti di elettrofisiologia (n = 13 cellule da 6 topi). I topi maschi Ai35 che esprimono un'archaerodopsina Cre-dipendente (Arch; Jackson Laboratories, stock 012735) sono stati utilizzati per esperimenti Arch (n = 5 topi, 2 canali EMG/topo).
Iniezioni stereotassiche. Gli animali sono stati anestetizzati profondamente con un'iniezione intraperitoneale di ketamina (100 mg/kg) e xilazina (10 mg/kg) disciolte in soluzione salina. Il virus è stato somministrato nel sito bersaglio utilizzando una capillare di vetro tirato (Warner Instruments) collegato a un UltraMicroPump controllato da un SYS-Micro4 Controller (World Precision Instruments). Per tutti i topi, 300 nl di RG-LV-Cre-N o 300 nl di RG-LV-Cre-C sono stati iniettati a una velocità di 200 nl/min nel MoV di sinistra o di destra, rispettivamente, in topi di età compresa tra 6 e 12 settimane (Fig. 1A). Per mirare bilateralmente al MoV, i topi sono stati montati nel telaio stereotassico con un'inclinazione tale che lambda fosse circa 180 μm ventrale a bregma (in pratica, tra 140 e 240 μm). Il cranio è stato assottigliato intorno alle coordinate di 5,00 mm caudali rispetto a bregma e 1,34 mm laterali rispetto a lambda, e la pipetta di iniezione è stata spostata appena anteriormente al seno trasverso. A questo punto, sulla dura madre, è stata misurata la coordinata dorso-ventrale della pipetta e il sito di iniezione è stato calcolato come 4,20 mm sotto questo punto. Un leggero tremolio o una scossa della guancia ipsilaterale è avvenuto durante l'iniezione del virus, indicando il corretto posizionamento nel MoV. Il processo è stato ripetuto sul lato controlaterale con il virus complementare.
Negli esperimenti di silenziamento mediati da TeNT, AAV-Flex-TeNT-EGFP o AAV-flex-EGFP sono stati iniettati bilateralmente nella regione reticolare parvicellulare a tre profondità verticali distanziate di 200 μm nello stesso intervento chirurgico delle iniezioni split-Cre. Le coordinate di iniezione erano relative al MoV di sinistra e di destra. Ad esempio, se le coordinate per il MoV erano le seguenti: posteriore a bregma = B; laterale a lambda = L; ventrale alla dura madre = D, allora le coordinate per l'iniezione di AAV erano 1,0 mm posteriori a B; 60 μm mediali rispetto a L; e 650, 500 e 350 μm ventrali rispetto a D. In ciascun sito di iniezione, sono stati iniettati 150 nl di virus utilizzando un iniettore a siringa a pressione, per un totale di 450 nl di virus iniettato su ciascun lato della regione reticolare.
Ibridazione in situ e immunoistochimica. Tutti i topi sono stati profondamente anestetizzati e perfusi transcardicamente con paraformaldeide (PFA) al 4% (Sigma-Aldrich) in PBS 1× (Invitrogen). Per gli studi di tracciamento e ibridazione in situ, i topi Ai14 iniettati con virus split-Cre retrogradi sono stati perfusi 2 settimane dopo l'iniezione. Per tutti gli altri studi, i topi sono stati perfusi l'ultimo giorno di acquisizione dei dati. I campioni cerebrali sono stati successivamente post-fissati durante la notte in PFA al 4%, crioprotetti in una soluzione di saccarosio al 30% (Sigma-Aldrich) in PBS, inclusi in un composto per il taglio a temperatura ottimale (Tissue-Tek) e congelati per almeno 24 ore a −80°C. L'immunoistochimica è stata eseguita come descritto precedentemente [17]. Gli anticorpi utilizzati sono stati i seguenti: anti-GFP coniglio (1:1000, Abcam), anti-RFP coniglio (1:1000, Rockland), anti-rabbit GFP (1:1000, Jackson ImmunoResearch).
L'ibridazione in situ su sezioni flottanti è stata eseguita come segue. Per ogni topo, sei sezioni da 60 μm contenenti Rt-MoVII e sei sezioni contenenti SupV sono state raccolte con un criostato a −20°C e risospese in PFA al 4% in acqua deionizzata trattata con DEPC (Sigma-Aldrich) in una piastra da 24 pozzetti. I campioni sono stati risciacquati con PBS 1× in acqua DEPC (PBS DEPC), lavati con Triton X-100 al 0,3% (Sigma-Aldrich) in PBS DEPC, trattati con proteinasi K a 5 μg/ml in PBS DEPC, acetilati utilizzando una soluzione di 0,465 g di TEA (Sigma-Aldrich), 28 μl di NaOH 10N, 25 ml di acqua DEPC, 62,6 μl di anidride acetica (Sigma-Aldrich), e infine risciacquati con PBS DEPC. I campioni sono stati incubati per 1 ora a 60°C in un buffer di ibridazione (0,2× SSC, Life Technologies), reagente di blocco al 10% (Roche), formammide al 50%, N-lauroilsarcosina al 2% (NLS; Sigma-Aldrich), SDS al 10% (Sigma-Aldrich), dopodiché le sonde sono state preparate come descritto precedentemente [18]. Le sonde per GAD1, GAD2, GlyT2 e vGluT2 sono state create come descritto precedentemente [19], e le sonde per GAD1 e GAD2 sono state applicate come una sonda mista. Le sonde sono state alternate tra tutte le sezioni per garantire che una sezione posteriore e una anteriore di ciascuna regione fossero analizzate con ciascun tipo di sonda. I campioni sono stati incubati con le sonde durante la notte in un buffer di ibridazione a 60°C. Il giorno successivo, i campioni sono stati lavati con SSC 2×/50% formammide/0,1% NLS a 60°C, seguiti da SSC 2×/0,1% NLS, SSC 0,2×/0,1% NLS, e infine un lavaggio in tampone salino Tris contenente Triton X-100 0,1% (TBST) a temperatura ambiente (RT). I campioni sono stati incubati a RT in una soluzione di blocco al 10% in TBST, seguiti dall'applicazione degli anticorpi primari (anti-DIG-AP 1:3500, Roche; anti-RFP coniglio 1:200, Rockland) durante la notte a 4°C. Il giorno successivo, i campioni sono stati lavati con TBST, incubati in Tris-HCl 100 mm, pH 8.0, incubati con FastRed (Roche) per 90 minuti, risciacquati con TBST, incubati con l'anticorpo secondario (anti-rabbit GFP AlexaFluor 488 1:1000, Jackson ImmunoResearch) per 2 ore, colorati con DAPI per la visualizzazione dei nuclei e montati su vetrini per l'imaging.
Acquisizione e quantificazione delle immagini.
I campioni sono stati acquisiti utilizzando un microscopio confocale a scansione laser Zeiss 700. I campioni per l'ibridazione in situ sono stati acquisiti a una risoluzione di 40× su tre posizioni z. Tutte le posizioni z per ciascuna fetta sono state unite in un'unica immagine utilizzando Adobe Photoshop CS6 per la quantificazione. Tutti gli altri campioni sono stati acquisiti a una risoluzione di 20×. I neuroni di SupV e Rt-MoVII sono stati identificati come neuroni all'interno della regione dorsale rispetto al MoV o MoVII, rispettivamente, in sezioni contenenti questi nuclei. Tutti i neuroni sono stati contati manualmente. Le percentuali di ibridazione in situ sono state calcolate all'interno di ciascun animale prima di calcolare la media delle percentuali tra gli animali.
Elettrofisiologia. Due settimane dopo l'infezione virale, i topi sono stati anestetizzati con isofluorano e perfusi transcardicamente in liquido cerebrospinale artificiale NMDG freddo (NMDG-ACSF; contenente 92 mm NMDG, 2.5 mm KCl, 1.2 mm NaH2PO4, 30 mm NaHCO3, 20 mm HEPES, 2 mm glucosio, 5 mm ascorbato di sodio, 2 mm tiourea, 3 mm piruvato di sodio, 10 mm MgSO4, 0.5 mm CaCl2), gorgogliato con una miscela di 5% CO2/95% O2. Il cervello è stato quindi estratto e sezionato in fette sagittali/orizzontali di 350 μm di spessore utilizzando un vibratome (VT-1000S, Leica Microsystems) contenente NMDG-ACSF ossigenato e freddo. Le sezioni coronali, comprese quelle contenenti il MoV, sono state quindi gorgogliate nella stessa soluzione a 37°C per 8 minuti e trasferite in ACSF modificato con HEPES a temperatura ambiente (20°–25°C; 92 mm NaCl, 2.5 mm KCl, 1.2 mm NaH2PO4, 30 mm NaHCO3, 20 mm HEPES, 2 mm glucosio, 5 mm ascorbato di sodio, 2 mm tiourea, 3 mm piruvato di sodio, 2 mm MgSO4, 2 mm CaCl2) per almeno 1 ora prima di effettuare le registrazioni. Le registrazioni sono state eseguite in una camera immersa, superfusa con ACSF continuamente ossigenato (125 mm NaCl, 2.5 mm KCl, 1.25 mm NaH2PO4, 26 mm NaHCO3, 20 mm glucosio, 2 mm CaCl2, 1.3 mm MgSO4) a una temperatura vicina a quella fisiologica (34 ± 1°C). Le cellule circondate da terminali assonici che esprimono un marcatore fluorescente codificato viralmente (ChR2-EYFP) sono state visualizzate tramite microscopia video a interferenza differenziale a infrarossi e fluorescenza (Examiner.D1, Zeiss). Le registrazioni in clamp di tensione a cellula intera sono state amplificate con Multiclamp 700B (filtrate a 2 kHz), digitalizzate con Digidata 1440A (5 kHz), e registrate utilizzando il software pClamp 10 (Axon). L'elettrodo patch-clamp (4–6 MΩ) è stato riempito con una soluzione intracellulare contenente 130 mm acido d-gluconico, 130 mm CsOH, 5 mm NaCl, 10 mm HEPES, 12 mm fosfocreatina, 3 mm MgATP, 0.2 mm Na2GTP, 1 mm EGTA. La fotostimolazione è stata eseguita utilizzando un LED a 473 nm (CoolLED, pE4000) controllato dal software pClamp 10 (Axon). L'intensità della luce è stata impostata al 100% per generare spike nei terminali assonici dei neuroni ChR2+ proiettati bilateralmente con una durata dell'impulso di 2 ms. Tutti i dati elettrofisiologici sono stati analizzati offline utilizzando il pacchetto Neuromatic (Think Random) nel software Igor Pro (WaveMetrics). L'analisi offline è stata eseguita mediando cinque tracce. L'ampiezza di picco, la semi-larghezza, la latenza di inizio, il tempo al picco, il tempo di salita e il tempo di decadimento degli EPSC e IPSC evocati dalla luce sono stati analizzati. La latenza di inizio degli EPSC e IPSC evocati dalla luce è stata definita come il tempo dall'inizio dello stimolo alla prima deflessione misurabile del potenziale dalla linea di base. Allo stesso modo, il tempo al picco è stato definito come il tempo dall'inizio dello stimolo al picco del potenziale. Il tempo di salita e il tempo di decadimento sono stati definiti come il tempo tra il 10% e il 90% della salita o del decadimento del potenziale, rispettivamente. I test t a due code sono stati eseguiti in GraphPad Prism per tutti i dati di fisiologia.
Impianti di fibre ottiche ed elettromiogrammi.
Le fibre ottiche sono state fabbricate su misura utilizzando cavi di fibra ottica di 0,2 mm di diametro, e le cannule ottiche sono state incollate insieme con una colla termoindurente (ThorLabs). Le coordinate di impianto sono state ottenute utilizzando le coordinate A/P e M/L per il MoV di sinistra o di destra, come descritto sopra. La coordinata D/V utilizzata era 3,50 mm sotto la dura. Dopo l'impianto, l'apertura nel cranio è stata riempita con cera ossea e la fibra ottica è stata fissata al cranio utilizzando supercolla Gel Control (Home Depot). È stata praticata una depressione nel cranio sopra la corteccia visiva, e una vite di messa a terra è stata inserita. Un filo di messa a terra in acciaio è stato avvolto attorno alla vite di messa a terra e saldato a una scheda di circuito a sette contatti fatta su misura (regalo del Dr. David Kleinfeld, University of California, San Diego, La Jolla, CA).
Dopo tutti gli impianti di fibre ottiche, e negli animali sperimentali e di controllo trattati con TeNT, sono stati impiantati elettrodi EMG nei muscoli masseteri di sinistra e di destra. Gli elettrodi EMG da 22 μm sono stati fabbricati su misura da filo di tungsteno rivestito da 0,002 pollici (CFW e A-M systems). Ogni estremità è stata spogliata di circa 1 μm e un'estremità è stata piegata a uncino. Tre elettrodi sono stati inseriti nella punta di un ago da 27 o 25 gauge, con l'estremità non uncinata inserita per prima. Gli elettrodi sono stati quindi fatti passare attraverso la pelle sulla sommità del cranio dietro l'occhio e nei muscoli masseteri sinistro e destro di ciascun topo. Ogni contatto EMG è stato saldato a una scheda di circuito a sette contatti fatta su misura con pin attaccati, che è stata ulteriormente fissata al cranio con supercolla. Tutti i componenti elettronici sono stati rivestiti con cemento dentale per prevenire potenziali danni da parte del topo.
Registrazioni EMG e manipolazione optogenetica dei neuroni proiettanti bilateralmente di SupV. Almeno una settimana dopo l'intervento chirurgico, i topi sono stati brevemente anestetizzati con isofluorano vaporizzato. Ogni topo è stato collegato a un laser tramite un cavo ottico (ThorLabs) e a un sistema di acquisizione Sirenia (Pinnacle Technology). Il primo giorno di registrazione, la coppia ottimale di elettrodi EMG è stata scelta per ogni topo e per ciascun muscolo. Questa coppia è stata identificata come quella con il miglior rapporto segnale/rumore dell'attività del massetere durante episodi di rosicchiamento o masticazione. Tutte le sessioni di registrazione successive hanno raccolto dati dalla stessa coppia di elettrodi. Durante gli esperimenti optogenetici, un stimolatore a impulsi Master-8 (AMPI) è stato utilizzato per controllare gli impulsi laser e inviare un impulso di logica TTL (transistor-to-transistor) a un sistema NI-DAQ (National Instruments) che ha tradotto questi impulsi nel software Sirenia Acquisition (Pinnacle Technology). Questo software è stato utilizzato per registrare segnali EMG preelaborati e impulsi TTL simultanei forniti dal Master-8. La frequenza di campionamento EMG era di 2 kHz con un filtro passa-alto di 0,5 Hz e un filtro passa-basso di 1 kHz.
Per gli esperimenti di attivazione optogenetica dei BPN, sono stati somministrati impulsi di 20 ms di un laser blu (473 nm) a 10 Hz per 2 s, con un intervallo di 20 s tra le sequenze di stimolazione. Per gli esperimenti di inibizione dei BPN, è stato somministrato un impulso continuo di 10 s di un laser giallo-verde (561 nm) con un intervallo di 40 s tra gli impulsi. Durante tutti gli esperimenti, episodi di masticazione, rosicchiamento, pulizia e vari altri comportamenti sono stati registrati manualmente in un quaderno e successivamente trascritti in un file Excel per un utilizzo futuro.
Analisi dei dati EMG. I dati grezzi dell'EMG bilaterale sono stati convertiti da un file Sirenia a un file EDF utilizzando il software Sirenia Acquisition. I dati TTL sono stati esportati in un file TXT. Questi dati sono stati quindi importati in MATLAB utilizzando edfRead e codice personalizzato e estratti in due vettori EMG e un vettore TTL per ulteriori elaborazioni. La maggior parte dell'analisi dei dati successiva è stata condotta in MATLAB utilizzando codice personalizzato o in Excel. Le analisi di regressione lineare per confrontare le pendenze sono state condotte in GraphPad Prism.
Analisi degli esperimenti di silenziamento dei BPN mediato da TeNT. I dati EMG sono stati inizialmente filtrati tra 50 e 500 Hz utilizzando filtri Butterworth e rettificati. Per ciascun canale, è stata registrata manualmente una soglia di attivazione. Gli episodi di masticazione sono stati estratti dalle tracce EMG grezze utilizzando intervalli di tempo registrati manualmente. Ogni intervallo di tempo è stato valutato per "episodi di masticazione", dove l'attivazione EMG nella gamma 5–7 Hz (quella della masticazione riduttoria) era grande e consistente in entrambi i canali. Questo è stato valutato filtrando il segnale in banda tra 5 e 7 Hz utilizzando un filtro Butterworth, e impostando una soglia personalizzata al di sopra della quale si verificavano episodi standard di masticazione riduttoria. Un singolo episodio aveva una durata minima di 500 ms per garantire almeno tre burst per episodio. Questi episodi sono stati analizzati individualmente per l'ampiezza media (definita come il massimo locale all'interno di un singolo burst sopra la soglia), l'ampiezza integrata (definita come l'integrale di un burst sopra la soglia) e la frequenza (compresa tra 5 e 7 Hz) all'interno di un determinato episodio. La media di queste medie è stata ottenuta per ciascun giorno di comportamento post-iniezione. Il comportamento è stato valutato 7 giorni dopo l'iniezione e due volte a settimana per le 2 settimane successive. L'ampiezza media, l'ampiezza integrata e la frequenza per ciascun canale per ogni giorno sono state normalizzate alla media per quel canale 7 giorni post-iniezione. Le pendenze medie dell'ampiezza o dell'ampiezza integrata rispetto al tempo post-iniezione sono state valutate e confrontate utilizzando la regressione lineare in GraphPad Prism
Analisi degli esperimenti di silenziamento optogenetico mediato da Arch.
I dati grezzi dell'EMG sono stati inizialmente segmentati in campioni di 30 secondi contenenti 10 secondi di dati prima dell'inizio di ogni impulso TTL e 10 secondi di dati dopo la fine dell'impulso TTL. I dati sono stati normalizzati utilizzando lo Z-score e per ogni campione è stato ottenuto un grafico tempo-frequenza-potenza utilizzando la funzione dello spettrogramma. È stata utilizzata una finestra di 200 ms con una sovrapposizione del 50% e un NFFT di 2048. Le matrici di frequenze comprese tra 118 e 122 Hz sono state mediate all'interno di ciascun campione per creare un singolo vettore potenza-tempo. Questi vettori sono stati mediati su ciascun canale per ottenere i vettori medi potenza-tempo per ciascun canale e per ciascun topo. Le medie dei primi (baseline), secondi (luce ON), e terzi (luce OFF) 10 secondi di questi vettori sono state estratte per tutti i topi e tutti i valori sono stati normalizzati sottraendo le baseline individuali. I valori normalizzati successivi sono stati mediati su tutti e cinque i topi per ottenere i valori medi e SEM. Le soglie per l'inizio dell'effetto e la fine dell'effetto sono state definite come la somma della media e 1 SD della media per i primi 10 secondi (inizio) o per gli ultimi 5 secondi (fine) delle matrici di potenza media per ciascun canale e per ciascun topo. Le medie e le SEM di questi valori sono state calcolate su tutti gli animali.
L'analisi del tono muscolare del silenziamento cronico e dell'attivazione acuta dei neuroni proiettanti bilateralmente è stata valutata nello stesso modo sopra descritto, ma con le seguenti modifiche. Negli esperimenti di silenziamento cronico, la potenza media nella banda 118-122 Hz su ciascun canale per ciascun topo è stata ottenuta per l'intera sessione comportamentale di baseline, 7 giorni dopo l'iniezione virale, e per l'intera sessione comportamentale finale, 21 giorni dopo l'iniezione virale. Questi valori sono stati mediati su tutti i canali e su tutti i topi per confrontare le medie della potenza. Negli esperimenti di attivazione acuta, i valori della potenza media sono stati valutati durante i 2 secondi immediatamente precedenti la stimolazione optogenetica (baseline) e nei 2 secondi immediatamente successivi alle risposte di stimolazione. Questi valori sono stati normalizzati sottraendo la potenza media di baseline e i valori risultanti sono stati mediati su tutti i canali e su tutti i topi per identificare una differenza di potenza post-stimolazione.
Analisi degli esperimenti di attivazione optogenetica mediata da ChR2. Per l'analisi dell'ampiezza delle esplosioni indotte dal laser, l'EMG grezzo è stato inizialmente segmentato in campioni contenenti 6 secondi di dati: 2 secondi prima della stimolazione, i 2 secondi di stimolazione, e 2 secondi post-stimolazione. L'ispezione visiva ha confermato che i picchi indotti dallo stimolo si verificavano sempre circa 250 ms dopo l'impulso TTL. Le ampiezze dei picchi indotti dallo stimolo sono state valutate come il picco all'interno di una finestra di 20 ms intorno al punto dati 250 ms dopo ciascun impulso TTL. Questi valori sono stati inizialmente normalizzati sottraendo l'ampiezza media del segnale per un determinato campione. Ogni ampiezza normalizzata per ciascun picco è stata quindi mediata su tutti i campioni per ottenere l'ampiezza media per ciascun picco. Il primo picco è stato analizzato separatamente dai successivi 19 picchi poiché era molto più alto rispetto agli altri picchi in tutti gli animali. Tutte le altre medie dei picchi sono state mediamente all'interno di ciascun canale, e quindi i valori dei topi sperimentali sono stati confrontati con quelli ottenuti dai topi di controllo.
Per separare i picchi successivi che si verificavano durante i periodi di riposo, esplosione, o inter-esplosione, abbiamo inizialmente segregato le prove in tre gruppi: riposo, masticazione/rosicchiamento, e altre attività (inclusa la pulizia e le attivazioni muscolari non associate a un comportamento chiaro). Le prove di riposo sono state definite come quelle che non contenevano scoppi mandibolari naturali sopra la soglia né immediatamente prima né subito dopo il periodo di stimolazione. Le prove di masticazione/rosicchiamento e altre attività sono state definite come contenenti alcune stimolazioni durante un'epoca di masticazione o rosicchiamento, o altre attività, come identificato dagli intervalli di tempo registrati manualmente durante le registrazioni comportamentali. Tutte le ampiezze dei picchi successivi per un dato topo e canale durante le prove di riposo sono state mediamente e normalizzate rispetto all'attività di baseline come descritto sopra, risultando in valori medi del picco sopra il baseline per ciascun canale per ciascun topo. Questi valori sono stati mediati per ottenere i valori medi del picco sopra il baseline durante il riposo.
I picchi successivi che si verificavano durante le prove di masticazione/rosicchiamento sono stati separati in picchi di esplosione o picchi inter-esplosione tramite il seguente metodo. È stata generata una matrice booleana per ciascuna prova tale che i punti temporali fossero veri se l'ampiezza EMG era sopra la soglia. Gli intervalli di picco per ciascun picco indotto da ChR2 sono stati definiti come il punto temporale del picco ± 10 ms. Un picco indotto da ChR2 è stato categorizzato come picco di esplosione se il punto temporale immediatamente precedente e/o successivo all'intervallo di picco era vero nella matrice booleana. Tutti gli altri picchi sono stati categorizzati come picchi inter-esplosione. I picchi di esplosione e inter-esplosione sono stati quindi mediamente e normalizzati come descritto sopra per i picchi di riposo.
Risultati Marcatura dei BPNs con lentivirus retrogradi esprimenti la ricombinasi split-intein-mediata split-Cre Abbiamo sviluppato una tecnica che combina lentivirus retrogradi con il sistema di ricombinasi split-Cre mediato da split-intein per marcare i neuroni premotori proiettanti bilateralmente. In breve, i lentivirus pseudotipizzati, confezionati con la glicoproteina di fusione FuG-B2 (S. Kato et al., 2011), possono infettare i neuroni dai terminali assonici e trasportarsi retrogradamente fino al soma. Abbiamo combinato questo lentivirus retrogrado (RG-LV) con un sistema di ricombinasi split-Cre mediato da split-intein sviluppato precedentemente [20] (vedi Materiali e Metodi). Quando la porzione Cre-N del sistema split-Cre è espressa nelle stesse cellule della porzione Cre-C, lo split-intein media la splicing proteico spontanea, risultando in una proteina inteina completa e una ricombinasi Cre funzionale a lunghezza intera [21].
Abbiamo identificato i BPNs che innervano il MoV trigeminale utilizzando questo sistema RG-LV split-Cre in una linea di topi Ai14, che esprime tdTomato sotto il controllo di Cre (Fig. 1). Abbiamo prima confermato che nessuno dei virus retrogradi esprimenti metà-Cre da solo aveva alcuna attività di ricombinasi iniettando il MoV con il lentivirus retrogrado che esprime Cre-N (RG-LV-Cre-N), o il lentivirus retrogrado che esprime Cre-C (RG-LV-Cre-C) in topi Ai14. Due settimane dopo, non abbiamo osservato alcun segnale di tdTomato nel tronco cerebrale in entrambi i casi (Fig. 1B, e dati non mostrati).
Successivamente abbiamo iniettato RG-LV-Cre-N nel nucleo motorio trigeminale sinistro, e RG-LV-Cre-C nel nucleo motorio trigeminale destro di topi Ai14 (Fig. 1A). Dopo 2 settimane, abbiamo osservato BPNs marcati localizzati principalmente in Rt-MoVII, nella zona peri-trigeminale, così come in SupV (Fig. 1C,D). I BPNs erano distribuiti bilateralmente nel tronco cerebrale. In tre topi Ai14, la proporzione di neuroni marcati in ciascun topo sul lato sinistro del tronco cerebrale non era significativamente diversa da quella sul lato destro (sinistro: 52.3 ± 2.3%, destro: 47.7 ± 2.3%, test t a due code di Student, t(4) = 1.13, p = 0.32). Inoltre, il MoV contiene interneuroni [22], alcuni dei quali proiettano bilateralmente [23], e infatti abbiamo osservato una marcatura sparsa di neuroni all'interno dei confini del nucleo motorio trigeminale (Fig. 1D, freccia). Altre regioni meno frequentemente marcate con questa strategia virale includevano la regione reticolare al livello del nucleo motorio ipoglosso, il nucleo vestibolare mediale, il nucleo spinale trigeminale interpolare, il nucleo sensoriale mesencefalico e la formazione reticolare pontina (dati non mostrati). La marcatura sporadica in queste regioni potrebbe essere causata da variazioni nei siti di iniezione e nell'infezione virale.
Abbiamo esaminato i bersagli di proiezione dei BPNs marcati e abbiamo scoperto che questi neuroni innervano anche il MoVII centrale (Fig. 1E) bilateralmente, che contiene i neuroni motori delle labbra e del volto, e il nucleo motorio ipoglosso (MoXII; Fig. 1F), che contiene i neuroni motori della lingua. Fibre assoniche estese sono state osservate anche nella formazione reticolare caudale e intermedia (Fig. 1F), nota per contenere neuroni premotori per i motoneuroni della mandibola e della lingua [24]. Inoltre, gli assoni marcati erano visibili nel nucleo vestibolare (Fig. 1G), nella formazione reticolare pontina e tegmentale (Fig. 1H), nella formazione reticolare mesencefalica, nel rafe dorsale e nella sostanza grigia periacqueduttale laterale (Fig. 1I).
Analisi neurochimica ed elettrofisiologica rivelano input eccitatori e inibitori dai BPNs ai motoneuroni trigeminali Caratterizzazione neurochimica dei BPNs Abbiamo focalizzato i nostri esperimenti successivi sui BPNs in Rt-MoVII e SupV poiché queste regioni contengono la maggior parte dei BPNs marcati che innervano i motoneuroni della mandibola. È noto che sia SupV che Rt-MoVII contengono neuroni glutammatergici, GABAergici e glicinergici [25]. Alcuni studi che utilizzano traccianti retrogradi o riempimenti di colorante hanno identificato neuroni inibitori in SupV che proiettano a entrambi i nuclei motori trigeminali di sinistra e destra [26], che possono produrre contemporaneamente sia glicina che GABA [27]. Abbiamo condotto esperimenti di ibridazione in situ insieme a immunofluorescenza per determinare se i BPNs fossero prevalentemente inibitori, eccitatori, o una miscela di entrambi (Fig. 2). Abbiamo iniziato iniettando RG-LV-Cre-N nel nucleo motorio trigeminale sinistro e RG-LV-Cre-C nel nucleo motorio trigeminale destro di topi Ai14. Due settimane dopo, abbiamo sondato l'espressione dell'mRNA utilizzando una sonda vGluT2, una sonda GlyT2 o una sonda mista GAD1/GAD2 insieme all'immunoistochimica per identificare i BPNs. I BPNs di SupV e Rt-MoVII erano prevalentemente glutammatergici (SupV, 59.2 ± 2.8%, n = 8 sezioni, 2 sezioni/topo; Rt-MoVII, 67.4 ± 2.6%, n = 8 sezioni, 2 sezioni/topo; Fig. 2A,D,G). Sottogruppi di BPNs di entrambe le regioni erano glicinergici (SupV, 18.3 ± 1.7%, n = 8 sezioni, 2 sezioni/topo; Rt-MoVII, 20.7 ± 0.7%, n = 8 sezioni, 2 sezioni/topo; Fig. 2B,E,G) o GABAergici (SupV, 18.5 ± 4.6%, n = 8 sezioni, 2 sezioni/topo; Rt-MoVII, 22.0 ± 1.5%, n = 8 sezioni, 2 sezioni/topo; Fig. 2C,F,G). Pertanto, i BPNs sia in SupV che in Rt-MoVII consistono in una popolazione mista di neuroni glutammatergici, GABAergici e glicinergici.
5° Clinical case: Spontaneous Electromyographic Activity
Paziente femmina di età 65 anni che riferisce principalmente Dolore Orofacciale (OP)nell'emirato sinistro della faccia ed in particolare un dolore che si irradia dai masseteri alla TMJ ed al muscolo temporale di sinistra. Dopo circa 2 anni da un episodio di perdita improvvisa di coscienza al momento in cui il proprio dentista eseguì una trocleare per paradontologia dell'emigrata inferiore sinistra. Da quel momento iniziarono dolori improvvisi di tipo untorio e poi diffusi a tutta l'emifaccia sinistra anche nella masticazione. I colleghi visto la correlazione con la masticazione ed analizzata seguendo il protocollo RDC definirono la paziente affetta da Temporomandibular Disorders (TMDs)
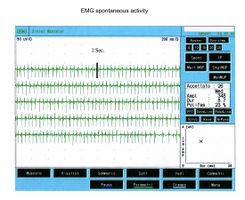
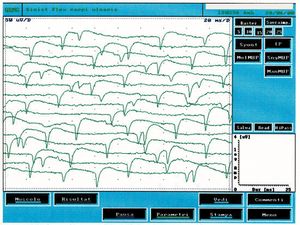
Giunta alla nostra attenzione seguimmo tutti i test gnatologici ( assiografia, Immagini delle ATMs, ed EMG di superficie) che non deponevano per una TMDs ma per un quadro non definito ma sostanzialmente neurologico. Il motivo di questa interpretazione fu proprio l'esecuzione della EMG di superficie che restituì i seguenti risultati. Il quadro elettromiografico dei masseteri è stato determinato seguendo una logica sequenza riportata nella figura 1. Come si può osservare, l’asimmetria di lato dell’attività EMG con elettrodi di superficie dei masseteri in stato di rilassamento (fig.1A) con la mandibola mantenuta in posizione di riposo era tale da richiedere una EMG ad ago del massetere sinistro. L’attività registrata con questa tecnica (fig.1B) ha mostrato una scarica con frequenza stabile di 20 Hz il che presuppose uno studio dell’unità motoria. Lo studio delle unità motorie del massetere sinistro (fig.1C) ha automaticamente selezionato 26 unità motorie di cui sono state analizzate la forma, la durata, gli spikes ed i turns di ciascuna unità. I dati sono riportati nella tabella (fig.1D) Statisticamente si possono rilevare i seguenti parametri: ampiezza media di , una durata di 8.7 mS., il 23% di unità polifasiche. Questo quadro clinico rappresenta il tipico fenomeno fisiopatologico in cui il paziente riferisce dolore ma molto spesso la diagnosi rimane “difficoltà nel rilassamento muscolare”, “ dolore orofacciale atipico” o ancor meglio “fibromialgia” e di conseguenza la terapia farmacologica rimane quella sintomatica. Proprio queste condizioni dovrebbero dare l’opportunità al medico di approfondire le ricerche eseguendo e conoscendo almeno in linee generali le costituenti di una analisi EMG ad ago coassiale, prima di indirizzare la paziente allo specialista neurologo.
Steps EMG ad ago
L’esame EMG dei muscoli scheletrici consiste di quattro step:
- Attività di inserzione quando inserito l’elettrodo ad ago nel muscolo
- Attività spontanea quando il muscolo si trova in condizioni di riposo
- Potenziali di unità motoria evocate da isolate scariche motorie durante una moderata contrazione volontaria
- Reclutamento o pattern interferenziale durante progressivo livello di contrazione
Attività di inserzione
In un soggetto l’attività di inserzione appare come spikes ad alta frequnenza positivi e negativi in un unico gruppo e sono in genere la rappresentazione di un danno delle fibre muscolari o di una stimolazione meccanica dovuta alla penetrazione dell’ago nel muscolo. Nel nostro paziente questa attività si presentò con una durata di 80 mS e fu riferibile ad una quadro di normalità. Da notare, inoltre, il fenomeno dell’attività di placca. Se un elettrodo ad ago viene mantenuto stazionario in un punto del muscolo, i muscoli normali a riposo non mostrano assolutamente nessuna attività elettrica eccetto che nella regione della placca neuromuscolare. Queste consistono di due componenti: bassa ampiezza ( nell’ordine di 10-50 μV) e minima durata (1-2 msec) che all’altoparlante EMG assomigliano al suono delle conchiglie di mare sull’orecchio. Nel nostro caso (fig.1A) l’assenza totale di attività di placca nel massetere destro può essere spiegata dalla registrazione eseguita con elettrodi di superficie che abbattono parzialmente l’energia del segnale ma l’attività registrata sul massetere sinistro, sempre con elettrodi di superficie, ha un ampiezza di . Per lo stesso ragionamento questa attività non deve essere considerata come attività di placca in quanto, come si può osservare in fig. 1B, registrazione del massetere sinistro eseguita con elettrodo coassiale, l’ampiezza è di . A volte gli spikes di potenziali di placca sono indistinguibili nella forma d’onda dai potenziali di fibrillazione i quali anche mostrano una iniziale negatività quando registrati vicino alla placca. Un altro elemento curioso è la somiglianza del modello di scarica tra le scariche dei fusi neuromuscolari e dei potenziali di placca, tanto è vero che alcuni autori [28] ipotizzarono che questi potenziali potessero originare dalle fibre intrafusali muscolari. Rimane ancora aperta la discussione ed il significato elettrofisiologico da dare all’attività elettrica osservabile in fig. 1B.
Attività spontanea:
Nelle prime 2 settimane dopo la denervazione la sensibilità di una fibra muscolare all’acetilcolina (ACh) aumenta fina a 100 volte. Questo fenomeno conosciuto come “ipersensibilità da denervazione” può spiegare le scariche spontanee delle fibre muscolari denervate in risposta a minimi quanti di ACh. Il fatto che l’infusione di curaro blocca i recettori della placca neuromuscolare ma non abolisce la scarica spontanea[29], che la denervazione del muscolo di rana può determinare una aumentata sensibilità alla ACh ma non generare attività spontanea [30]. Questi studi hanno suggerito una ipotesi alternative quella dei cambiamenti lenti dei potenziali di membrana di origine metabolica che possono periodicamente raggiungere un livello critico ed evocare spikes propagati.[31] I fenomeni tipici dell’attività spontanee comprendono, comunque, potenziali di fibrillazione, onde a punta positiva, potenziali di fascicolazione, scariche miochimiche e scariche ripetitive complesse. Senza entrare in argomenti troppo specialistici e considerando la registrazioni elettrofisiologiche del caso clinico è sufficiente trattare le onde a punta positive, la fibrillazione e la fascicolazione. Per onde punta positive si intende scariche a denti di sega che scaricano spontaneamente e continuamente. Questo tipo di attività si trova nelle muscoli denervati ma anche in una varietà di condizioni miogeniche. In figura 2 si può osservare un tipico tracciato di attività spontanea di onde a punta positiva che confrontate con il caso clinico in esame (fig.1B) sono chiaramente diverse. Per fibrillazione si intende, invece, potenziali di durata da e ampiezza di con forme d’onda bifasiche o trifasiche e positività iniziale. Potenziali di fibrillazione triggerati da oscillazioni spontanee nel potenziale di membrana tipicamente scaricano a frequenze di con una media di . Questo fenomeno rappresenta l’attività spontanea di una o più fibre muscolari ed è patognomonico di denervazione anche se può apparire in muscoli sani. La presenza di scariche riproducibili in almeno due differenti aree del muscolo usualmente suggerisce un disordine del motoneurone secondario che include patologie delle cellule delle corna anteriori, radicolopatie, plessopatie, mono e polineuropatie assonali oltre che in certe miopatie.
In figura 3 possiamo osservare un tipico tracciato di attività spontanea da denervazione e confrontarlo con il tracciato in figura 1C in cui si possono notare delle diversità elettrofisiologiche. L’attività spontanea di fibrillazione ha un ampiezza di , la frequenza risulta essere con andamento random mentre nel caso clinico riportato (fig.1C) l’ampiezza era di e la frequenza più alta () ma particolarmente stabile quasi a significare un pacemaker centrale.
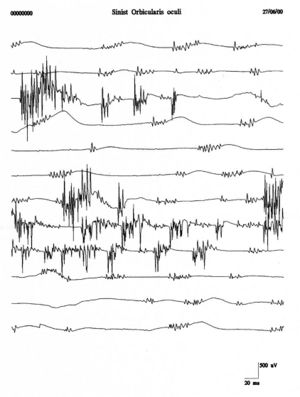
Per evitare confusione terminologica e clinica tra fibrillazione e fascicolazione Danny-Brown e Pennybacker[32] proposero il termine di fascicolazione per descrivere la spontanea contrazione (twitch) di unità motorie. Le fascicolazione, perciò, rappresentano la scarica spontanea di un gruppo di fibre muscolari riferibili all’intera o parziale parte dell’unità motoria. Isolate scariche di una unità motoria con complesse bursts di ripetitive scariche causano movimenti vermicolari della pelle chiamati miochimie.[33]
Scariche ripetitive della stessa unità motoria occorrono in bursts a intervalli regolari di con spikes che scaricano a in ciascun burst. I potenziali di fascicolazione sono tipicamente associati con patologie delle cellule delle corna anteriori ma sono anche osservate in radicolopatie, neuropatie da intrappolamento, e la sindrome di fascicolazione dolorosa muscolare. In figura 4 si può osservare un chiaro esempio di fascicolazioni del muscolo orbicolare dell’occhio che confrontato con i tracciati del caso clinico (fig.1B e C) mostra una totale diversità morfologica e di rappresentazione temporale. Questa diversità rafforzerebbe l’esclusione di una patologia da denervazione.
Potenziali di Unità Motoria
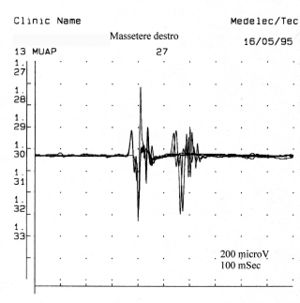
Una unità motoria può essere definita dall’ampiezza, il rise time, dalla durata e dalle fasi come verrà meglio descritto nel capitolo 'Elettromiografia'. L’ampiezza registrata varia ampiamente con la posizione della punta dell’elettrodo relativa alla sorgente di corrente ionica scaricata, per cui un operatore esperto seleziona un potenziale di unità motoria con una rise time di per essere certi della vicinanza con la sorgente. L’ampiezza nel range della normalità va da centinaia di ad alcuni e la durata da . Per i muscoli facciali, in particolare, ci si riferisce ai valori riportati da Buchthal [34] il cui range è per una età massima di anni. I potenziali di unità motoria bifasici o trifasici sono presenti anche in muscoli normali con una media di di unità con o più fasi.
Il numero di unità polifasiche aumentano sia nelle miopatie, neuropatie o nelle patologie del motoneurone. La polifasia indica, dunque, una dispersione temporale dei potenziali di fibra muscolari dentro una unità motoria. In alcune anormalità chiamate doppiette o triplette una unità motoria spara due o tre volte ad una intervallo di tempo molto corto e sono rappresentative di un disturbo metabolico associato ad ipereccitabilità del pool motoneurale. In figura 5 possiamo osservare un tipico tracciato a minima attività volontaria di MUAP polifasico ed una doppietta che rappresenta uno stato di patologia del motoneurone. Confrontando questa registrazione di unità motoria patologica con alcune della fig.1C, ed in particolare la 5,7,13 e 23 con i valori di ampiezza rispettivi durata e e 8.4 possiamo affermare che l’attività registrata sul massetere di sinistra, del caso clinico in questione, non ha nessuna caratteristica elettrofisiologica sovrapponibile ad un quadro di danno del II motoneurone.
Bruxer
The mysterious "muscle tone"
Riassunto
Pochi studi hanno tentato di caratterizzare il dolore orofacciale (OP) associato al bruxismo (esaminare le caratteristiche neurobiologiche e fisiologiche dei muscoli mandibolari). Alcuni casi clinici e studi su piccola scala suggeriscono che alcuni farmaci legati ai sistemi dopaminergico, serotoninergico e adrenergico possono sopprimere o esacerbare il bruxismo. Inoltre, la maggior parte di questi studi farmacologici indica che varie classi di farmaci possono influenzare l'attività muscolare correlata al bruxismo, senza esercitare alcun effetto sullo OP. Pertanto, la sensibilizzazione del sistema nocicettivo del trigemino e l'effetto facilitante sui riflessi da stiramento mandibolare e sull'ipereccitabilità neurale sono fenomeni neurofisiopatogenetici correlabili al dolore nella regione craniofacciale. Tuttavia, fino ad ora, non è stata segnalata alcuna correlazione tra OP, disfunzione dei nuclei mesencefalici e facilitazione della nocicezione trigeminale, ad eccezione di uno studio clinico su un paziente affetto da cavernoma pineale, che ha evidenziato una relativa facilitazione del sistema nocicettivo trigeminale attraverso i riflessi.
Come anticipato, riprenderemo lo stesso linguaggio diagnostico presentato per la paziente Mary Poppins in modo che diventi un modello assimilabile e praticabile, cercheremo di sovrapporlo al presente caso clinico denominato 'Bruxer'. Il soggetto era un uomo di 32 anni affetto da marcato bruxismo notturno e diurno e OP cronico bilaterale prevalente nelle regioni temporoparietali, con maggiore intensità e frequenza a sinistra. .
Introduzione
Come anticipato nel capitolo 'Bruxismo' eviteremo di indicare questo disturbo come correlato esclusivamente dentale e cercheremo una descrizione più ampia ed essenzialmente più neurofisiologica facendo un breve excursus sui fenomeni distonici, sul 'Dolore Orofacciale' e solo successivamente considereremo il fenomeno 'bruxismo' vero e proprio. Successivamente si passerà alla presentazione del caso clinico.
La distonia è una contrazione muscolare involontaria, ripetitiva, prolungata (tonica) o spasmodica (rapida o clonica). Lo spettro delle distonie può coinvolgere varie regioni del corpo. Di interesse per i chirurghi orali e maxillofacciali sono le distonie cranio-cervicali, in particolare la distonia orofacciale (OFD). L'OFD è una contrazione involontaria e prolungata dei muscoli periorbitali, facciali, oromandibolari, faringei, laringei o cervicali.[35] L'OFD può coinvolgere i muscoli masticatori, facciali inferiori e della lingua, che possono causare trisma, bruxismo, apertura o chiusura involontaria della mascella e movimento involontario della lingua
L'eziologia dell'OFD è varia e comprende predisposizione genetica, lesioni al sistema nervoso centrale (SNC), traumi periferici, farmaci, stati metabolici o tossici e malattie neurodegenerative. Tuttavia, nella maggior parte dei pazienti, non è possibile identificare alcuna causa specifica. È stata trovata un'associazione tra disturbi temporomandibolari dolorosi (TMD), emicrania, cefalea di tipo tensivo e bruxismo notturno, sebbene l'associazione fosse significativa solo per l'emicrania cronica. L'associazione tra TMD dolorosi e bruxismo del sonno ha aumentato significativamente il rischio di emicrania cronica, seguita da emicrania episodica e cefalea di tipo tensivo episodica.[36]
Il bruxismo è il disturbo del movimento orale più frequente e può verificarsi nei soggetti durante la veglia e durante il sonno. È probabile che entrambe le forme abbiano eziologie diverse e la loro diagnosi e trattamento richiedono approcci diversi. Il trattamento è indicato quando il bruxismo provoca dolore al sistema masticatorio o porta a danni come l'usura dei denti o fratture di denti, restauri o persino di impianti. Una revisione mirata sull'eziologia del bruxismo[37] ha concluso che esiste un ruolo limitato per i fattori morfologici nell'eziologia del bruxismo, mentre i fattori psicologici (ad esempio lo stress) e i fattori fisiopatologici (ad esempio i disturbi nei sistemi di neurotrasmettitori centrali) sono maggiormente coinvolti.
Il dolore orofacciale (OP), compreso il dolore da TMD, esercita un effetto modulatore sui riflessi di stiramento mandibolare.[38] Studi elettrofisiologici hanno dimostrato che il dolore indotto sperimentalmente da iniezioni di soluzione salina ipertonica al 5% nel muscolo massetere provoca un aumento dell'ampiezza da picco a picco dello scatto mandibolare. Questo effetto facilitatore sembra essere correlato ad una maggiore sensibilità del sistema fusimotorio, che allo stesso tempo provoca rigidità muscolare.[39] Inoltre, numerosi studi su animali sul dolore muscolare indotto sperimentalmente hanno dimostrato che l'attivazione dei nocicettori muscolari influenza notevolmente le proprietà propriocettive dei fusi muscolari attraverso una via neurale centrale[40] e che il lavaggio della sostanza algogena locale provoca un ritorno alla normalità riflessi tendinei.
Tuttavia, pochi studi hanno tentato di caratterizzare il dolore associato al bruxismo (cioè, di esaminare le caratteristiche neurobiologiche e fisiologiche dei muscoli mandibolari). Alcuni casi clinici e studi su piccola scala suggeriscono che alcuni farmaci legati ai sistemi dopaminergico, serotoninergico e adrenergico possono sopprimere o esacerbare il bruxismo. Inoltre, la maggior parte di questi studi farmacologici indica che varie classi di farmaci possono influenzare l'attività muscolare correlata al bruxismo, senza esercitare alcun effetto sull'OP.[41]
Pertanto, la sensibilizzazione del sistema nocicettivo del trigemino e l'effetto facilitante sui riflessi da stiramento mandibolare e sull'ipereccitabilità del SNC sono fenomeni neurofisiopatogenetici correlabili al dolore nella regione craniofacciale. Tuttavia, fino ad ora, non è stata segnalata alcuna correlazione tra OP, disfunzione dei nuclei mesencefalici e facilitazione della nocicezione trigeminale, ad eccezione di uno studio clinico su un paziente affetto da cavernoma pontino, che ha evidenziato una relativa facilitazione del sistema nocicettivo trigeminale attraverso il riflesso delle palpebre.[42]
Caso Clinico
Come anticipato riprenderemo lo stesso linguaggio diagnostico presentato per la paziente Mary Poppins in modo che diventi un modello assimilabile e praticabile, e cercheremo di sovrapporlo al presente caso clinico denominato 'Bruxer'.
Il soggetto era un uomo di 32 anni affetto da marcato bruxismo notturno e diurno e OP cronico bilaterale prevalente nelle regioni temporoparietali, con maggiore intensità e frequenza a sinistra. L'esame neurologico ha mostrato una contrazione dei muscoli masseteri con pronunciata rigidità della mandibola, diplopia e perdita dell'acuità visiva nell'occhio sinistro, nistagmo dello sguardo sinistro con una componente rotatoria, papille con bordi sfocati e positività bilaterale di Babynski e riflessi tendinei policinetici in tutti quattro arti.
a quanto esposto nei precedenti capitoli dalla 'Introduzione' ai capitoli 'Logica del linguaggio medico' e all'ultimo capitolo 'Bruxismo', oltre alla complessità delle argomentazioni e alla vaghezza del linguaggio verbale, potremmo trovare ci troviamo di fronte ad una situazione clinica in cui sembra dominare uno dei contesti considerati.
(sembra ma....)
A differenza del paziente con 'Spasmo Emimasticatorio', il caso clinico del nostro povero 'Bruxer' mostra un fenomeno di sovrapposizione di proposizioni, asserzioni e frasi logiche nel contesto odontoiatrico e neurologico e apparentemente nessuno dei due ottiene un'assoluta e chiara compatibilità e coerenza . Questo ha delle ripercussioni nella clinica in cui tutti gli attori coinvolti (i medici legali) hanno ragione e contestualmente torto, rendendo la conclusione diagnostica inadeguata e pericolosa, ma vediamo passo dopo passo il processo nel suo complesso.
Significato dei contesti
In ambito odontoiatrico avremo le seguenti frasi ed affermazioni alle quali diamo un valore numerico per facilitare il trattamento, ovvero dove indica 'normale' e anomalia e quindi positività del referto:
Referto RM negativo dell'ATM nella Figura 2, Normalità, negatività del referto
Referto assiografico negativo per tracciato condilare destro in Figura 3, Normalità, negatività del referto
Referto assiografico negativo per tracciato condilare sinistro in Figura 4, Normalità, negatività del referto
Diagramma di interferenza EMG simmetrico nella Figura 5, Normalità, negatività del referto
(ed è proprio qui che i contesti entrano in conflitto o meglio i risultati potrebbero non essere così decisivi)
Nel contesto neurologico avremo, perciò, le seguenti frasi ed asserzioni a cui diamo un valore numerico per facilitare la trattazione e cioè dove lo indica 'normalità' e 'anormalità e dunque positività del referto:
Presenza e simmetria dei Potenziali Evocati Motori delle Radici trigeminali in Figure 5, Normalità, negatività del referto
Presenza del jaw jerk con relativa asimmetria di ampiezza in Figure 6 Anormalità, negatività del referto* ( lo * è stato inserito per annotare una ambiguità del referto che andremo a descrivere dettagliatamente nella trattazione clinica)
Periodo silente elettrico e contestuale simmetria Figure 7, Normalità, negatività del referto
Demarcatore di coerenza
Come abbiamo descritto nel capitolo '1° Caso clinico: spasmo emimasticatorio' lo è un peso specifico clinico rappresentativo, complesso da ricercare e sviluppare perché varia da disciplina a disciplina e per patologie, indispensabile per non far collidere le asserzioni logiche e nelle procedure diagnostiche e fondamentale per inizializzare la decrittazione del codice in linguaggio macchina. In sostanza consente di confermare la coerenza di una asserzione contro un altro e viceversa, dando maggior peso alla gravità delle accuse e alla denuncia nel contesto opportuno.
Il peso del demarcazione , quindi, dà maggior significato alle asserzioni più gravi nel contesto clinico da cui derivano e quindi al di là della maggiore o minore positività delle asserzioni o che comunque sono sempre verificate e rispettate, queste devono essere validato in base alla gravità clinica intrinseca moltiplicando la media delle asserzioni e per uno dove indica 'bassa gravità' mentre 'alta gravità'.
Riassumendo nel nostro caso 'Bruxer' abbiamo quindi:
dove
media del valore delle affermazioni cliniche nel contesto odontoiatrico e quindi
media del valore delle affermazioni cliniche nel contesto neurologico e quindi
segnalazione di bassa gravità del contesto dentale
segnalazione di elevata gravità del contesto neurologico
dove il demarcatore di coerenza ' ' definirà il percorso diagnostico come segue
Come si vede nel nostro caso clinico 'Bruxer' abbiamo una leggerissima pendenza diagnostica verso il contesto neurologico che ci permette però di intravedere più una componente neurologica che dentale.
Lavata via la miriade di dati normativi riportati positivamente, che generano conflitto tra contesti, grazie al demarcatore di coerenza abbiamo un quadro molto più chiaro e lineare su cui approfondire l'analisi della funzionalità del Sistema Nervoso Centrale rispetto nel nostro caso clinico 'Bruxer' appare alquanto incuriosito dal basso peso diagnostico derivato dalle asserzioni neurologiche .
Questa cifra media deriva principalmente da un'ipotetica anomalia dell'ampiezza dello scatto della mandibola etichettata con un asterisco (*). Ne parleremo nella sezione dedicata a questo riflesso trigeminale.
Di conseguenza ci si può concentrare sull'intercettazione dei test necessari per decifrare il codice del linguaggio macchina che il SNC invia all'esterno convertito in linguaggio verbale che a prima vista sembrerebbe riguardare una sorta di iperreflessia dei riflessi tendinei. e in particolare lo scatto della mascella..[43][44][45] Per confermare questa ipotetica intuizione è necessario un brainstorming del tipo 'Cognitive Neural Network' abbreviato in 'RNC' presentato per la diagnosi del caso della nostra 'Mary Poppins' nel capitolo 'Codice cifrato: trasmissione efaptica'.
Tuttavia, attraverso questo primo processo diagnostico abbiamo fatto progressi perché, contrariamente al processo codificato nelle discipline odontoiatriche, stiamo intraprendendo un processo neurofisiologico per decifrare il codice del linguaggio macchina del "bruxismo".
Per non appesantire il discorso, tratteremo il secondo step diagnostico del modello Masticationpedia nel capitolo successivo intitolato 'Codice criptato: Ipereccitabilità del sistema trigeminale'.
- ↑ J Neurosci. 2016 Jul 20;36(29):7663–7675. doi: 10.1523/JNEUROSCI.0839-16.2016 Edward Stanek IV 1, Erica Rodriguez 1, Shengli Zhao 1, Bao-Xia Han 1, Fan Wang 1,2,✉
- ↑ Richter e Löscher, 1998; Balasubramaniam e Ram, 2008; Kato et al., 2011; Suzuki e Iwata, 2016
- ↑ Li et al., 1993; Kamogawa et al., 1994
- ↑ Stanek et al., 2014
- ↑ Li et al., 1998; Dong et al., 2011
- ↑ Luo et al., 2001
- ↑ Minkels et al., 1991; Inoue et al., 2002; Takamatsu et al., 2005
- ↑ Kamogawa et al., 1994; Minkels et al., 1995
- ↑ Travers et al., 2005; Paik et al., 2009
- ↑ Ohta e Moriyama, 1986; Castillo et al., 1991
- ↑ Ter Horst et al., 1991; Kolta, 1997
- ↑ Murakami et al., 1989
- ↑ Yamamoto et al., 1989; Inoue et al., 1992
- ↑ Wang et al., 2012
- ↑ Zhang et al., 2015
- ↑ Zhang et al., 2015
- ↑ Takatoh et al., 2013
- ↑ Hasegawa et al., 2007
- ↑ Takatoh et al., 2013
- ↑ Wang et al., 2012
- ↑ Wang et al., 2012
- ↑ McDavid et al., 2006
- ↑ Ter Horst et al., 1990
- ↑ Fay e Norgren, 1997; Kolta et al., 2000; Stanek et al., 2014
- ↑ Travers et al., 2005; Nakamura et al., 2008; Gemba-Nishimura et al., 2010
- ↑ Rokx et al., 1986; Kamogawa et al., 1994
- ↑ Li et al., 2002
- ↑ Partanen JV, Nousiainen U. : End-plate spikes in the electromyography are fusimotor unit potentials. Neurology 1983; 33:039-1043,
- ↑ Axelsson J, Thesleff S.: A study of super-sensitivity of denervated mammalian skeletal muscles. J Physiol (Lond) 1957:149;178-193
- ↑ Miledi R.: The acetylcholine sensitivity of frog musclefibres after complete or partial denervation. J Physiol (Lond) 1960:151;1-23
- ↑ Thesleff S: Fibrillation in denervated mammalian skeletal muscle. In Cukp WL e Ochoa J (eds): Abnormal Nerves and Muscle as Impulse Genertors. Oxford University Press. Oxford 1982, pp 678-694
- ↑ Danny-Brown D, Pennybacker JB.: Fibrillation and fasciculation in voluntary muscle. Brain 1938; 61: 311-332
- ↑ Sindermann F,Conrad B, Jacobi HM, Prochazka VJ.: Unusual properties of repetitive fasciculation Elctroencephalogr Clin Neurophysiol 1973; 35: 173-179
- ↑ Buchtal F: An introduction to electromyography Scandinavian University Books. Copenhagen 1957
- ↑ Thompson PD, Obeso JA, Delgado G, Gallego J, Marsden CD. Focal dystonia of the jaw and differential diagnosis of unilateral jaw and masticatory spasm. J Neurol Neurosurg Psychiatry. 1986;49:651–656. doi: 10.1136/jnnp.49.6.651. [PMC free article][PubMed] [CrossRef] [Google Scholar][Ref list]
- ↑ Fernandes G, Franco AL, Gonçalves DA, Speciali JG, Bigal ME, Camparis CM. Temporomandibular disorders, sleep bruxism, and primary headaches are mutually associated. J Orofac Pain. 2013;27(1):14–20. [PubMed] [Google Scholar] [Ref list]
- ↑ Lobbezoo F. Taking up challenges at the interface of wear and tear. J Dent Res. 2007;86(2):101–103. doi: 10.1177/154405910708600201.[PubMed] [CrossRef] [Google Scholar][Ref list]
- ↑ Dubner R, Ren K. Brainstem mechanisms of persistent pain following injury. J Orofac Pain. 2004;18(4):299–305. [PubMed] [Google Scholar] [Ref list]
- ↑ Wang K, Svensson P, Arendt-Nielsen L. Modulation of exteroceptive suppression periods in human jaw-closing muscles by local and remote experimental muscle pain. Pain. 1999;82(3):253–262. doi: 10.1016/S0304-3959(99)00058-5.[PubMed] [CrossRef] [Google Scholar][Ref list]
- ↑ Ro JY, Capra NF. Modulation of jaw muscle spindle afferent activity following intramuscular injections with hypertonic saline. Pain. 2001;92(1–2):117–127.[PubMed] [Google Scholar] [Ref list]
- ↑ Winocur E, Gavish A, Voikovitch M, Emodi-Perlman A, Eli I. Drugs and bruxism: a critical review. J Orofac Pain. 2003;17(2):99–111. [PubMed] [Google Scholar] [Ref list]
- ↑ Katsarava Z, Egelhof T, Kaube H, Diener HC, Limmroth V. Symptomatic migraine and sensitization of trigeminal nociception associated with contralateral pontine cavernoma. Pain. 2003;105(1–2):381–384.[PubMed] [Google Scholar] [Ref list]
- ↑ S Watanabe , H Mochizuki, I Nakashima, Y Itoyama. A case of primary Sjögren's syndrome with CNS disease mimicking chronic progressive multiple sclerosis.Rinsho Shinkeigaku. 1998 Jul;38(7):658-62.
- ↑ Ibrahim M Norlinah, Kailash P Bhatia, Karen Ostergaard, Robin Howard, Gennarina Arabia, Niall P Quinn. Primary lateral sclerosis mimicking atypical parkinsonism. Mov Disord. 2007 Oct.31;22(14):2057-62. doi: 10.1002/mds.21645.
- ↑ M Yoshida, N Murakami, Y Hashizume, A Takahashi. A clinicopathological study on 13 cases of motor neuron disease with dementia.Rinsho Shinkeigaku.1992 Nov;32(11):1193-202.