7° Clinical case: Brainstem neoplasm in Orofacial pain
In questo capitolo si presenta un caso di assoluta importanza epistemologica nel senso che evidenzia una lacuna nel processo diagnostico basato sull'evidenza based in medicine (EBM). Quest'ultimo termine, infatti, è legato in modo indissolubile alla conoscenza di base scientifica già conosciuto come ( Conoscenza di base).
Lo , ovviamente, dipende dal progresso scientifico e dall'evoluzione tecnologica, metodologica ma anche filosofica in quanto l'interpretazione dei dati clinici in un modello probabilistico classico non può rappresentare appieno la realtà sottostante in quanto le variabili sono dipendetti e compatibili mentre in un modello quantistico le variabili sono indipendenti ed incompatibili. Questo cambiamento paradigmatico ci avrebbe permesso di fare diagnosi differenziale dettagliata e precoce senza aspettare la conoscenza di base sull'argomento specifico della capsaicina sul dolore.
Questo capitolo è stata una pietra miliare che ha indotto l'autore alla realizzazione di Masticationpedia perchè questi casi si possano prendere in tempo giusto per garantire almeno una fine di vita relativamente serena e non in 10 anni di Dolore Orofacciale (OP) facendo la collezione di diagnosi errate.
Introduzione
Il tronco encefalico è la porzione caudale del cervello che collega il diencefalo al midollo spinale e al cervelletto.[1] Il tronco cerebrale media le vie sensoriali e motorie tra il midollo spinale e il cervello e contiene i nuclei dei nervi cranici, il sistema di attivazione reticolare ascendente (ARAS) e i nuclei autonomi. Controlla i riflessi del tronco encefalico e il ciclo sonno-veglia ed è responsabile del controllo autonomo del sistema cardiocircolatorio, respiratorio, digestivo e immunitario. La disfunzione del tronco cerebrale può derivare da vari insulti acuti o cronici, tra cui ictus, malattie infettive, tumori, infiammatorie e neurodegenerative. Nel contesto della malattia critica, il tronco cerebrale può essere suscettibile a vari insulti che possono essere classificati come origine strutturale e non strutturale. La disfunzione del tronco cerebrale può quindi contribuire alla compromissione della coscienza, all'insufficienza cardiocircolatoria e respiratoria e quindi all'aumento della mortalità [2][3][4][5]e soprattutto manifestarsi come dolore orofacciale (OP).Brainstem dysfunction in critically ill patients:
Queste importanti premesse estratte da un interessante articolo di Sarah Benghanem [6] sono dettagli essenziali espressione di una esperienza clinica che ha indotto l'autore del capitolo a riflessioni scientifiche ed epistemologiche sulla tipologia di linguaggio da impiegare nella realizzazione di modelli diagnostici. e di conseguenza a fondare Masticationpedia. Non si può, personale e responsabile asserzione dell'autore del capitoli, seguire pedissequamente un assioma, un protocollo quale lo RDC o quant'altro e rischiare un errore di diagnosi differenziale che può costare la vita di un essere umano. Se c'è una lacuna nel modello, che dimostreremo nel corso dell'implementazione di Masticationpedia, allora va notata come anomalia, analizzata ed eliminata od almeno modificata altrimenti non si tratta di progresso paradigmatico ma soltanto di progresso intensivo.
Presentazione del caso clinico
Era l'anno 1995 quando la paziente femmina di anni 60, che chiameremo con nome di fantasia 'Capsaicina' ( si capirà di seguito il motivo) si presentò alla nostra osservazione riferendo dolore oro facciale diffuso bilaterale in regione dei muscoli temporali ed in regione occipitale, oltre, alla presenza di bruciore della bocca (BMS), da più di 10 anni. Il dolore aveva una durata di ore specialmente notturna e non si presentava ciclicamente. La paziente era portatrice di una riabilitazione protesica fissa in ceramica superiore ed inferiore di vecchia data con varie fratture della struttura ceramica e faccette di usura sui restanti denti naturali. Non furono rilevate, comunque, discrepanze occlusali nella riabilitazione protesica ma fu eseguito, da altri operatori sanitari, una placca di svincolo da impiegare di notte. La paziente riferiva dolore anche con la placca inserita ed è stata considerata, dapprima, affetta da Dolore Orofacciale Atipico (AOP) con forte componente psicosomatica e successivamente, secondo il protocollo RDC, affetta da 'Disordini Temporomandibulari'.
Giunta alla nostra osservazione, come da protocollo Masticationpedia, sono stati eseguiti i principali test gnatologici quali assiografia paraocclusale dei tracciati condilari ed una EMG interferenziale dei muscoli masseteri. Non è stata, in questo caso, richiesta una TC della ATM tanto meno una MR. Presentiamo in modo schematico e rappresentativo riportando alcuni paragrafi esposti nei capitoli precedenti il protocollo Masticationpedia nella sua schematizzazione quale: asserzioni nel contesto odontoiatrico, neurologico ed in fine la conclusione diagnostica attraverso il 'Demarcatore ':
Significatività dei contesti
Per il contesto odontoiatrico avremo le seguenti frasi ed asserzioni a cui diamo un valore numerico per facilitare la trattazione e cioè dove lo indica 'normalità' e 'anormalità e dunque positività del referto:
Tracciato assiografico paraocclusale del condilo di destra negativo in Figura 1, Normalità, positività del referto
Tracciato assiografico paraocclusale del condilo di sinistra negativo in Figura 2, Normalità, positività del referto
Schema di interferenza EMG asimmetrico nella Figura 5, . Normalità, positività del referto
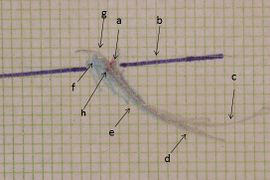
Figura 2: Tracciato assiografico paraocclusale consolare destro: a) Centro asse cerniera, b) piano asse orbitale, c) tracciato protruso, d) tracciato mediotrusivo, e) area dei cicli masticatori mediotrusivi, f) area cicli masticatori laterotrusivi, g) backline laterotrusiva, h) asse cerniera consolare in massima intercuspidazione,
La frase ( contesto odontoiatrico) con un numero di altre asserzioni logicamente compatibili determinano l'unione e la coerenza tra di loro e vengono rappresentate con un formalismo matematico per facilitare la dialettica diagnostica nel seguente modo. che rappresenta la media delle singole asserzioni refertate. La media è stata pensata perchè spesso può capitare che alcuni test diano risposte con refertazione negative a cui dare il valore . Il risultato in questo caso è e contestualmente ne deriva l'affermazione coerente della frase in cui si sostiene che la sintomatologia della paziente 'Capsaicina' non è determinata dalla presenza di una DTMs.
Nel contesto neurologico avremo, perciò, le seguenti frasi ed asserzioni a cui diamo, ovviamente, come per il contesto odontoiatrico, un valore numerico per facilitare la trattazione e cioè dove lo indica 'normalità' e 'anormalità e dunque positività del referto:
bRoot-MEPs simmetrica in ampiezza e latenza in Figure 4, Normalità, positività del referto
Jaw jerk simmetrico in ampiezza ed in latenza in Figure 8, Normalità, positività del referto
Simmetria in durata del periodo silente masseterino in Figure 6, Normalità, positività del referto
Di conseguenza anche a frase con un numero di altre asserzioni logicamente compatibili determinano l'unione e coerenza tra di loro e la rappresentazione formale ssarà simile a quella del contesto odontoiatrico.
con contestuale affermazione coerente della frase in cui si sostiene che la sintomatologia della paziente 'Capsiacina' non evidenzia elettrofisiologicamente nessun elemento che possa indicare una correlazione tra dolore orofacciale e danno neuromotorio.
Demarcatore di Coerenza
Il è un rappresentativo peso specifico clinico, complesso da ricercare e mettere a punto perchè varia da disciplina a disciplina e per patologie, essenziale per non far collidere le asserzioni logiche e nelle procedure diagnostiche e fondamentale per inizializzare la decriptazione del codice macchina. Sostanzialmente permette di confermare la coerenza di una unione rispetto ad una altra e viceversa, dando un peso maggiore alla gravità delle asserzioni e del referto nel contesto appropriato. A volte il medico si trova di fronte ad una serie di refertazioni positive a cui dare il giusto peso, deve considerare la positività di un referto che evidenzia, per esempio, un rimodernamento osteoarticolare della ATM non può avere lo stesso peso di una positività di un referto che conferma un ritardo di latenza di un riflesso trigeminale. Il peso di demarcazione , perciò, dà più significatività alle asserzioni più gravi nel contesto clinico da cui derivano e dunque al di là della positività delle asserzioni oppure che comunque sono sempre verificate e rispettate, queste dovranno essere moltiplicate per un dove lo indica 'Gravità bassa' mentre 'Gravità severa'.
Si potrebbe definire un demarcatore di coerenza come un numero reale compreso fra 0 e 1 nel caso in cui abbiamo più di due refertazioni e quindi un numero vicino allo zero corrisponderebbe ad una refertazione di 'Gravità bassa' mentre con un numero vicino allo uno ad una refertazione di 'Gravità severa'. Questo però è ridondante. Quello che si fa è confrontare a due a due le refertazioni e quindi usare i valori che abbiamo indicato per esprimere la 'Gravità'.
Per ricapitolare abbiamo dunque:
dove
media del valore delle asserzioni cliniche nel contesto odontoiatrico che nel nostro caso in questione è
media del valore delle asserzioni cliniche nel contesto neurologico e dunque
refertazione di bassa gravità del contesto odontoiatrico
refertazione di bassa gravità del contesto neurologico
in cui il 'demarcatore di coerenza ' definirà il percorso diagnostico nel seguente modo
Come vedremo nel corso dell'esposizione dei casi clinici in Masticationpeida ci si troverà di fronte a situazioni cliniche simili in cui sei è in presenza di dolore orofacciale ma i risultati di refertazione nei contesti specialistici risulteranno di bassa gravità tale da annullare il valore discriminate del .
(Rimane il fatto che la paziente continua ad accusare dolore orofacciale ed in particolare con esacerbazione dopo una cena piccante.)
Nei rari ma reali casi clinici in cui si assiste ad un azzeramento del 'Demarcatore ' siamo motivati ad un controllo ancor più vasto ed approfondito ipotizzando patologie gravi [7][8]compreso tumori della testa e del collo che simulano sintomatologie sovrapponibili ad altre patologie. Un grave errore considerare il paziente con tali manifestazioni cliniche e contestuale assenza di anomalie di sistema, come paziente con turbe psicosomatica. Certamente posso coesistere elementi di danno psicofisico ma, se fallisce il 'Demarcatore ', è obbligatorio approfondire la diagnostica. Il cancro della testa e del collo (HNC), infatti, colpisce oltre 890.000 persone ogni anno in tutto il mondo e ha un tasso di mortalità del 50%. A parte la scarsa sopravvivenza, il dolore HNC compromette il mangiare, bere e parlare, riducendo gravemente la qualità della vita. Il diverso fenotipo del dolore nei pazienti (allodinia, iperalgesia e dolore spontaneo) deriva da una combinazione di differenze anatomiche, istopatologiche e molecolari tra i tumori. .[9] La modulazione gliale e immunitaria del microambiente tumorale, come ben spiegato nell'articolo di Ye et al., influenza non solo la progressione del cancro ma anche la segnalazione del dolore tra cui i Potenziali di recettore transitori contenuto nei sistemi somatosensoriali gustativi ne sono un esempio.[10][11]
Per i motivi sovraesposti e per il persistere del OP, della difficoltà nel concludere una diagnosi certa, l'assenza di discrepanze organico-funzionali e l'azzeramento del 'Demarcatore ' si è chiesta una MR dell'encefalo.
L'imaging ha evidenziato una massa di tipo neoplasica con molta probabilità un neurinoma troncoencefalico con invaginazione del frame occipitale. (figura 7 e 8)
(.......lasciando un dubbio, quello della correlazione tra il dolore e la capsaicina come riferito dalla paziente nelle occasioni di una alimentazione piccante.)
Riflessioni e conclusioni
Il sistema gustativo dei mammiferi è costituito da papille gustative, che sono gruppi di 50-100 cellule gustative che si trovano in tutta la cavità orale. Sulla lingua, che è l'argomento centrale del caso clinico 'Capsaicina', le papille gustative si trovano su papille circumvallate, foliate e fungiformi. Le cellule gustative fanno sinapsi con le fibre afferenti dai rami dei nervi cranici facciale (CN VII), glossofaringeo (CN IX) e vago (CN X) che, a loro volta, trasmettono informazioni al sistema nervoso centrale (SNC) attributi di qualità gustativa, intensità e natura edonica. [12][13][14] Le papille gustative sono incorporate in un epitelio squamoso stratificato, che contiene rami somatosensoriali dei nervi cranici trigemino (CN V), glossofaringeo (CN IX) e vago (CN X). Le informazioni provenienti da questi nervi sensoriali generali forniscono informazioni al sistema nervoso centrale sugli stimoli meccanici, termici e dolorosi.[11][15] Gli stimoli dolorosi possono derivare da stimoli meccanici forti o acuti, temperature anormalmente alte o basse o stimoli chimici come la capsaicina, che si trova nei peperoncini e provoca una sensazione di gusto bruciante attraverso l'intervento dei Potenziale di recettore transitorio (TRPs).[10] Questi TRPs sono divisi in sei sottofamiglie tra cui il TRPV1, che a noi interessa per ipotizzare il fenomeno di riacutizzazione algica della paziente' Capsaicina' nell'alimentazione piccante.

TRPV1 e neuroinfiammazione
I TRPV1 costituiscono un sottogruppo distinto di canali cationici non selettivi (Transient Receptor Potential) responsabili di molte risposte cellulari. Sono attivati da diversi stimoli come acidi, protoni extracellulari, alte temperature, tossine di piante e agonisti vanilloidi. I TRPV1 presenti nei mammiferi possono essere considerati dei sensori di sostanze chimiche (capsaicina), termiche (calore) e/o di stimoli nocivi. L'attivazione del TRPV1 porta alla depolarizzazione necessaria alla propagazione dei potenziali d'azione lungo gli assoni dei gangli delle radici dorsali (DRG) dei neuroni che proiettano al midollo spinale e di conseguenza anche nei nuclei trigeminali nocicettivi. Ciò che rende il TRPV1 così critico per la segnalazione del dolore è innegabilmente la sua capacità di trasdurre segnali infiammatori in segnali elettrici con l'attivazione dei canali del sodio e del calcio entrambi voltaggio-dipendenti localizzati a livello dei nocicettori.[16] L'implicazione dei TRPV1 nel dolore patologico ha spinto un accurato studio delle suddette proteine. L’elemento limitativo nella ricerca farmacologica a livello applicativo è stata la peculiarità del canale TRPV1 cioè il suo meccanismo polimodale di attivazione (calore, capsaicina, pH) che ha portato a un alto livello di complessità nella progettazione di un inibitore a modalità specifica.
L'interazione tra neuroni e cellule immunitarie è un fenomeno ben noto.[17] TRPV1 svolge il suo ruolo, anche, nella neuroinfiammazione essendo espresso sia nei neuroni che nelle cellule immunitarie. Un'importanza significativa dovrebbe essere data all'espressione confermata di TRPV1 nella microglia e negli astrociti, cellule che si trovano in prossimità dei neuroni. L'asse neuro-immunitario è il luogo di produzione delle molecole e dei recettori neuroinfiammatori che interagiscono tra i due sistemi e assicurano una risposta complessa agli stimoli esterni (o alle patologie proprie dell'organismo). Si dice che TRPV1 contribuisca all'autofagia della microglia attraverso la sua segnalazione di Ca2+, che porta alla morte cellulare indotta dai mitocondri. Sostanzialmente la TRPV1 è un elemento pro-apoptotico.
Ligandi
Antagonisti
Gli antagonisti bloccano l'attività del TRPV1, riducendo così il dolore. Gli antagonisti identificati includono l'antagonista competitivo capsazepina e l'antagonista non competitivo rosso rutenio. Questi agenti potrebbero essere utili se applicati sistematicamente.[18] Gli antagonisti del TRPV1 hanno mostrato efficacia nel ridurre la nocicezione da modelli di dolore infiammatorio e neuropatico nei ratti.[19] Ciò fornisce la prova che TRPV1 è l'unico recettore della capsaicina. [20]Negli esseri umani, i farmaci che agiscono sui recettori TRPV1 potrebbero essere usati per trattare il dolore neuropatico associato a sclerosi multipla, chemioterapia o amputazione, nonché il dolore associato alla risposta infiammatoria del tessuto danneggiato, come nell'osteoartrosi.[21]
Agonisti
TRPV1 è attivato da numerosi agonisti di origine naturale.[22]Agonisti come la capsaicina e la resiniferatossina attivano TRPV1 e, dopo un'applicazione prolungata, provocano la diminuzione dell'attività di TRPV1 (desensibilizzazione), portando all'attenuazione del dolore attraverso la successiva diminuzione del rilascio mediato da TRPV1 di molecole infiammatorie in seguito all'esposizione a stimoli nocivi.
Un interessante studio del gruppo Tominaga estende l'elenco delle interazioni del TRPV1 anche all’Anoctamina 1 (ANO 1) conosciuta anche come Transmembrane member 16A (TMEM16A)[23] un canale del cloro che di solito è attivato dal Ca2+. Gli autori dimostrano, infatti, che quando il TRPV1 interagisce con il canale ANO1 esso media l’efflusso del Cloro evocando la depolarizzazione (dopo stimolazione della capsaicina) con accresciuta eccitabilità del nocicettore. Tominaga[23] ha evidenziato un chiaro crosstalk sia strutturale sia funzionale tra i TRPV1 a l’ANO1, che interviene nell’azione algogenica della capsaicina.
Questi risultati dimostrano l’importanza dell’omeostasi del cloro nella regolazione dell’eccitabilità dei DRG neuronali cioè dei gangli delle radici dorsali ed ovviamente dei nuclei somatosensoriali trigeminali e nel fenomeno dolore in toto; uno dei nuovi approcci, dunque, dove intervenire nel mitigare l’ipersensibilità dolorosa e l’infiammazione neurogenica.
(....per un danno cronico a livello delle fibre nervose troncoencefaliche con conseguente alterazione dell'omeostasi neuro-immunitaria e contestuale effetto paradosso dell'azione analgesica della capsaicina.)
In questi casi, come premesso in altri capitoli, siamo di fronte ad un profilo epistemologico in cui la conoscenza di base, ciò che abbiamo chiamato (Knowledge Base) corrisponde ad un limite temporale dell'informazione scientifica e di conseguenza grave difficoltà della diagnosi differenziale.Abbiamo dovuto aspettare ben 12 anni per giungere ad una conclusione ezipatogenetica soprascritta dal 1995 periodo in cui la paziente 'Capsaicina' era in cura al 2007 in cui una ricerca ha dato gli elementi per sospettare della presenza di un danno organico neurologico con manifestazioni di dolore e bruciore della bocca[24] La sindrome della bocca urente (BMS) è spesso una condizione di dolore cronico e intrattabile idiopatico, che colpisce l'1,5-5,5% delle donne di mezza età e anziane. Abbiamo studiato il calore e il recettore della capsaicina TRPV1, e il suo fattore di crescita del nervo regolatore (NGF), in BMS. I pazienti con BMS (n=10) e i controlli (n=10) sono stati valutati per i punteggi del dolore alla capsaicina al basale e post-topico e le loro biopsie della lingua sono state immunocolorate per TRPV1, NGF e marcatori nervosi strutturali neurofilamento e periferia. Le fibre nervose che penetrano nell'epitelio erano meno abbondanti nel BMS (p<0,0001), indicando una neuropatia delle piccole fibre. Le fibre TRPV1-positive erano complessivamente significativamente aumentate nel BMS (p=0,0011), così come le fibre NGF (p<0,0001) e la colorazione NGF delle cellule epiteliali basali (p<0,0147). C'era una correlazione significativa tra il punteggio del dolore basale e le fibre TRPV1 (p=0,0143) e NGF (p=0,0252). È stata osservata una correlazione significativa tra il dolore basale e post-capsaicina (p=0,0006).
(Con questo caso clinico abbiamo dimostrato la anomalia che dovrebbe rappresentare una crisi del paradigma attuale e proporne uno nuovo.)
- ↑ Hurley RA, Flashman LA, Chow TW, Taber KH. The brainstem: anatomy, assessment, and clinical syndromes. J Neuropsychiatry Clin Neurosci. 2010;22(1):iv. doi: 10.1176/jnp.2010.22.1.iv.
- ↑ Annane D, Trabold F, Sharshar T, Jarrin I, Blanc AS, Raphael JC, et al. Inappropriate sympathetic activation at onset of septic shock: a spectral analysis approach. Am J Respir Crit Care Med août. 1999;160(2):458–465. doi: 10.1164/ajrccm.160.2.9810073.
- ↑ Sharshar T, Porcher R, Siami S, Rohaut B, Bailly-Salin J, Hopkinson NS, et al. Brainstem responses can predict death and delirium in sedated patients in intensive care unit. Crit Care Med août. 2011;39(8):1960–1967. doi: 10.1097/CCM.0b013e31821b843b.
- ↑ Sharshar T, Gray F, Lorin de la Grandmaison G, Hopkinson NS, Ross E, Dorandeu A, et al. Apoptosis of neurons in cardiovascular autonomic centres triggered by inducible nitric oxide synthase after death from septic shock. Lancet Lond Engl. 2003;362(9398):1799–1805. doi: 10.1016/S0140-6736(03)14899-4.
- ↑ Mazeraud A, Pascal Q, Verdonk F, Heming N, Chrétien F, Sharshar T. Neuroanatomy and physiology of brain dysfunction in sepsis. Clin Chest Med. 2016;37(2):333–345. doi: 10.1016/j.ccm.2016.01.013.
- ↑ Benghanem S, Mazeraud A, Azabou E, Chhor V, Shinotsuka CR, Claassen J, Rohaut B, Sharshar T. Brainstem dysfunction in critically ill patients. Crit Care. 2020 Jan 6;24(1):5. doi: 10.1186/s13054-019-2718-9.PMID: 31907011
- ↑ Chloé Gibeili, Arek Sulukdjian, Audrey Chanlon, Nathan Moreau. Unilateral glossodynia as a harbinger of an occult cerebellopontine angle tumour. BMJ Case Report.. 2022 Apr 12;15(4):e249408.doi: 10.1136/bcr-2022-249408.
- ↑ Irappa Madabhavi, Malay Sarkar, K S Sandeep, Mitul Modi. Isolated trigeminal neuralgia: An early weird presentation of carcinoma breast. J Cancer Res Ther. . 2022 Oct-Dec;18(6):1820-1822.doi: 10.4103/jcrt.JCRT_712_20.
- ↑ Advances in Head and Neck Cancer Pain. Ye Y, Jensen DD, Viet CT, Pan HL, Campana WM, Amit M, Boada MD.J Dent Res. 2022 Aug;101(9):1025-1033. doi: 10.1177/00220345221088527. Epub 2022 Apr 13.PMID: 35416080
- ↑ 10.0 10.1 Ramsey, I.S., M. Delling, and D.E. Clapham. 2006. An introduction to TRP channels. Annu Rev Physiol, 68: 619–647.
- ↑ 11.0 11.1 Julius, D. 2013. TRP channels and pain. Annu Rev Cell Dev Biol, 29: 355–584.
- ↑ Gutierrez, R., and S.A. Simon. 2011. Chemosensory processing in the taste-reward pathway. Flavour Fragr J, 26(4): 231–238.
- ↑ Carleton, A., R. Accolla, and S.A. Simon. 2010. Coding in the mammalian gustatory system. Trends Neurosci, 33(7): 326–334.
- ↑ Vincis, R. and A. Fontanini. 2016. A gustocentric perspective to understanding primary sensory cortices. Curr Opin Neurobiol, 40: 118–124
- ↑ Kaneko, Y., and A. Szallasi. 2014. Transient receptor potential (TRP) channels: A clinical perspective. Br J Pharmacol, 171(10): 2474–2507.
- ↑ Bourinet E, Altier C, Hildebrand M E, Trang T, Salter MW, Zamponi GW. Calcium permeable ion channels in pain signaling. Physiol Rev 2014; 94: 81–140.
- ↑ Jacobson A, Yang D, Vella M, Chiu IM (May 2021). "The intestinal neuro-immune axis: crosstalk between neurons, immune cells, and microbes". Mucosal Immunology. 14 (3): 555–565. doi:10.1038/s41385-020-00368-1. PMC 8075967. PMID 33542493.
- ↑ Khairatkar-Joshi N, Szallasi A (January 2009). "TRPV1 antagonists: the challenges for therapeutic targeting". Trends in Molecular Medicine. 15 (1): 14–22. doi:10.1016/j.molmed.2008.11.004. PMID 19097938.
- ↑ Jhaveri MD, Elmes SJ, Kendall DA, Chapman V (July 2005). "Inhibition of peripheral vanilloid TRPV1 receptors reduces noxious heat-evoked responses of dorsal horn neurons in naïve, carrageenan-inflamed and neuropathic rats". The European Journal of Neuroscience. 22 (2): 361–370. doi:10.1111/j.1460-9568.2005.04227.x. PMID 16045489. S2CID 24664751.
- ↑ Story GM, Crus-Orengo L (2008). "Feel the Burn". American Scientist. 95 (4): 326–333. doi:10.1511/2007.66.326. ISSN 0003-0996. Archived from the original on January 19, 2008.
- ↑ Gunthorpe MJ, Szallasi A (2008). "Peripheral TRPV1 receptors as targets for drug development: new molecules and mechanisms". Current Pharmaceutical Design. 14 (1): 32–41. doi:10.2174/138161208783330754. PMID 18220816.
- ↑ Boonen, Brett; Startek, Justyna B.; Talavera, Karel (2016-01-01). Chemical Activation of Sensory TRP Channels. Topics in Medicinal Chemistry. Springer Berlin Heidelberg. pp. 1–41. [1]doi:10.1007/7355_2015_98.
- ↑ 23.0 23.1 Yasunori Takayama, Daisuke Uta, Hidemasa Furue, and Makoto Tominaga. Pain-enhancing mechanism through interaction between TRPV1 and anoctamin 1 in sensory neurons. Proc Natl Acad Sci 2015; 21; 112(16): 5213-5218. doi: 10.1073/pnas.1421507112. Epub 2015 Apr 6.
- ↑ Z Yilmaz, T Renton, Y Yiangou, J Zakrzewska, I P Chessell, C Bountra, P Anand. Burning mouth syndrome as a trigeminal small fibre neuropathy: Increased heat and capsaicin receptor TRPV1 in nerve fibres correlates with pain score. J Clin Neurosci. 2007 Sep;14(9):864-71. doi: 10.1016/j.jocn.2006.09.002. Epub 2007 Jun 19.



![{\displaystyle \delta _{n}=[0|1]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cd35df3912a48e5b0b70d9cd5b2e1bee432c3272)

















![{\displaystyle \gamma _{n}=[0|1]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2f85d0ed73fa3e7903f0321e48668467c1277f4e)















![{\displaystyle \tau =[0|1]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fbdc534cec0dcf1f070a551e40611eb83e8aca25)













