Verschlüsselter Code: Übererregbarkeit des Trigeminussystems
Zusammenfassung
Der 32-jährige Patient, der unter ausgeprägtem nächtlichem und täglichem Bruxismus sowie orofazialem Schmerz (OP) vorwiegend in den temporoparietalen Regionen mit einer höheren Intensität und Häufigkeit auf der linken Seite des Gesichts leidet, unterzog sich dem diagnostischen Modell Masticationpedia, das die Maschinensprache des Zentralnervensystems im Rahmen der "Hyperexitabilität" des Zentralnervensystems mit besonderem Bezug auf den mittleren Hirnstammtrigeminusbereich entschlüsselte. Diese "Hyperexitabilität" wurde durch eine elektrophysiologische Methode namens "Erholungszyklus des inhibitorischen Masseterreflexes" verifiziert, die eine übertriebene Erholung der Ruhephase hervorrief, die durch den zweiten elektrischen Reiz namens "Stimulus-Test" ausgelöst wurde. Dieser neurophysiologische Zustand veranlasste den Arzt, eine MRT des Gehirns zu beantragen, die eine "Pinealis Cavernosa" zeigt. Zusammenfassend ist "Bruxismus" eine Form der funktionellen Instabilität der neuronalen Erregbarkeit und/oder organisch, daher nicht ausschließlich auf die Zahnmedizin bezogen. Die Fortsetzung des Phänomens, seine Intensivierung und die Hartnäckigkeit, es mit zahnärztlichen Behandlungen zu behandeln, ohne den "Zustand" des Systems genauer zu untersuchen, könnte ernsthaft sein und eine ungünstige Prognose haben.
Einleitung
Wir haben daher den Abschnitt des Cognitive Neural Network' erreicht, das als 'RNC' abgekürzt wird und für die Diagnose des Falls unserer 'Mary Poppins' im Kapitel 'Verschlüsselter Code: Ephaptische Übertragung' vorgestellt wurde. Wir werden es erneut als Diagnosemodell vorschlagen, um den Leser mit dem Verfahren vertraut zu machen, das einfach, intuitiv, aber unerlässlich bei klinischen Fällen mit komplexer Diagnose wie unserem Patienten 'Bruxer' ist. Unser Ausgangspunkt ist daher der Endpunkt der Phase vor dem 'RNC', nämlich die diskriminierende Phase der Kontexte ( Kohärenz-Demarker). Das geringe diagnostische Gewicht, das sich aus den neurologischen Aussagen ergibt, bezieht sich tatsächlich nur auf einen bescheidenen Unterschied in der Amplitude des Kieferreflexes. Auch in diesem Fall kann uns das Cognitive Neural Network (CNN) dabei helfen, den Maschinensprachencode zu fokussieren und zu entschlüsseln. Wir folgen daher demselben Verfahren, das bereits ausführlich im Kapitel 'Verschlüsselter Code: Ephaptische Übertragung' beschrieben wurde, und erhalten das folgende Ergebnis:
Bruxism (4398), trigeminal system (29), abnormality ( 5), excitability ( 3)The excitability of the trigeminal motor system in sleep bruxism: a transcranial magnetic stimulation and brainstem reflex study
Diagnostische Sequenzen
1 Schritt: CNN-Sequenz
- -Kohärenz-Demarker: Wie bereits beschrieben, besteht der erste Schritt aus einem Initialisierungsbefehl der Netzwerkanalyse, der sich tatsächlich aus einer vorherigen kognitiven Verarbeitung der Aussagen im zahnärztlichen Kontext und im neurologischen Kontext γn ableitet, denen der '-Kohärenz-Demarker' ein absolutes Gewicht verliehen hat, wodurch der zahnärztliche Kontext effektiv aus dem Prozess eliminiert wird. Aus den neurologischen Aussagen ergibt sich, dass der 'Zustand' des Trigeminusnervensystems in Bezug auf die Amplitude des Kieferreflexes relativ asymmetrisch ist, wobei ein Durchschnitt von vorliegt. Dies erlaubt es nicht, den anfänglichen rein neurologischen Befehl in die Pubmed-Datenbank einzugeben, wie es für den vorherigen klinischen Fall von Mary Poppins durchgeführt wurde. Der Initialisierungsbefehl wird daher 'Bruxismus' sein, der sich auf beide Datensätze (zahnärztlich und neurologisch) bezieht.
- 1st Schleife geöffnet: Dieser "Initialisierungsbefehl" wird daher als anfängliche Eingabe für die Pubmed-Datenbank betrachtet, die mit 4398 klinischen und experimentellen Daten antwortet, die dem Kliniker zur Verfügung stehen. Die Eröffnung der ersten tatsächlichen kognitiven Analyse erfolgt präzise auf der Analyse des ersten Ergebnisses des 'CNN', das 'Bruxismus' entspricht. In dieser Phase, angesichts der Negativität des zahnärztlichen Berichts und der minimalen Positivität des neurologischen Kontexts, wäre es notwendig, eine neurologische Komponente zu identifizieren, für die das 'Das trigeminale System' als erster offener Regelkreis hinzugefügt wird.
- 2st Schleife geöffnet: Der Prozess wird fortgesetzt, indem der Fokus immer mehr auf die Schlüsselwörter gelegt wird, die mit unseren trigeminal-spezifischen Kontextergebnisdaten übereinstimmen, die wir mit einem Begriff 'Abnormalität' vervollständigen sollten. Dieser Begriff wird die 2. offene Schleife mit 5 spezifischen Elementen durchführen. An diesem Punkt sollte man kognitiv den Aufwand betreiben, alle 5 Artikel zu bewerten, um einige klinische oder laboratorische Hinweise extrapolieren zu können, die für die Entschlüsselung des maschinensprachlichen Codes des zentralen Nervensystems erforderlich sind. Die Bewertung der Artikel ergab ein Phänomen, das möglicherweise in einigen Fällen von Bruxismus vorhanden ist, nämlich eine veränderte Erregbarkeit des Trigeminussystems. Daher wurde der Begriff 'Erregbarkeit' in das Netzwerk in der 3. offenen Schleife eingefügt.
- 3st Schleife geöffnet:In dieser Phase lieferten die "Erregbarkeits"-Daten 3 sehr signifikante Artikel zurück, die darauf hinweisen, wie der Erregbarkeitsgrad des trigeminalen Zentralnervensystems durch eine elektrophysiologische Technik namens "Erholungszyklus" des masseterischen inhibitorischen Reflexes getestet werden kann und als rcMIR abgekürzt wird. Offensichtlich wurde im vorliegenden Fall die Schleife des Netzwerks im ersten Artikel geschlossen, in dem diese Methodik erwähnt wird (der letzte Artikel in chronologischer Reihenfolge war unser). Aus diesem Artikel "Die Erregbarkeit des trigeminalen Motorsystems beim Schlafbruxismus: Eine transkranielle Magnetstimulation- und Hirnstammreflexstudie" geht hervor, dass bei Patienten, die Anzeichen und Symptome von nächtlichem Bruxismus (SB) berichtet haben, eine abnorme Erregbarkeit der trigeminalen motorischen Bahnen besteht. Diese erhöhte Erregbarkeit könnte auf eine veränderte Modulation inhibitorischer Hirnstammkreise und nicht auf veränderte kortikale Mechanismen zurückzuführen sein. Die Ergebnisse unterstützen die Idee, dass Bruxismus hauptsächlich zentral vermittelt wird und subkortikale Strukturen einbezieht.
2 Schritt: Erholungszyklus des inhibitorischen Masseter-Reflexes
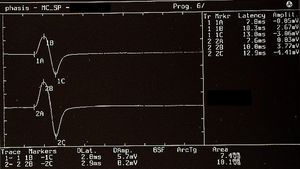
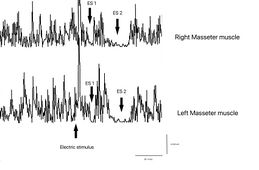
Der Erholungszyklus des inhibitorischen Masseterreflexes (rcMIR) wurde durch die Erzeugung von Paaren von Reizen mit identischen Eigenschaften untersucht, die perkutan mit einem bipolaren elektrischen Stimulator geliefert wurden, der im Bereich des mentalen Nervs des Patienten positioniert war. Die Stimulation erfolgte mit Rechteckimpulsen, die in der Lage waren, einen klar definierten inhibitorischen Reflex zu erzeugen, der aus zwei stillen Perioden (SP) bestand, genannt SP1 und SP2, die durch ein Intervall der Erholung der EMG-"Interposed Activity" (IA) getrennt waren. Der erste Reiz (S1) wurde als Konditionierungsreiz betrachtet und der zweite (S2) als Testreiz. Das Intervall zwischen S1 und S2 wurde auf 150 ms festgelegt.
Der Proband wurde gebeten, die Zähne zusammenzubeißen, um maximale EMG-Aktivität zu erzeugen, und die Kontraktion mindestens 3 Sekunden lang aufrechtzuerhalten, mit visuellem und akustischem Feedback. Nach 60 Sekunden Ruhe wiederholte der Proband die Kontraktion 10 Mal. Das EMG-Signal wurde im direkt gleichgerichteten und gemittelten Modus aufgezeichnet. Die Platzierung der Ableitungselektroden war dieselbe wie die zur Aufzeichnung des Kieferreflexes verwendete, und die Parameter des Vorverstärkers wurden auf eine Zeitfensterbreite von 500 ms, 200 mV pro Teilung und eine Filterbandbreite von 50-1 kHz eingestellt. Die Latenzen und Dauern der SPs und der IA (Abbildung 1) wurden wie folgt berechnet:
- Um die Untersuchung zu vereinfachen, wurde der rcMIR durch elektrische Stimulation nur auf der linken Seite ausgelöst. Die EMG-Reaktionen entsprechen den EMG-Aufzeichnungen des rechten Masseters (Ch1) und des linken Masseters (Ch2). Auf den Spuren zeigt jeder Marker die Kanalnummer an, während die Buchstaben die Sequenzen von Latenzen anzeigen.
- Der Stimulus S1 teilt die Erfassung in Vor- und Nachanalyse auf und erzeugt die SPs und die IA.
- Der Stimulus S2, der 150 ms nach S1 geliefert wird, der als Interstimulus (IS) bezeichnet wird, ruft die zweite SP-Sequenz und die IA hervor.
- Die SPs von S1 und S2 werden automatisch durch die Software bestimmt, die die Marker auf dem ersten und letzten Minimalwert auf den Spuren positioniert, um SP1 und SP2 zu generieren, und gleichzeitig ihre Dauer berechnet. Die IA-Dauer wird zwischen dem letzten Minimalwert von SP1 und dem ersten Minimalwert von SP2 berechnet.
ChatGPT
Bei dem getesteten Probanden war der S2-Reiz in der Lage, beide SPs hervorzurufen, während bei einem normalen Probanden der S2-Reiz normalerweise nur den SP1 oder höchstens einen SP2 von reduzierter Dauer hervorrufen kann. Wie in Tabelle 2 gezeigt, wurde festgestellt, dass die Dauer des durch S2 hervorgerufenen SP1 sehr stabil war, ohne signifikante Unterschiede in der Dauer des durch S1 erzeugten SP1 (Δ= -1ms für Ch1 und Δ= -2 ms für Ch2), während die von S2 am rechten und linken Masseter ausgelösten SP1 (61 ms bzw. 54 ms) länger waren als die von S1 ausgelösten (39 ms bzw. 35 ms). Die Unterschiede betrugen +22 ms für Ch1 (rechter Masseter) und +19 ms für Ch2 (linker Masseter). Folglich zeigte die Dauer der IA deutliche Unterschiede zwischen S2 und S1. Die Dauer der durch S2 hervorgerufenen IA betrug 12 ms gegenüber 23 ms des S1-Reizes für den rechten Masseter (Ch1) und 17 ms gegenüber 30 ms des S1-Reizes für den linken Masseter (Ch2) mit einem Unterschied zwischen den Reaktionen, die durch S2 minus S1 hervorgerufen wurden, von -11 ms bzw. -13 ms.
| Tabella 1 | ||||||
|---|---|---|---|---|---|---|
| Description of the positioning and measurements of the markers
for the recovery cycle of the Masseter Inhibitory Reflex ( rc MIR) |
||||||
| S1 | S2 | |||||
| EMG
traces |
Markers | Onset latency
S1 (msec) |
Markers | Onset latency
S1 (msec) |
||
| 1A | 11 | 13 | 1E | 12 | 12 | |
| Ch1
Right masseter muscle |
1B | 24 | 1F | 24 | ||
| 1C | 47 | 39 | 1G | 37 | 61 | |
| 1D | 86 | 1H | 98 | |||
| 2A | 10 | 16 | 2E | 13 | 14 | |
| Ch2
Left masseter muscle |
2B | 26 | 2F | 27 | ||
| 2C | 56 | 35 | 2G | 44 | 54 | |
| 2D | 91 | 2H | 98 | |||
3rd Step: brain MNR
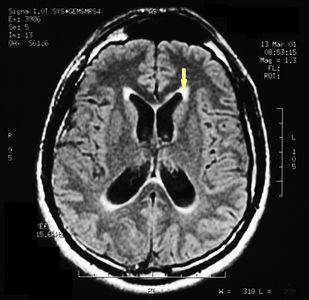
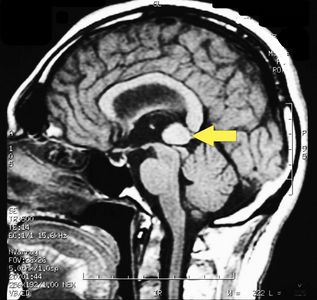
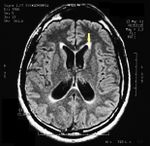
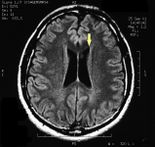
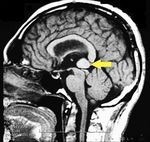
MRI of the brain, using Turbo Spin Echo, Fluid Attenuated Inversion Recovery, and Gradient Echo sequences, was conducted before and after intravenous administration of contrast medium. Results showed the presence of a roundish area of approximately 1.5 cm in diameter located in the vicinity of the quadrigeminal cistern at the level of the pineal gland. There was also a slight dilation of the supratentorial ventricular system, which appeared in the axis and was most evident in the proximity of the temporal horns, with a periventricular rim with a transependymal fluid absorption phenomenon.[1] The signal characteristics of the formation suggested a provisional diagnosis of pineal cavernoma. (Figures 2 and 3)
Final considerations
As we can see from the 'Visual Cognitive gallery', the neurological context is enriched by the contribution deriving from the decryption of the machine language through the rcMIR () test to definitively close the diagnosis with the MR report (). The diagnostic model Masticationpedia not only supports the doctor in complex diagnoses but above all it is an element of implementation of our basic knowledge . It will be useful to represent this cognitive interpretation by correlating it to the images of the assertions of the neurological context.
|
| |||||||
Discussion
The main aim of this study was to electrophysiologically document hyperexcitability of the trigeminal nervous system in a patient affected by pineal cavernoma with pronounced symptoms of OP and bruxism, and who was resistant to any pharmacological or odontological treatment.
We found evidence of activation and peripheral sensitization of the nociceptive fibers, the primary and secondary nociceptive neurons in the CNS, and the endogenous pain control systems, including both the inhibitory and facilitatory processes in our subject.
The concentration of extracellular glutamate in 13 patients affected by cavernous angioma[4] was reported to be increased in comparison with physiological concentrations. High levels of glutamate can cause negative effects on the brain through excitotoxic mechanisms, including degeneration of the superficial layer of the retina in a mouse after repeated administration of glutamate, termed “glutamate excitotoxicity”,[5] resulting from NMDA receptor hyperactivation .[6] In a study in which the trigeminal ganglion neurons were exposed to KCl, the calculated release of glutamate was 10 times greater than the basal level.[7] Further, a significant reduction in the release of potassium-induced glutamate was observed with addition of ω-agatoxin TK, a powerful P/Q calcium channel blocker, while the N-type calcium channel blocker ω-Cgtx conotoxin had a similar effect .[8] Nimodipine, an L-type calcium channel blocker, was also found to reduce the amount of potassium-induced glutamate release.[9] These studies suggest that the P/Q-, N-, and L-type calcium channels each mediate a significant fraction of depolarization-associated glutamate release.
Glutamate release is obviously a much broader and more complex phenomenon. NMDA, kainate, and AMPA ionotrophic receptors, and the metabotropic glutamate receptors, have been found in the superficial lamina of the trigeminal nucleus caudalis in mice.[10] NMDA and AMPA receptor antagonists can block the transmission of the nociceptive trigeminal-vascular signals [11][12] and reduce the high level of c-fos observed in the trigeminal nucleus caudalis following cisternal injection of capsaicin.[13] Furthermore, micro-injections of ω-agatoxin into the ventrolateral area of the periaqueductal gray cause a facilitatory response of nociceptive activity in the trigeminal nucleus caudalis (TNC) activated by tonic electrical stimulation of the supratentorial parietal dura, adjacent to the middle meningeal artery.[14] This response can occur through antinociceptive and/or pronociceptive effects, because the presence of P/Q-type calcium channels is required at the synaptic level for the presynaptic action potentials to couple with the neurotransmitter release processes.[15] Of note, the pre-synaptic afferents in the PAG are positioned on GABAergic inhibitory interneurons and on descending projection neurons. Therefore, the facilitatory effect may be explained by an increased release of GABA, which would indirectly disinhibit the dorsal horn neurons, or by a direct pronociceptive mechanism.[16] These experimental results provide further understanding of the clinical manifestations of pain and central nervous system hyperexcitability found in cases of cerebral cavernous malformations.
Indeed, a blink reflex study on a 38-year-old patient with right hemicranial symptoms associated with a pontine cavernoma affecting the nucleus raphes magnus area revealed a reduction of the pain threshold and a persistent facilitation of the R2 response, with an onset latency difference of 4.4 ms less in the side displaying the symptoms [8]. This confirms a regulatory role for release of neurotransmitters by the nucleus raphes magnus, which exhibits a descending inhibitory control on the TNC [17]and on the entire antinociceptive mesencephalic complex.[18] Our results suggest a hyperexcitability of the trigeminal nervous system in our subject, as follows. First, we evoked a direct response of the trigeminal motor system (bR-MEPs) to provide a value for reference and for amplitude symmetry, as the direct response of the trigeminal motor branch was not affected by any conditioning. A comparison between the jaw jerk responses versus the ipsilateral responses of the R-MEPs showed a much higher amplitude ratio than in normal subjects [19] (Table 1). Therefore, these data indicate the presence of hyperexcitability of the trigeminal system.
The facilitatory effect on the masseter reflex could be indirect. The highest concentration of premotoneurons in the orofacial motor nuclei is found in the bulbar and pontine reticular formations adjacent to the motor nuclei themselves, where these are GABAergic, glycinergic, and glutamatergic-type premotoneurons.[20] In addition, the significant increase of the SP2 recovery cycle from S2 compared with the response from S1 (Table 2) corroborates the hypothesis of hyperexcitability of the trigeminal system. In an in vitro study performed on encephalic slices,[21] intracellular recording of interneurons of the peritrigeminal area (PeriV) surrounding the trigeminal motor nucleus (NVmt) and of the parvocellular reticular formation (PCRt) demonstrated that electrical stimulation of the adjacent areas could evoke both excitatory postsynaptic potentials (EPSPs) and inhibitory postsynaptic potentials (IPSPs). All the EPSPs induced by stimulation of the PeriV, PCRt, and NVmt were shown to be sensitive to ionotropic glutamate receptor antagonists (DNQX and APV), while the IPSPs were sensitive to the GABA and glycine receptor antagonists, bicuculline and strychnine. The cells of this sample showed a long after-hyperpolarization (AHP).
In an electrophysiological study that analyzed a population of neurons and interneurons in the NVmt,[22] three types of AHP were seen: fast, slow, and biphasic. The majority of the motoneurons had a fast AHP (fAHP), whereas most of the interneurons had a slow AHP. The basic properties of these interneurons are similar to the previously described “last-order pre-motoneurons” in the PeriV,[23] suggesting that the interneurons in the NVmt are part of an interneuronal matrix surrounding the NVmt in which the motoneurons are inserted. In this last study, the authors describe the possibility, although rare, of interneurons also having an fAHP.
In our study, the increased duration of the SP2 from S2 invades the IA rather than expanding into the EMG reactivation after the silent period. The afferents for the SP2 descend their intra-axial process along the trigeminal spinal tract and connect with a polysynaptic chain of excitatory interneurons located in the reticular formation at the level of the pontocerebellar junction. The last interneuron in the chain is inhibitory, and sends ipsilateral and controlateral collaterals that ascend medially to the right and left spinal trigeminal complex to reach the trigeminal motoneurons.[24] The interneural sensitization in the rcMIR may be linked to a combination of the excitatory effect of glutamate, with a contribution from the intraneuronal fAHP, and to the disinhibition of the inhibitory processes due to the effect of glycine and GABA.
Overall, our data suggest that certain types of OP, at least those of a central origin, and bruxism are caused by a disruption and homeostatic imbalance of cerebral neurobiochemistry, particularly of the excitatory and inhibitory neurotransmitters in the trigeminal nervous system.
This gives rise to the following questions: Is there a correlation between OP and bruxism, and can bruxism be considered a clinical form of orofacial dystonia?
With respect to the correlation, a distinction should be made between central and peripheral OP on the basis of case history and clinical examination. The muscle discomfort of bruxism is mainly a peripheral phenomenon, resulting from muscle hyperfunction leading to destruction of the myofibrils and release of algogenic substances including myoglobin into bloodstream. By contrast, OP radiating to one or more areas of the face correlated with a clear manifestation of nocturnal or diurnal bruxism could be considered a central type disorder. In these cases, trigeminal electrophysical examinations are highly informative, particularly the rcMIR, blink reflex, JJr, and bR-MEPs, for a differential diagnosis between organic-type lesions of the CNS and functional-type diseases such as TMDs.
Thus, although bruxism and central OP can coexist, they are two independent symptoms, which is why many experimental and clinical studies fail to reach unequivocal conclusions.[25]
It is also possible that bruxism may be a clinical form of dystonia. Our data indicate that bruxism may be a clinical manifestation linked to a CNS neurotransmitter imbalance, and therefore should be considered a subclinical condition of orofacial dystonia or dystonic syndrome. Nevertheless, this phenomenon also appears in a transitory form in children and is resolved with the eruption of mixed dentition.[26][27]
Many studies and diagnostic research protocols, including the Research Diagnostic Criteria (RDC), continue to appear in the field of OP and TMDs, although clear consensus has not yet been reached among the international scientific community.[28] The RDC should consider the patient as affected by a painful syndrome, and should tend towards the definition of a differential diagnosis between organic and/or functional pathologies.[29]
- ↑ Peter H Yang, Alison Almgren-Bell, Hongjie Gu, Anna V Dowling, Sangami Pugazenthi, Kimberly Mackey, Esther B Dupépé, Jennifer M Strahle. Etiology- and region-specific characteristics of transependymal cerebrospinal fluid flow. J Neurosurg Pediatr. 2022 Aug 12;1-11. doi: 10.3171/2022.7.PEDS2246. Online ahead of print.
- ↑ Frisardi G. The use of transcranial stimulation in the fabrication of an occlusal splint. J Prosthet Dent, 1992, DOI: 10.1016/0022-3913(92)90345-b
- ↑ G. Frisardi 1, P. Ravazzani, G. Tognola, F Grandori. Electric versus magnetic transcranial stimulation of the trigeminal system in healthy subjects. Clinical applications in gnathology. J Oral Rehabil.1997 Dec;24(12):920-8. doi: 10.1046/j.1365-2842.1997.00577.x.
- ↑ von Essen C, Rydenhag B, Nystrom B, Mozzi R, van Gelder N, Hamberger A. High levels of glycine and serine as a cause of the seizure symptoms of cavernous angiomas? J Neurochem. 1996;67(1):260–264. [PubMed] [Google Scholar]
- ↑ Lau A, Tymianski M. Glutamate receptors, neurotoxicity and neurodegeneration. Pflugers Arch. 2010;460(2):525–542. doi: 10.1007/s00424-010-0809-1. [PubMed] [CrossRef] [Google Scholar]
- ↑ Meldrum B, Garthwaite J. Excitatory amino acid neurotoxicity and neurodegenerative disease. Trends Pharmacol Sci. 1990;11(9):379–387. doi: 10.1016/0165-6147(90)90184-A. [PubMed] [CrossRef] [Google Scholar]
- ↑ Xiao Y, Richter JA, Hurley JH. Release of glutamate and CGRP from trigeminal ganglion neurons: role of calcium channels and 5-HT1 receptor signaling. Mol Pain. 2008;4:12. doi: 10.1186/1744-8069-4-12. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ McCleskey EW, Fox AP, Feldman DH, Cruz LJ, Olivera BM, Tsien RW, Yoshikami D. Omega-conotoxin: direct and persistent blockade of specific types of calcium channels in neurons but not muscle. Proc Natl Acad Sci U S A. 1987;84(12):4327–4331. doi: 10.1073/pnas.84.12.4327. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Hockerman GH, Johnson BD, Abbott MR, Scheuer T, Catterall WA. Molecular determinants of high affinity phenylalkylamine block of L-type calcium channels in transmembrane segment IIIS6 and the pore region of the alpha1 subunit. J Biol Chem. 1997;272(30):18759–18765. doi: 10.1074/jbc.272.30.18759. [PubMed] [CrossRef] [Google Scholar]
- ↑ Tallaksen-Greene SJ, Young AB, Penney JB, Beitz AJ. Excitatory amino acid binding sites in the trigeminal principal sensory and spinal trigeminal nuclei of the rat. Neurosci Let. 1992;141(1):79–83. doi: 10.1016/0304-3940(92)90339-9. [PubMed] [CrossRef] [Google Scholar]
- ↑ Storer RJ, Goadsby PJ. Trigeminovascular nociceptive transmission involves N-methyl-D-aspartate and non-N-methyl-D-aspartate glutamate receptors. Neuroscience. 1999;90(4):1371–1376. doi: 10.1016/S0306-4522(98)00536-3. [PubMed] [CrossRef] [Google Scholar]
- ↑ Goadsby PJ, Classey JD. Glutamatergic transmission in the trigeminal nucleus assessed with local blood flow. Brain Res. 2000;875(1–2):119–124. [PubMed] [Google Scholar]
- ↑ Waeber C, Moskowitz MA, Cutrer FM, Sanchez Del Rio M, Mitsikostas DD. The NMDA receptor antagonist MK-801 reduces capsaicin-induced c-fos expression within rat trigeminal nucleus caudalis. Pain. 1998;76(1–2):239–248. [PubMed] [Google Scholar]
- ↑ Knight YE, Bartsch T, Kaube H, Goadsby PJ. P/Q-type calcium-channel blockade in the periaqueductal gray facilitates trigeminal nociception: a functional genetic link for migraine? J Neurosci. 2002;22(5):RC213. [PMC free article] [PubMed] [Google Scholar]
- ↑ Dunlap K, Luebke JI, Turner TJ. Exocytotic Ca2+ channels in mammalian central neurons. Trends Neurosci. 1995;18(2):89–98. doi: 10.1016/0166-2236(95)93882-X. [PubMed] [CrossRef] [Google Scholar]
- ↑ Pan ZZ, Williams JT, Osborne PB. Opioid actions on single nucleus raphe magnus neurons from rat and guinea-pig in vitro. J Physiol. 1990;427:519–532. [PMC free article] [PubMed] [Google Scholar]
- ↑ Hentall ID. Interactions between brainstem and trigeminal neurons detected by cross-spectral analysis. Neuroscience. 2000;96(3):601–610. doi: 10.1016/S0306-4522(99)00593-X. [PubMed] [CrossRef] [Google Scholar]
- ↑ Jiang M, Behbehani MM. Physiological characteristics of the projection pathway from the medial preoptic to the nucleus raphe magnus of the rat and its modulation by the periaqueductal gray. Pain. 2001;94(2):139–147. doi: 10.1016/S0304-3959(01)00348-7. [PubMed] [CrossRef] [Google Scholar]
- ↑ Cruccu G, Berardelli A, Inghilleri M, Manfredi M. Functional organization of the trigeminal motor system in man. A neurophysiological study. Brain. 1989;112(5):1333–1350. doi: 10.1093/brain/112.5.1333. [PubMed] [CrossRef] [Google Scholar]
- ↑ Li YQ, Takada M, Kaneko T, Mizuno N. GABAergic and glycinergic neurons projecting to the trigeminal motor nucleus: a double labeling study in the rat. J Comp Neurol. 1996;373(4):498–510. doi: 10.1002/(SICI)1096-9861(19960930)373:4<498::AID-CNE3>3.0.CO;2-X. [PubMed] [CrossRef] [Google Scholar]
- ↑ Bourque MJ, Kolta A. Properties and interconnections of trigeminal interneurons of the lateral pontine reticular formation in the rat. J Neurophys. 2001;86(5):2583–2596. [PubMed] [Google Scholar]
- ↑ McDavid S, Verdier D, Lund JP, Kolta A. Electrical properties of interneurons found within the trigeminal motor nucleus. Eur J Neurosci. 2008;28(6):1136–1145. doi: 10.1111/j.1460-9568.2008.06413.x. [PubMed] [CrossRef] [Google Scholar]
- ↑ Kolta A, Westberg KG, Lund JP. Identification of brainstem interneurons projecting to the trigeminal motor nucleus and adjacent structures in the rabbit. J Chem Neuroanat. 2000;19(3):175–195. doi: 10.1016/S0891-0618(00)00061-2. [PubMed] [CrossRef] [Google Scholar]
- ↑ Ongerboer de Visser BW, Cruccu G, Manfredi M, Koelman JH. Effects of brainstem lesions on the masseter inhibitory reflex. Functional mechanisms of reflex pathways. Brain. 1990;113(3):781–792. doi: 10.1093/brain/113.3.781. [PubMed] [CrossRef] [Google Scholar]
- ↑ Svensson P, Jadidi F, Arima T, Baad-Hansen L, Sessle BJ. Relationships between craniofacial pain and bruxism. J Oral Rehabil. 2008;35(7):524–547. doi: 10.1111/j.1365-2842.2008.01852.x. [PubMed] [CrossRef] [Google Scholar]
- ↑ Watts MW, Tan EK, Jankovic J. Bruxism and cranial-cervical dystonia: is there a relationship? Cranio. 1999;17(3):196–201. [PubMed] [Google Scholar]
- ↑ Monaco A, Ciammella NM, Marci MC, Pirro R, Giannoni M. The anxiety in bruxer child. A case–control study. Minerva Stomatol. 2002;51(6):247–250. [PubMed] [Google Scholar]
- ↑ Lobbezoo F, Visscher CM, Naeije M. Some remarks on the RDC/TMD Validation Project: report of an IADR/Toronto-2008 workshop discussion. J Oral Rehabil. 2010;37(10):779–783. doi: 10.1111/j.1365-2842.2010.02091.x. [PubMed] [CrossRef] [Google Scholar]
- ↑ Frisardi G, Chessa G, Sau G, Frisardi F. Trigeminal electrophysiology: a 2 × 2 matrix model for differential diagnosis between temporomandibular disorders and orofacial pain. BMC Musculoskelet Disord. 2010;11:141. doi: 10.1186/1471-2474-11-141. [PMC free article] [PubMed] [CrossRef] [Google Scholar]