| Other languages: |
Dopo i capitoli precedenti, dovremmo ora essere in grado di riconoscere che, sia nella fisica moderna che nella biologia, un "Sistema Complesso" è un sistema dinamico multi-componente composto da diversi sottosistemi che tipicamente interagiscono tra loro. Tali sistemi sono tipicamente studiati attraverso metodologie di indagine "olistiche" o come computo "totale" dei comportamenti dei singoli sottosistemi insieme alle loro reciproche interazioni; questi possono essere descritti analiticamente attraverso modelli matematici, piuttosto che, in maniera "riduzionista" (cioè scomponendo e analizzando il sistema nelle sue componenti). Tipici dei Sistemi Complessi, sono i concetti di autorganizzazione e di “Comportamento Emergente”. In questo capitolo esporremo alcuni contenuti a favore di questa visione più stocastica e complessa delle funzioni neuromotorie, sensitive ed associative del sistema masticatorio trigeminale.
Considerazioni preliminari
Negli ultimi anni, sviluppi paralleli in diverse discipline si sono concentrati su quella che è stata chiamata "Connettività", un concetto utilizzato per comprendere e descrivere i "Sistemi Complessi". Le concettualizzazioni e le funzionalizzazioni della connettività si sono ampiamente evolute all'interno dei loro confini disciplinari, ma ci sono chiare somiglianze in questo concetto e nella sua applicazione attraverso le discipline. Tuttavia, qualsiasi implementazione del concetto di connettività implica vincoli sia ontologici che epistemologici, che ci portano a chiederci se esiste un tipo o un insieme di approcci di connettività che potrebbero essere applicati a tutte le discipline. In questa recensione, esploriamo quattro sfide ontologiche ed epistemologiche nell'uso della connettività per comprendere i sistemi complessi i varie discipline molto diverse tra loro.
Nel capitolo 'Connettività e Sistemi Complessi' introdurremo infine il concetto di:
- definire l'unità fondamentale per lo studio della connettività;
- scindere la connettività strutturale dalla connettività funzionale;
- comprensione dei comportamenti emergenti;
- misurare la connettività.
Dobbiamo ora considerare il profilo complesso della funzione masticatoria, per poter parlare di “connettività”.[1] Solo in tempi successivi l'importanza della funzione masticatoria è divenuta evidente come Sistema Complesso; diventa evidente per la sua interazione con una moltitudine di altri Centri e Sistemi Nervosi (SNC), anche distanti dal punto di vista funzionale.[2] La funzione neurofisiologiche, infatti, sono sempre state considerata una funzione periferica ed isolata rispetto alla fonetica ed alla masticazione come fossero parte di un altro sistema. A seguito di questa interpretazione, innumerevoli sono stati i punti di vista che si sono concentrati, e tuttora puntano, sulla diagnosi e riabilitazione della Masticazione esclusivamente nei mascellari, escludendo ogni correlazione multistrutturale.
Questo tipo di approccio denota un chiaro 'riduzionismo' nei contenuti del sistema stesso: in biologia, è più realistico considerare la funzionalità di sistemi come i "Sistemi Complessi" che non operano in modo lineare. Questi sistemi utilizzano un approccio stocastico, in cui l'interazione dei vari costituenti genera un "Comportamento emergente" (EB)[3] dello stesso sistema.[4]
Il risultato paradigmatico inverte la tendenza a considerare il sistema masticatorio come un semplice organo cinematico, e va ben oltre la tradizionale procedura meccanicistica della Gnatologia Classica.
Questo aspetto introduce anche un tipo di profilo indeterministico delle funzioni biologiche, in cui la funzione di un sistema si presenta come una rete di molteplici elementi correlati. Questo sistema, oltre ad interpretarne lo Stato, dovrebbe essere triggerato dall'esterno per analizzare la risposta evocata, come è tipico dei sistemi indeterministici.[6]
È, quindi, fondamentale passare da un modello semplice e lineare di clinica odontoiatrica ad un modello Stocastico Complesso di neurofisiologia masticatoria.
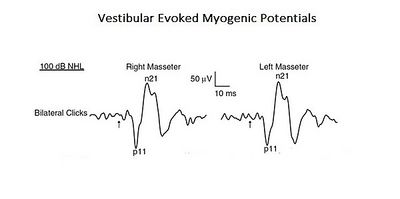
A conferma di questo approccio più complesso e integrato per interpretare le funzioni della masticazione, viene qui presentato uno studio dove emerge il profilo di un "Sistema Complesso Neurale". Nello studio citato è stata analizzata la connessione organica e funzionale del sistema vestibolare con il sistema trigeminale. [7]
Gli stimoli acustici possono evocare risposte riflesse EMG nel muscolo massetere chiamate Vestibular Evoked Myogenic Potentials (VEMPs). Anche se questi risultati sono stati precedentemente attribuiti all'attivazione dei recettori cocleari (suono ad alta intensità), questi possono anche attivare i recettori vestibolari. Poiché studi anatomici e fisiologici, sia negli animali che nell'uomo, hanno dimostrato che i muscoli masseteri sono un bersaglio per gli ingressi vestibolari, gli autori di questo studio hanno rivalutato il contributo vestibolare per i riflessi masseterici. Questo è un tipico esempio di 'Sistema Complesso' di livello base in quanto consiste di due soli sistemi nervosi cranici ma, allo stesso tempo, interagiscono attivando circuiti mono e polisinaptici (Figura 1).
Sarebbe opportuno a questo punto introdurre alcuni argomenti relativi ai concetti sopra citati, che chiarirebbero la logica del progetto Masticationpedia. Questo introdurrebbe i capitoli che sono al centro del progetto.
Quindi l'oggetto è:
Masticazione e processi cognitivi
Negli ultimi anni, la masticazione è stata oggetto di discussione sugli effetti di mantenimento e supporto delle prestazioni cognitive.
Un elegante studio eseguito mediante fMR e tomografia a emissione di positroni (PET) ha dimostrato che la masticazione porta ad un aumento del flusso sanguigno corticale e attiva varie aree della corteccia somatosensoriale, motoria e insulare, nonché lo striato, il talamo e il cervelletto. La masticazione subito prima di eseguire un compito cognitivo aumenta i livelli di ossigeno nel sangue (BOLD del segnale fMR) nella corteccia prefrontale e nell'ippocampo, importanti strutture coinvolte nell'apprendimento e nella memoria, migliorando così il compito prestazionale.[8] Precedenti studi epidemiologici hanno dimostrato che un numero ridotto di denti residui, l'uso incongruo di protesi e uno sviluppo limitato della forza mandibolare sono direttamente correlati allo sviluppo della demenza, supportando ulteriormente l'idea che la masticazione contribuisce al mantenimento delle funzioni cognitive.[9]
Un recente studio ha fornito ulteriori evidenze a sostegno dell'interazione tra processi masticatori, apprendimento e memoria, soffermandosi sulla funzione dell'ippocampo essenziale per la formazione di nuovi ricordi.[10] Una disarmonia occlusale, come la perdita dei denti e l'aumento della dimensione occlusale verticale, provoca bruxismo o dolore ai muscoli masticatori e disturbi temporo-mandibolari (DTM).[11][12] Quindi, per descrivere la funzione alterata dell'ippocampo in una situazione ridotta o anormale nella funzione masticatoria, gli autori hanno utilizzato un modello animale (topi) chiamato "Molarless Senescence-Accelerated Prone" (SAMP8) al fine di fare un parallelismo sull'uomo.
Nei topi SAMP8, a cui è stata modificata l'occlusione, l'aumento della dimensione verticale occlusale di circa 0,1 mm con materiali dentali ha mostrato che la disarmonia occlusale interrompe l'apprendimento e la memoria. Questi animali hanno mostrato un deficit dipendente dall'età nell'apprendimento spaziale nell'acqua di Morris.[13][14] Aumentando la dimensione verticale del morso nei topi SAMP8 diminuisce il numero di cellule piramidali[14] e il numero delle loro spine dendritiche.[15] Aumenta inoltre l'ipertrofia e l'iperplasia proteica fibrillare acida negli astrociti nelle regioni dell'ippocampo CA1 e CA3.[16] Nei roditori e nelle scimmie, disarmonie occlusali indotte attraverso un aumento della dimensione verticale con incrementi acrilici sugli incisivi[17][18] o l'inserimento di un bite nella mascella sono associati a livelli aumentati di cortisolo urinario e livelli plasmatici elevati di corticosterone, suggerendo che anche la disarmonia occlusale è una fonte di stress.
A sostegno di questa nozione, i topi SAMP8 con deficit di apprendimento mostrano un marcato aumento dei livelli plasmatici di corticosterone[12] e sottoregolazione di GR e GRmRNA dell'ippocampo. La disarmonia occlusale colpisce anche l'attività catecolaminergica. L'alternanza della chiusura del morso mediante l'inserimento di un bite-plane in acrilico sugli incisivi inferiori porta ad un aumento dei livelli di dopamina e noradrenalina nell'ipotalamo e nella corteccia frontale[17][19] e una diminuzione della tiroxinaidrossilasi, del ciclocloridrato GTP e della serotonina immunoreattiva nella corteccia cerebrale e il nucleo caudato, nella sostanza nigra, nel locus ceruleus e nel nucleo del rafe dorsale, che sono simili ai cambiamenti cronici indotti dallo stress.[20] Questi cambiamenti nei sistemi catecolaminergico e serotoninergico, indotti da disarmonie occlusali, influiscono chiaramente sull'innervazione dell'ippocampo. Le condizioni di aumento della dimensione verticale alterano la neurogenesi e portano all'apoptosi nel giro ippocampale diminuendo l'espressione del cervello ippocampale derivato da fattori neurotrofici: tutto ciò potrebbe contribuire ai cambiamenti nell'apprendimento osservato negli animali con disarmonia occlusale.[10]
Tronco encefalico e masticazione
Il distretto del tronco cerebrale è un'area di collegamento che collega i centri superiori del cervello, il cervelletto e il midollo spinale e fornisce la principale innervazione sensoriale e motoria del viso, della testa e del collo attraverso i nervi cranici.
Questo gioca un ruolo determinante nella regolazione della respirazione, locomozione, postura, equilibrio, eccitazione (incluso controllo intestinale, vescica, pressione sanguigna e frequenza cardiaca). È responsabile della regolazione di numerosi riflessi, tra cui la deglutizione, la tosse e il vomito. Il tronco cerebrale è controllato dai centri cerebrali superiori delle regioni corticali e sottocorticali, inclusi i nuclei dei gangli della base e il diencefalo, nonché dai circuiti di feedback del cervelletto e del midollo spinale. La neuromodulazione può essere ottenuta con la modalità "classica" dei neurotrasmettitori glutammatergici e del GABA (acido gamma-amino butirrico) attraverso un'eccitazione primaria e un'inibizione della "rete anatomica", ma può essere ottenuta anche attraverso l'uso di trasmettitori che agiscono sulle proteine G . Questi neuromodulatori includono la monoamina (serotonina, noradrenalina e dopamina) acetilcolina, come anche il glutammato e il GABA. Inoltre, non solo i neuropeptidi e le purine agiscono come neuromodulatori: lo fanno anche altri mediatori chimici, come i Fattori di Crescita che potrebbero avere azioni simili.[21]
La rete neurale sopra descritta non si esaurisce con l'unica correlazione tra i centri somatosensoriali del trigemino e altre aree motorie, ma si allontana anche nei processi amigdaloidei attraverso una correlazione con l'area del tronco cerebrale del trigemino. L'amigdala diventa attiva dalla paura, svolgendo un ruolo importante nella risposta emotiva a situazioni pericolose per la vita. Quando i topi da laboratorio si sentono minacciati, rispondono mordendo ferocemente. La forza del morso è regolata dai nuclei motori del sistema trigeminale e del tronco encefalico trigeminale Me5. Il Me5 trasmette segnali propriocettivi dai muscoli masticatori e dai legamenti parodontali ai nuclei motori del trigemino. Le proiezioni del nucleo dell'amigdaloide centrale (ACe) inviano connessioni al nucleo motorio del trigemino e alla formazione premotoria reticolare e direttamente al Me5.
A conferma di ciò, in uno studio condotto sui topi, i neuroni nel nucleo centrale dell'Amigdaloide (ACe) sono stati marcati dopo l'iniezione di un tracciante retrogrado (Fast Blue), nel nucleo caudale del Me5, indicando che gli Amigdaloiani inviano proiezioni dirette al Me5, e suggeriscono che l'amigdala regoli la forza del morso modificando l'attività neuronale nel Me5 attraverso una facilitazione neurale.[22]
La modifica dei rapporti occlusali può alterare le funzioni somatosensoriali orali e i trattamenti riabilitativi del sistema masticatorio dovrebbero ripristinare le funzioni somatosensoriali. Tuttavia, non è chiaro il motivo per cui alcuni pazienti non riescono ad adattarsi al restauro masticatorio e permangono disturbi sensomotori. A prima vista, sembrerebbero cambiamenti strutturali, non solo funzionali. La corteccia motoria primaria del viso è coinvolta nella generazione e nel controllo dei movimenti orofacciali e degli input sensoriali o delle funzioni motorie alterate, che possono portare a cambiamenti neuroplastici nell'area corticale M1.[10][23]
Conclusive Considerations
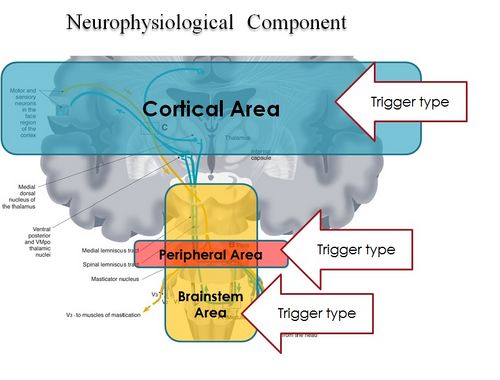
In conclusion, it is clear from the premise, that the Masticatory system should be considered not certainly as a system simply governed by mechanical laws, but as a "Complex System" of indeterministic type, where one can quantify the "Emerging Behavior" only after stimulating it and then analysing the response evoked (Figure 2). The Neuronal System also dialogues with its own encrypted machine language (potential action and ionic currents) and, therefore, it is not possible to interpret the symptoms referred to by the patient through natural language.
This concept deepens knowledge of the state of health of a system because it elicits an answer from inside the network — or, at least, from a large part of it — by allocating normal and/or abnormal components of the various nodes of the network. In scientific terms, it also introduces a new paradigm in the study of the Masticatory System: the "Neuro Gnathology Function", that we will meet in due course in the chapter ‘Extraordinary Science’.
Currently, the interpretation of the Emergent Behavior of the Mastication system in dentistry is performed only by analysing the voluntary valley response, through electromyographic recordings ‘EMG interference pattern’, and radiographic and axographic tests (replicators of mandibular movements). These can only be considered descriptive tests.
The paradigm of gnathological descriptive tests faced a crisis years ago: despite an attempt to reorder the various axioms, schools of thought, and clinical-experimental strictness in the field of Temporomandibular Disorders (through the realization of a protocol called "Research Diagnostic Criteria" RDC/TMDs), this paradigm has not yet come to be accepted because of the scientific-clinical incompleteness of the procedure itself. It deserves, however, a particular reference to the RDC/TMD, at least for the commitment that was carried out by the authors and, at the same time, to scroll the limits.
The RDC/TMD protocol was designed and initialized to avoid the loss of ‘standardized diagnostic criteria’ and evaluate a diagnostic standardization of empirical data at disposition. This protocol was supported by the National Institute for Dental Research (NIDR) and conducted at the University of Washington and the Group Health Corporative of Puget Sound, Seattle, Washington. Samuel F. Dworkin, M. Von Korff, and L. LeResche were the main investigators[24].
To arrive at the formulation of the protocol of the ‘RDC’, a review of the literature of diagnostic methods in rehabilitative dentistry and TMDs, and subjected to validation and reproducibility, has been made. Taxonomic systems were taken into account by Farrar (1972)[25][26], Eversole and Machado (1985)[27], Bell (1986)[28], Fricton (1989)[29], American Academy of Craniomandibular Disorders (AACD) (1990)[30], Talley (1990)[31], Bergamini and Prayer-Galletti (1990)[32], Truelove (1992)[33], and compared them by granting them to a set of assessment criteria. The evaluation criteria were split into two categories that involve methodological considerations and clinical considerations.
The end of the research came to the elimination, due to a lack of scientific and clinical validation, of a series of instrumental diagnostic methodologies like interferential electromyography (EMG Interference Pattern), Pantography, X-ray diagnostics, etc. These will be described in more detail in the next editions of Masticationpedia. This first target was, therefore, the scientific request of an "objective data"' and not generated by opinions, schools of thought or subjective evaluations of the phenomenon’. During the Workshop of the International Association for Dental Research (IADR) of 2008, preliminary results of the RDC/TMDs were presented in the endeavour to validate the project.
The conclusion was that, to achieve a review and simultaneous validation of [RDC/TMD], it is essential that the tests should be able to make a differential diagnosis between TMD patients with pain and subjects without pain, and above all, discriminate against patients with TMD pain from patients with orofacial pain without TMD.[34]
This last article, reconsidering pain as an essential symptom for the clinical interpretation, puts all the neurophysiological phenomenology in the game, not just this. To move more easily at ease in this medical branch, a different scientific-clinical approach is required, one that widens the horizons of competence in fields such as bioengineering and neurobiology.
It is, therefore, essential to focus attention on how to take trigeminal electrophysiological signals in response to a series of triggers evoked by an electrophysiological device, treating data and determining an organic-functional value of the trigeminal and masticatory systems as anticipated by Marom Bikson and coll. in their «Electrical stimulation of cranial nerves in cognition and disease».
We should think of a system that unifies the mastication and neurophysiological functions by introducing a new term: "Neuro-Gnathological Functions"
which will be the object of a dedicated chapter.
Bibliography
- ↑ Turnbull L, Hütt MT, Ioannides AA, Kininmonth S, Poeppl R, Tockner K, Bracken LJ, Keesstra S, Liu L, Masselink R, Parsons AJ, «Connectivity and complex systems: learning from a multi-disciplinary perspective», in Appl Netw Sci, 2018».
PMID:30839779 - PMCID:PMC6214298
DOI:10.1007/s41109-018-0067-2
This is an Open Access resource! - ↑ Viggiano A, Manara R, Conforti R, Paccone A, Secondulfo C, Lorusso L, Sbordone L, Di Salle F, Monda M, Tedeschi G, Esposito F, «Mastication induces long-term increases in blood perfusion of the trigeminal principal nucleus», in Neuroscience, Elsevier, 2015».
PMID:26477983
DOI:10.1016/j.neuroscience.2015.10.017 - ↑ Florio T, Capozzo A, Cellini R, Pizzuti G, Staderini EM, Scarnati E, «Unilateral lesions of the pedunculopontine nucleus do not alleviate subthalamic nucleus-mediated anticipatory responding in a delayed sensorimotor task in the rat», in Behav Brain Res, 2001».
PMID:11704255
DOI:10.1016/s0166-4328(01)00248-0 - ↑ de Boer RJ, Perelson AS, «Size and connectivity as emergent properties of a developing immune network», in J Theor Biol, 1991».
PMID:2062103
DOI:10.1016/s0022-5193(05)80313-3 - ↑ Iyer-Biswas S, Hayot F, Jayaprakash C, «Stochasticity of gene products from transcriptional pulsing», in Phys Rev E Stat Nonlin Soft Matter Phys, 2009».
PMID:19391975
DOI:10.1103/PhysRevE.79.031911
This is an Open Access resource! - ↑ Lewis ER, MacGregor RJ, «On indeterminism, chaos, and small number particle systems in the brain», in J Integr Neurosci, 2006».
PMID:16783870
DOI:10.1142/s0219635206001112 - ↑ Deriu F, Ortu E, Capobianco S, Giaconi E, Melis F, Aiello E, Rothwell JC, Tolu E, «Origin of sound-evoked EMG responses in human masseter muscles», in J Physiol, 2007».
PMID:17234698 - PMCID:PMC2075422
DOI:10.1113/jphysiol.2006.123240
This is an Open Access resource! - ↑ Yamada K, Park H, Sato S, Onozuka M, Kubo K, Yamamoto T, «Dynorphin-A immunoreactive terminals on the neuronal somata of rat mesencephalic trigeminalnucleus», in Neurosci Lett, Elsevier Ireland, 2008».
PMID:18455871
DOI:10.1016/j.neulet.2008.04.030 - ↑ Kondo K, Niino M, Shido K, «Dementia. A case-control study of Alzheimer's disease in Japan - significance of life-styles», 1994».
PMID:7866485
DOI:10.1159/000106741 - ↑ 10.0 10.1 10.2 Kubo KY, Ichihashi Y, Kurata C, Iinuma M, Mori D, Katayama T, Miyake H, Fujiwara S, Tamura Y, «Masticatory function and cognitive function», in Okajimas Folia Anat Jpn, 2010».
PMID:21174943
DOI:10.2535/ofaj.87.135
This is an Open Access resource! - ↑ Christensen J, «Effect of occlusion-raising procedures on the chewing system», in Dent Pract Dent Rec, 1970».
PMID:5266427 - ↑ 12.0 12.1 Ichihashi Y, Arakawa Y, Iinuma M, Tamura Y, Kubo KY, Iwaku F, Sato Y, Onozuka M, «Occlusal disharmony attenuates glucocorticoid negative feedback in aged SAMP8 mice», in Neurosci Lett, 2007».
PMID:17928141
DOI:10.1016/j.neulet.2007.09.020 - ↑ Arakawa Y, Ichihashi Y, Iinuma M, Tamura Y, Iwaku F, Kubo KY, «Duration-dependent effects of the bite-raised condition on hippocampal function in SAMP8 mice», in Okajimas Folia Anat Jpn, 2007».
PMID:18186225
DOI:10.2535/ofaj.84.115
This is an Open Access resource! - ↑ 14.0 14.1 Kubo KY, Yamada Y, Iinuma M, Iwaku F, Tamura Y, Watanabe K, Nakamura H, Onozuka M, «Occlusal disharmony induces spatial memory impairment and hippocampal neuron degeneration via stress in SAMP8 mice», in Neurosci Lett, Elsevier Ireland, 2007».
PMID:17207572
DOI:10.1016/j.neulet.2006.12.020 - ↑ Kubo KY, Kojo A, Yamamoto T, Onozuka M, «The bite-raised condition in aged SAMP8 mice induces dendritic spine changes in the hippocampal region», in Neurosci Lett, 2008».
PMID:18614288
DOI:10.1016/j.neulet.2008.05.027 - ↑ Ichihashi Y, Saito N, Arakawa Y, Kurata C, Iinuma M, Tamura Y, Iwaku F, Kubo KY, «The bite-raised condition in aged SAMP8 mice reduces the expression of glucocorticoid receptors in the dorsal and ventral hippocampus», in Okajimas Folia Anat Jpn, 2008».
PMID:18464530
DOI:10.2535/ofaj.84.137
This is an Open Access resource! - ↑ 17.0 17.1 Areso MP, Giralt MT, Sainz B, Prieto M, García-Vallejo P, Gómez FM, «Occlusal disharmonies modulate central catecholaminergic activity in the rat», in J Dent Res, 1999».
PMID:10371243
DOI:10.1177/00220345990780060301 - ↑ Yoshihara T, Matsumoto Y, Ogura T, «Occlusal disharmony affects plasma corticosterone and hypothalamic noradrenaline release in rats», in J Dent Res, 2001».
PMID:11808768
DOI:10.1177/00220345010800121301 - ↑ Gómez FM, Areso MP, Giralt MT, Sainz B, García-Vallejo P, «Effects of dopaminergic drugs, occlusal disharmonies, and chronic stress on non-functional masticatory activity in the rat, assessed by incisal attrition», in J Dent Res, 1998».
PMID:9649174
DOI:10.1177/00220345980770061001 - ↑ Feldman S, Weidenfeld J, «Glucocorticoid receptor antagonists in the hippocampus modify the negative feedback following neural stimuli», in Brain Res, Elsevier Science B.V., 1999».
PMID:10064785
DOI:10.1016/s0006-8993(99)01054-9 - ↑ Mascaro MB, Prosdócimi FC, Bittencourt JC, Elias CF, «Forebrain projections to brainstem nuclei involved in the control of mandibular movements in rats», in Eur J Oral Sci, 2009, São Paulo, Brazil».
PMID:20121930
DOI:10.1111/j.1600-0722.2009.00686.x - ↑ Shirasu M, Takahashi T, Yamamoto T, Itoh K, Sato S, Nakamura H, «Direct projections from the central amygdaloid nucleus to the mesencephalic trigeminal nucleus in rats», in Brain Res, 2011».
PMID:21640334
DOI:10.1016/j.brainres.2011.05.026 - ↑ Avivi-Arber L, Lee JC, Sessle BJ, «Dental Occlusal Changes Induce Motor Cortex Neuroplasticity», in J Dent Res, International & American Associations for Dental Research, 2015, Toronto, Canada».
PMID:26310722
DOI:10.1177/0022034515602478 - ↑ Dworkin SF, Huggins KH, Wilson L, Mancl L, Turner J, Massoth D, LeResche L, Truelove E, «A randomized clinical trial using research diagnostic criteria for temporomandibular disorders-axis II to target clinic cases for a tailored self-care TMD treatment program», in J Orofac Pain, 2002».
PMID:11889659 - ↑ Farrar WB, «Differentiation of temporomandibular joint dysfunction to simplify treatment», in J Prosthet Dent, 1972».
PMID:4508486
DOI:10.1016/0022-3913(72)90113-8 - ↑ Farrar WB, «Controversial syndrome», in J Am Dent Assoc, Elsevier Inc, 1972».
PMID:4503595
DOI:10.14219/jada.archive.1972.0286 - ↑ Eversole LR, Machado L, «Temporomandibular joint internal derangements and associated neuromuscular disorders», in J Am Dent Assoc, 1985».
PMID:3882811
DOI:10.14219/jada.archive.1985.0283 - ↑ Storum KA, Bell WH, «The effect of physical rehabilitation on mandibular function after ramus osteotomies», in J Oral Maxillofac Surg, 1986».
PMID:3456031
DOI:10.1016/0278-2391(86)90188-6 - ↑ Schiffman E, Anderson G, Fricton J, Burton K, Schellhas K, «Diagnostic criteria for intraarticular T.M. disorders», in Community Dent Oral Epidemiol, 1989».
PMID:2791516
DOI:10.1111/j.1600-0528.1989.tb00628.x - ↑ Phillips DJ Jr, Gelb M, Brown CR, Kinderknecht KE, Neff PA, Kirk WS Jr, Schellhas KP, Biggs JH 3rd, Williams B, «Guide to evaluation of permanent impairment of the temporomandibular joint», in Cranio, American Academy of Head, Neck and Facial Pain; American Academy of Orofacial Pain; American Academy of Pain Management; American College of Prosthodontists; American Equilibration Society and Society of Occlusal Studies; American Society of Maxillofacial Surgeons; American Society of Temporomandibular Joint Surgeons; International College of Cranio-mandibular Orthopedics; Society for Occlusal Studies, 1997».
PMID:9586521 - ↑ Talley RL, Murphy GJ, Smith SD, Baylin MA, Haden JL, «Standards for the history, examination, diagnosis, and treatment of temporomandibular disorders(TMD): a position paper», in Cranio, American Academy of Head, Neck and Facial Pain, 1990».
PMID:2098190
DOI:10.1080/08869634.1990.11678302 - ↑ Prayer Galletti S, Colonna MT, Meringolo P, «The psychological aspects of craniocervicomandibular pain dysfunction pathology», in Minerva Stomatol, 1990».
PMID:2398856 - ↑ Truelove EL, Sommers EE, LeResche L, Dworkin SF, Von Korff M, «Clinical diagnostic criteria for TMD. New classification permits multiple diagnoses», in J Am Dent Assoc, 1992».
PMID:1290490
DOI:10.14219/jada.archive.1992.0094 - ↑ Lobbezoo F, Visscher CM, Naeije M, «Some remarks on the RDC/TMD Validation Project: report of an IADR/Toronto-2008 workshop discussion», in J Oral Rehabil, Academic Centre for Dentistry Amsterdam (ACTA), 2010, Amsterdam, The Netherlands».
PMID:20374440
DOI:10.1111/j.1365-2842.2010.02091.x
particularly focusing on the field of the neurophysiology of the masticatory system