(Created page with "Das Ende der Forschung kam aufgrund fehlender wissenschaftlicher und klinischer Validierung zur Eliminierung einer Reihe instrumenteller diagnostischer Methoden wie Interferenz-Elektromyographie (EMG-Interferenzmuster), Pantographie, Röntgendiagnostik usw") |
Gianfranco (talk | contribs) |
||
| Line 557: | Line 557: | ||
| autore6 = Massoth D | | autore6 = Massoth D | ||
| autore7 = LeResche L | | autore7 = LeResche L | ||
| autore8 = Truelove | | autore8 = Truelove Edmond L | ||
| titolo = A randomized clinical trial using research diagnostic criteria for temporomandibular disorders-axis II to target clinic cases for a tailored self-care TMD treatment program | | titolo = A randomized clinical trial using research diagnostic criteria for temporomandibular disorders-axis II to target clinic cases for a tailored self-care TMD treatment program | ||
| url = https://pubmed.ncbi.nlm.nih.gov/11889659/ | | url = https://pubmed.ncbi.nlm.nih.gov/11889659/ | ||
| Line 748: | Line 748: | ||
| OCLC = | | OCLC = | ||
}}</ref>, Truelove (1992)<ref>{{Cite book | }}</ref>, Truelove (1992)<ref>{{Cite book | ||
| autore = Truelove | | autore = Truelove Edmond L | ||
| autore2 = Sommers EE | | autore2 = Sommers EE | ||
| autore3 = LeResche L | | autore3 = LeResche L | ||
Latest revision as of 15:53, 6 September 2023
Nach den vorangegangenen Kapiteln sollten wir nun erkennen können, dass sowohl in der modernen Physik als auch in der Biologie ein „komplexes System“ ein dynamisches Mehrkomponentensystem ist, das aus verschiedenen Teilsystemen besteht, die typischerweise miteinander interagieren. Solche Systeme werden typischerweise durch "ganzheitliche" Untersuchungsmethoden oder als "vollständige" Berechnung des Verhaltens der einzelnen Subsysteme zusammen mit ihren gegenseitigen Wechselwirkungen untersucht; diese können eher analytisch durch mathematische Modelle beschrieben werden als auf "reduktionistische" Weise (dh durch Zerlegen und Analysieren des Systems in seine Komponenten).. Typisch für komplexe Systeme sind die Konzepte der Selbstorganisation und „Emerging Behaviour“.
In diesem Kapitel werden wir einige Inhalte zugunsten dieser eher stochastischen und komplexeren Vision der neuromotorischen Funktionen des Kausystems aufdecken.
Vorüberlegung
In den letzten Jahren konzentrierten sich parallele Entwicklungen in verschiedenen Disziplinen auf das, was als "Konnektivität" bezeichnet wurde, ein Konzept, das verwendet wird, um die "komplexen Systeme" zu verstehen und zu beschreiben.. Die Konzeptualisierungen und Funktionalisierungen von Konnektivität haben sich innerhalb ihrer Disziplingrenzen weit entwickelt, aber es gibt deutliche Ähnlichkeiten in diesem Konzept und in seiner Anwendung über die Disziplinen hinweg. Jede Implementierung des Konnektivitätskonzepts beinhaltet jedoch sowohl ontologische als auch erkenntnistheoretische Einschränkungen, die uns zu der Frage veranlassen, ob es eine Art oder eine Reihe von Konnektivitätsansätzen gibt, die auf alle Disziplinen angewendet werden könnten. In diesem Aufsatz untersuchen wir vier ontologische und erkenntnistheoretische Herausforderungen bei der Verwendung von Konnektivität zum Verständnis komplexer Systeme aus der Sicht sehr unterschiedlicher Disziplinen.
Im Kapitel „Konnektivität und komplexe Systeme“ stellen wir abschließend das Konzept von vor:
- Definieren der grundlegenden Einheit für das Studium der Konnektivität;
- Trennung der strukturellen Konnektivität von der funktionellen Konnektivität;
- Verständnis für aufkommendes Verhalten; und
- Konnektivität messen.
Wir müssen nun das komplexe Profil der Kaufunktion betrachten, um von „Konnektivität“ sprechen zu können.[1]
Erst in späteren Zeiten wurde die Bedeutung der Kaufunktion als komplexes System deutlich; deutlich wird es durch seine Interaktion mit einer Vielzahl anderer Nervenzentren und -systeme (ZNS), die ebenfalls funktionell weit entfernt sind.[2]. Die Kaufunktion wurde in der Tat immer als periphere und isolierte Funktion in Bezug auf die Phonetik und das Kauen betrachtet. Dieser Interpretation folgend gab es unzählige Sichtweisen, die sich ausschließlich auf die Diagnose und Rehabilitation von Kauen im Oberkiefer konzentrierten und konzentrieren, indem sie jede multistrukturelle Korrelation ausschlossen.
Diese Art der Herangehensweise bezeichnet einen klaren „Reduktionismus“ in den Inhalten des Systems selbst: in der Biologie ist es realistischer, die Funktionalität von Systemen wie "Komplexen Systemen" zu betrachten, die nicht linear funktionieren. Diese Systeme verwenden einen stochastischen Ansatz, bei dem die Interaktion der verschiedenen Bestandteile ein „emergentes Verhalten“ (EB) erzeugt.[3] of the same system.[4]
Das paradigmatische Ergebnis kehrt die Tendenz um, das Kausystem als ein einfaches kinematisches Organ zu betrachten, und geht weit über das traditionelle mechanistische Verfahren der klassischen Gnathologie hinaus.
Dieser Aspekt führt auch eine Art indeterministisches Profil biologischer Funktionen ein, in dem sich die Funktion eines Systems als ein Netzwerk mehrerer verwandter Elemente darstellt. Zusätzlich zur Interpretation seines Zustands sollte dieses System von außen stimuliert werden, um die evozierte Reaktion zu analysieren, wie es für indeterministische Systeme typisch ist.[6]
Es ist daher unerlässlich, von einem einfachen und linearen Modell der Zahnklinik zu einem stochastischen komplexen Modell der Kauneurophysiologie zu wechseln.
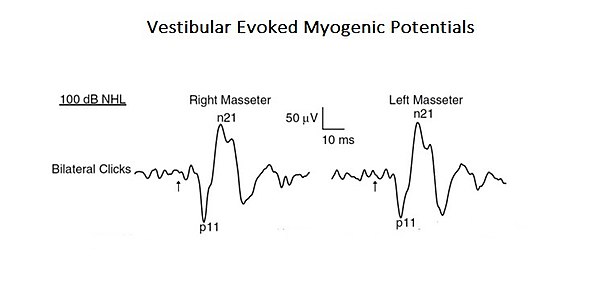
Als Bestätigung dieses komplexeren und integrierten Ansatzes zur Interpretation der Kaufunktionen wird hier eine Studie vorgestellt, in der das Profil eines „Neural Complex System“ auftaucht. In der erwähnten Studie wurde die organische und funktionelle Verbindung des vestibulären Systems mit dem trigeminalen System analysiert. [7]. Akustische Reize können EMG-Reflexantworten im Massetermuskel hervorrufen, die als vestibuläre evozierte myogene Potenziale (VEMPs) bezeichnet werden.. Auch wenn diese Ergebnisse bisher auf die Aktivierung der cochleären Rezeptoren (hohe Schallintensität) zurückgeführt wurden, können diese auch die vestibulären Rezeptoren aktivieren. Da anatomische und physiologische Studien sowohl bei Tieren als auch bei Menschen gezeigt haben, dass Kaumuskeln ein Ziel für vestibuläre Eingänge sind, haben die Autoren dieser Studie den vestibulären Beitrag für die Masseterreflexe neu bewertet. Dies ist ein typisches Beispiel für ein komplexes System auf Basisebene, da es nur aus zwei kranialen Nervensystemen besteht, aber gleichzeitig durch Aktivierung mono- und polysynaptischer Schaltkreise interagiert (Abbildung 1).
An dieser Stelle wäre es angebracht, einige Themen im Zusammenhang mit den oben genannten Konzepten einzuführen, die die Begründung des Masticationpedia-Projekts verdeutlichen würden. Dies würde die Kapitel einführen, die den Kern des Projekts bilden.
Daher ist das Objekt:
diese werden um zusätzliche wesentliche Themen erweitert, wie z. B. die „Segmentierung des Trigeminusnervensystems“ im letzten Kapitel „Außergewöhnliche Wissenschaft“..»
Kauen und kognitive Prozesse
In den letzten Jahren war das Kauen ein Diskussionsthema über die Erhaltungs- und Unterstützungseffekte der kognitiven Leistungsfähigkeit.
Eine elegante Studie, die durch fMR und Positronen-Emissions-Tomographie (PET) durchgeführt wurde, hat gezeigt, dass das Kauen zu einer Erhöhung des kortikalen Blutflusses führt und den zusätzlichen somatosensorischen Kortex, Motormotor und Insular sowie das Striatum aktiviert , den Thalamus und das Kleinhirn. Das Kauen direkt vor der Durchführung einer kognitiven Aufgabe erhöht den Sauerstoffgehalt im Blut (FETT im fMRT-Signal) im präfrontalen Kortex und im Hippocampus, wichtige Strukturen, die am Lernen und Gedächtnis beteiligt sind, wodurch die Leistungsaufgabe verbessert wird.[8] Frühere epidemiologische Studien haben gezeigt, dass eine reduzierte Anzahl von Restzähnen, eine inkongruente Verwendung von Prothesen und eine eingeschränkte Entwicklung der Unterkieferkraft in direktem Zusammenhang mit der Entwicklung von Demenz stehen, was die Annahme weiter stützt, dass Kauen zur Aufrechterhaltung kognitiver Funktionen beiträgt.[9].
Eine kürzlich durchgeführte Studie hat weitere Beweise für die Interaktion zwischen Kauprozessen, Lernen und Gedächtnis geliefert und sich auf die Funktion des Hippocampus konzentriert, die für die Bildung neuer Erinnerungen unerlässlich ist[10]. Eine okklusale Disharmonie, wie z. B. Zahnverlust und Zunahme der vertikalen okklusalen Dimension, verursacht Bruxismus oder Schmerzen der Kaumuskulatur und temporomandibuläre Störungen (TMDs).[11][12]. Um die beeinträchtigte Funktion des Hippocampus in einer reduzierten Situation oder abnormen Kaufunktion zu beschreiben, verwendeten die Autoren daher ein Tiermodell (Mäuse) namens „Molarless Senescence-Accelerated Prone“ (SAMP8), um eine Parallelität zum Menschen herzustellen. Bei SAMP8-Mäusen, bei denen die Okklusion modifiziert wurde, zeigte die Erhöhung der okklusalen vertikalen Dimension von etwa 0,1 mm mit Dentalmaterialien, dass die okklusale Disharmonie Lernen und Gedächtnis stört. Diese Tiere zeigten ein altersabhängiges Defizit im Raumlernen an Morris’ Wasser. [13][14]
Die Erhöhung der vertikalen Dimension des Bisses in SAMP8-Mäusen verringert die Anzahl der Pyramidenzellen[14] und die Anzahl ihrer dendritischen Stacheln.[15] Es erhöht auch die Hypertrophie und Hyperplasie der fibrillären Proteinsäure in Astrozyten in den Regionen des CA1- und CA3-Hippocampus.[16]. Bei Nagetieren und Affen okklusale Disharmonien, die durch eine Erhöhung der vertikalen Dimension mit Acrylerhöhungen an den Schneidezähnen induziert werden[17][18] oder Das Einsetzen der Bissebene in den Kiefer ist mit erhöhten Cortisolspiegeln im Urin und erhöhten Corticosteronspiegeln im Plasma verbunden, was darauf hindeutet, dass okklusale Disharmonie auch eine Stressquelle ist.
Zur Stützung dieser Annahme zeigen SAMP8-Mäuse mit Lerndefiziten einen deutlichen Anstieg der Plasmaspiegel von Corticosteron[12] und Subregulation von GR und GRmRNA des Hippocampus. Die okklusale Disharmonie beeinflusst auch die katecholaminerge Aktivität. Der abwechselnde Verschluss des Bisses durch Einsetzen einer Acrylbissschiene an den unteren Schneidezähnen führt zu einem Anstieg der Dopamin- und Noradrenalinspiegel im Hypothalamus und im frontalen Cortex[17][19], und Abnahmen von Thyroxinaydroxylase, GTP-Cyclohydrochlorid und immunreaktivem Serotonin in der Großhirnrinde und im Nucleus caudatus, in der Nigra-Substanz, im Locus ceruleus und im dorsalen Raphe-Nucleus, die chronischen stressinduzierten Veränderungen ähneln.[20] Diese durch okklusale Disharmonien induzierten Veränderungen im katekolaminergen und serotonergen System wirken sich eindeutig auf die Innervation des Hippocampus aus. Die Bedingungen der Erhöhung der vertikalen Dimension verändern die Neurogenese und führen zu Apoptose im ippocampalen Gyrus, indem sie die Expression des ippocampalen Gehirns, die von neurotrophen Faktoren stammt, verringern: All dies könnte zu den Veränderungen beim beobachteten Lernen bei Tieren mit okklusaler Disharmonie beitragen.[10]
Hirnstamm und Kauen
Der Hirnstammbezirk ist ein Relaisbereich, der die oberen Zentren des Gehirns, das Kleinhirn und das Rückenmark verbindet und die wichtigste sensorische und motorische Innervation von Gesicht, Kopf und Hals durch die Hirnnerven bereitstellt.
Dies spielt eine entscheidende Rolle bei der Regulierung von Atmung, Fortbewegung, Körperhaltung, Gleichgewicht, Erregung (einschließlich Darmkontrolle, Blase, Blutdruck und Herzfrequenz).. Es ist für die Regulierung zahlreicher Reflexe verantwortlich, darunter Schlucken, Husten und Erbrechen. Der Hirnstamm wird von höheren zerebralen Zentren aus kortikalen und subkortikalen Regionen gesteuert, einschließlich der Basalganglienkerne und des Zwischenhirns, sowie von Rückkopplungsschleifen aus dem Kleinhirn und dem Rückenmark. Neuromodulation kann durch den „klassischen“ Modus von glutamatergen Neurotransmittern und GABA (Gamma-Aminobuttersäure) durch eine primäre Erregung und Hemmung des „anatomischen Netzwerks“ erreicht werden, kann aber auch durch die Verwendung von Botenstoffen erreicht werden, die auf G-Proteine wirken. Zu diesen Neuromodulatoren gehören das Monoamin (Serotonin, Noradrenalin und Dopamin) Acetylcholin sowie Glutamat und GABA. Darüber hinaus wirken nicht nur Neuropeptide und Purine als Neuromodulatoren, sondern auch andere chemische Mediatoren, wie Wachstumsfaktoren, die ähnliche Wirkungen haben könnten.[21]
Das oben beschriebene neuronale Netzwerk endet nicht bei der einzigen Korrelation zwischen trigeminalen somatosensorischen Zentren und anderen motorischen Arealen, sondern verirrt sich auch in die Amigdaloidei-Prozesse durch eine Korrelation mit dem trigeminalen Hirnstammareal. Die Amygdala wird aus Angst aktiv und spielt eine wichtige Rolle bei der emotionalen Reaktion auf lebensbedrohliche Situationen. Wenn sich Laborratten bedroht fühlen, reagieren sie mit heftigen Beißen. Die Kraft des Bisses wird durch die motorischen Kerne des Trigeminussystems und des Trigeminushirnstamms Me5 reguliert.Das Me5 überträgt propriozeptive Signale von den Kaumuskeln und Parodontalbändern an Trigeminuskerne und Motoren. Projektionen des zentralen Amygdaloidkerns (ACe) senden Verbindungen zum motorischen Trigeminuskern und zur retikulären Prämotorformation und direkt zum Me5.
Um dies zu bestätigen, wurden in einer an Mäusen durchgeführten Studie die Neuronen im zentralen Amigdaloide-Kern (ACe) nach der Injektion eines retrograden Tracers (Fast Blue) im kaudalen Kern des Me5 markiert, was darauf hinweist, dass die Amigdaloiden direkte Projektionen senden zum Me5 und legen nahe, dass die Amygdala die Stärke des Bisses reguliert, indem sie die neuronale Aktivität im Me5 durch eine neurale Fazilitation modifiziert.[22]
Die Änderung der okklusalen Verhältnisse kann die oralen somatosensorischen Funktionen verändern, und die rehabilitativen Behandlungen des Kausystems sollten die somatosensorischen Funktionen wiederherstellen. Es ist jedoch unklar, warum sich einige Patienten nicht an die Kaurestauration gewöhnen und sensomotorische Störungen bestehen bleiben. Auf den ersten Blick scheinen es strukturelle Veränderungen zu sein, nicht nur funktionale. Der primäre motorische Kortex des Gesichts ist an der Erzeugung und Steuerung von Gesichtsgoldbewegungen und sensorischen Eingaben oder veränderten motorischen Funktionen beteiligt, die zu neuroplastischen Veränderungen im kortikalen M1-Bereich führen können.[10][23]
Abschließende Überlegungen
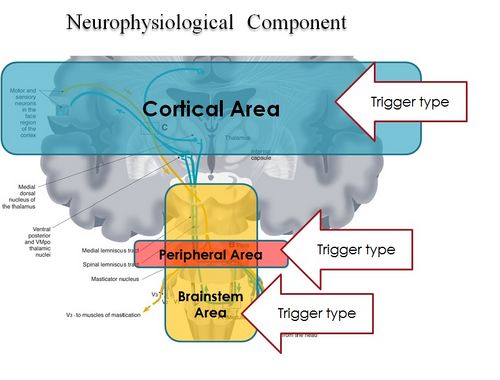
Abschließend wird aus der Prämisse deutlich, dass das Kausystem nicht unbedingt als ein System angesehen werden sollte, das einfach von mechanischen Gesetzen beherrscht wird, sondern als ein "komplexes System" indeterministischer Art, bei dem man das "aufkommende Verhalten" erst danach quantifizieren kann stimulieren und dann die hervorgerufene Reaktion analysieren (Abbildung 2). Das neuronale System kommuniziert auch mit seiner eigenen verschlüsselten Maschinensprache (potenzielle Aktion und Ionenströme) und daher ist es nicht möglich, die vom Patienten angegebenen Symptome durch natürliche Sprache zu interpretieren.
Dieses Konzept vertieft das Wissen über den Gesundheitszustand eines Systems, da es eine Antwort aus dem Inneren des Netzwerks herausholt – oder zumindest aus einem großen Teil davon – indem normale und/oder abnormale Komponenten den verschiedenen Knoten des Netzwerks zugeordnet werden. In wissenschaftlicher Hinsicht führt es auch ein neues Paradigma in das Studium des Kausystems ein: die „Neuro-Gnathologie-Funktion“, die wir zu gegebener Zeit im Kapitel „Außergewöhnliche Wissenschaft“ kennenlernen werden..
Derzeit erfolgt die Interpretation des Emergent Behaviour of the Kausystem in der Zahnheilkunde nur durch die Analyse der freiwilligen Valley-Reaktion, durch elektromyografische Aufzeichnungen, „EMG-Interferenzmuster“ und radiologische und axografische Tests (Replikatoren von Unterkieferbewegungen).. Diese können nur als beschreibende Tests betrachtet werden.
Das Paradigma der gnathologischen Beschreibungstests stand vor Jahren vor einer Krise: Trotz des Versuchs, die verschiedenen Axiome, Denkschulen und klinisch-experimentellen Strenge im Bereich der Kiefergelenkserkrankungen neu zu ordnen (durch die Umsetzung eines Protokolls namens „Research Diagnostic Criteria“ RDC/TMDs), ist dieses Paradigma noch nicht entstanden wegen der wissenschaftlich-klinischen Unvollständigkeit des Verfahrens selbst akzeptiert. Es verdient jedoch einen besonderen Hinweis auf die RDC/TMD, zumindest für das Engagement der Autoren und gleichzeitig für das Scrollen der Grenzen.
Das RDC/TMD-Protokoll wurde entwickelt und initialisiert, um den Verlust „standardisierter diagnostischer Kriterien“ zu vermeiden und eine diagnostische Standardisierung empirischer Daten zur Verfügung zu stellen. Dieses Protokoll wurde vom National Institute for Dental Research (NIDR) unterstützt und an der University of Washington und der Group Health Corporative of Puget Sound, Seattle, Washington, durchgeführt. Samuel F. Dworkin, M. von Korff und L. LeResche waren die Hauptermittler[24].
Um zur Formulierung des Protokolls des „RDC“ zu gelangen, wurde eine Überprüfung der Literatur zu diagnostischen Methoden in der rehabilitativen Zahnheilkunde und TMDs durchgeführt und einer Validierung und Reproduzierbarkeit unterzogen. Taxonomische Systeme wurden von Farrar berücksichtigt (1972)[25][26], Eversole und Machado (1985)[27], Bell (1986)[28], Fricton (1989)[29], American Academy of Craniomandibular Disorders (AACD) (1990)[30], Talley (1990)[31], Bergamini und Prayer-Galletti (1990)[32], Truelove (1992)[33], und verglichen sie, indem sie sie einem Satz von Bewertungskriterien zuordneten. Die Bewertungskriterien wurden in zwei Kategorien unterteilt, die methodische Überlegungen und klinische Überlegungen beinhalten.
Das Ende der Forschung kam aufgrund fehlender wissenschaftlicher und klinischer Validierung zur Eliminierung einer Reihe instrumenteller diagnostischer Methoden wie Interferenz-Elektromyographie (EMG-Interferenzmuster), Pantographie, Röntgendiagnostik usw. Diese werden in den nächsten Ausgaben von Masticationpedia ausführlicher beschrieben. Dieses erste Ziel war daher die wissenschaftliche Anfrage nach „objektiven Daten“ und nicht erzeugt durch Meinungen, Denkschulen oder subjektive Bewertungen des Phänomens.. Während des Workshops der International Association for Dental Research (IADR) von 2008 wurden vorläufige Ergebnisse der RDC/TMDs präsentiert, um das Projekt zu validieren.
Die Schlussfolgerung war, dass es für eine Überprüfung und gleichzeitige Validierung von [RDC/TMD] unerlässlich ist, dass die Tests in der Lage sein sollten, eine Differenzialdiagnose zwischen CMD-Patienten mit Schmerzen und Probanden ohne Schmerzen zu stellen und vor allem Patienten zu diskriminieren mit CMD-Schmerzen von Patienten mit orofazialen Schmerzen ohne CMD.[34]
Dieser letzte Artikel, der Schmerz als ein wesentliches Symptom für die klinische Interpretation neu betrachtet, bringt die gesamte neurophysiologische Phänomenologie ins Spiel, nicht nur diese. Um sich in diesem Medizinzweig leichter bewegen zu können, bedarf es eines anderen wissenschaftlich-klinischen Ansatzes, der den Kompetenzhorizont in Bereichen wie Bioengineering und Neurobiologie erweitert.
Es ist daher wichtig, die Aufmerksamkeit darauf zu richten, wie man trigeminusförmige elektrophysiologische Signale als Reaktion auf eine Reihe von Auslösern empfängt, die von einem elektrophysiologischen Gerät hervorgerufen werden, Daten verarbeitet und einen organisch-funktionellen Wert des Trigeminus- und Kausystems bestimmt, wie von Marom Bikson und erwartet coll. in ihren «Elektrische Stimulation von Hirnnerven bei Kognition und Krankheit».
Wir sollten an ein System denken, das Kaufunktion und neurophysiologische Funktionen vereint, indem wir einen neuen Begriff einführen: "Neuro-gnathologische Funktionen"
die Gegenstand eines eigenen Kapitels sein wird.
- ↑ Turnbull L, Hütt MT, Ioannides AA, Kininmonth S, Poeppl R, Tockner K, Bracken LJ, Keesstra S, Liu L, Masselink R, Parsons AJ, «Connectivity and complex systems: learning from a multi-disciplinary perspective», in Appl Netw Sci, 2018».
PMID:30839779 - PMCID:PMC6214298
DOI:10.1007/s41109-018-0067-2
This is an Open Access resource! - ↑ Viggiano A, Manara R, Conforti R, Paccone A, Secondulfo C, Lorusso L, Sbordone L, Di Salle F, Monda M, Tedeschi G, Esposito F, «Mastication induces long-term increases in blood perfusion of the trigeminal principal nucleus», in Neuroscience, Elsevier, 2015».
PMID:26477983
DOI:10.1016/j.neuroscience.2015.10.017 - ↑ Florio T, Capozzo A, Cellini R, Pizzuti G, Staderini EM, Scarnati E, «Unilateral lesions of the pedunculopontine nucleus do not alleviate subthalamic nucleus-mediated anticipatory responding in a delayed sensorimotor task in the rat», in Behav Brain Res, 2001».
PMID:11704255
DOI:10.1016/s0166-4328(01)00248-0 - ↑ de Boer RJ, Perelson AS, «Size and connectivity as emergent properties of a developing immune network», in J Theor Biol, 1991».
PMID:2062103
DOI:10.1016/s0022-5193(05)80313-3 - ↑ Iyer-Biswas S, Hayot F, Jayaprakash C, «Stochasticity of gene products from transcriptional pulsing», in Phys Rev E Stat Nonlin Soft Matter Phys, 2009».
PMID:19391975
DOI:10.1103/PhysRevE.79.031911
This is an Open Access resource! - ↑ Lewis ER, MacGregor RJ, «On indeterminism, chaos, and small number particle systems in the brain», in J Integr Neurosci, 2006».
PMID:16783870
DOI:10.1142/s0219635206001112 - ↑ Deriu F, Ortu E, Capobianco S, Giaconi E, Melis F, Aiello E, Rothwell JC, Tolu E, «Origin of sound-evoked EMG responses in human masseter muscles», in J Physiol, 2007».
PMID:17234698 - PMCID:PMC2075422
DOI:10.1113/jphysiol.2006.123240
This is an Open Access resource! - ↑ Yamada K, Park H, Sato S, Onozuka M, Kubo K, Yamamoto T, «Dynorphin-A immunoreactive terminals on the neuronal somata of rat mesencephalic trigeminalnucleus», in Neurosci Lett, Elsevier Ireland, 2008».
PMID:18455871
DOI:10.1016/j.neulet.2008.04.030 - ↑ Kondo K, Niino M, Shido K, «Dementia. A case-control study of Alzheimer's disease in Japan - significance of life-styles», 1994».
PMID:7866485
DOI:10.1159/000106741 - ↑ Jump up to: 10.0 10.1 10.2 Kubo KY, Ichihashi Y, Kurata C, Iinuma M, Mori D, Katayama T, Miyake H, Fujiwara S, Tamura Y, «Masticatory function and cognitive function», in Okajimas Folia Anat Jpn, 2010».
PMID:21174943
DOI:10.2535/ofaj.87.135
This is an Open Access resource! - ↑ Christensen J, «Effect of occlusion-raising procedures on the chewing system», in Dent Pract Dent Rec, 1970».
PMID:5266427 - ↑ Jump up to: 12.0 12.1 Ichihashi Y, Arakawa Y, Iinuma M, Tamura Y, Kubo KY, Iwaku F, Sato Y, Onozuka M, «Occlusal disharmony attenuates glucocorticoid negative feedback in aged SAMP8 mice», in Neurosci Lett, 2007».
PMID:17928141
DOI:10.1016/j.neulet.2007.09.020 - ↑ Arakawa Y, Ichihashi Y, Iinuma M, Tamura Y, Iwaku F, Kubo KY, «Duration-dependent effects of the bite-raised condition on hippocampal function in SAMP8 mice», in Okajimas Folia Anat Jpn, 2007».
PMID:18186225
DOI:10.2535/ofaj.84.115
This is an Open Access resource! - ↑ Jump up to: 14.0 14.1 Kubo KY, Yamada Y, Iinuma M, Iwaku F, Tamura Y, Watanabe K, Nakamura H, Onozuka M, «Occlusal disharmony induces spatial memory impairment and hippocampal neuron degeneration via stress in SAMP8 mice», in Neurosci Lett, Elsevier Ireland, 2007».
PMID:17207572
DOI:10.1016/j.neulet.2006.12.020 - ↑ Kubo KY, Kojo A, Yamamoto T, Onozuka M, «The bite-raised condition in aged SAMP8 mice induces dendritic spine changes in the hippocampal region», in Neurosci Lett, 2008».
PMID:18614288
DOI:10.1016/j.neulet.2008.05.027 - ↑ Ichihashi Y, Saito N, Arakawa Y, Kurata C, Iinuma M, Tamura Y, Iwaku F, Kubo KY, «The bite-raised condition in aged SAMP8 mice reduces the expression of glucocorticoid receptors in the dorsal and ventral hippocampus», in Okajimas Folia Anat Jpn, 2008».
PMID:18464530
DOI:10.2535/ofaj.84.137
This is an Open Access resource! - ↑ Jump up to: 17.0 17.1 Areso MP, Giralt MT, Sainz B, Prieto M, García-Vallejo P, Gómez FM, «Occlusal disharmonies modulate central catecholaminergic activity in the rat», in J Dent Res, 1999».
PMID:10371243
DOI:10.1177/00220345990780060301 - ↑ Yoshihara T, Matsumoto Y, Ogura T, «Occlusal disharmony affects plasma corticosterone and hypothalamic noradrenaline release in rats», in J Dent Res, 2001».
PMID:11808768
DOI:10.1177/00220345010800121301 - ↑ Gómez FM, Areso MP, Giralt MT, Sainz B, García-Vallejo P, «Effects of dopaminergic drugs, occlusal disharmonies, and chronic stress on non-functional masticatory activity in the rat, assessed by incisal attrition», in J Dent Res, 1998».
PMID:9649174
DOI:10.1177/00220345980770061001 - ↑ Feldman S, Weidenfeld J, «Glucocorticoid receptor antagonists in the hippocampus modify the negative feedback following neural stimuli», in Brain Res, Elsevier Science B.V., 1999».
PMID:10064785
DOI:10.1016/s0006-8993(99)01054-9 - ↑ Mascaro MB, Prosdócimi FC, Bittencourt JC, Elias CF, «Forebrain projections to brainstem nuclei involved in the control of mandibular movements in rats», in Eur J Oral Sci, 2009, São Paulo, Brazil».
PMID:20121930
DOI:10.1111/j.1600-0722.2009.00686.x - ↑ Shirasu M, Takahashi T, Yamamoto T, Itoh K, Sato S, Nakamura H, «Direct projections from the central amygdaloid nucleus to the mesencephalic trigeminal nucleus in rats», in Brain Res, 2011».
PMID:21640334
DOI:10.1016/j.brainres.2011.05.026 - ↑ Avivi-Arber L, Lee JC, Sessle BJ, «Dental Occlusal Changes Induce Motor Cortex Neuroplasticity», in J Dent Res, International & American Associations for Dental Research, 2015, Toronto, Canada».
PMID:26310722
DOI:10.1177/0022034515602478 - ↑ Dworkin SF, Huggins KH, Wilson L, Mancl L, Turner J, Massoth D, LeResche L, Truelove Edmond L, «A randomized clinical trial using research diagnostic criteria for temporomandibular disorders-axis II to target clinic cases for a tailored self-care TMD treatment program», in J Orofac Pain, 2002».
PMID:11889659 - ↑ Farrar WB, «Differentiation of temporomandibular joint dysfunction to simplify treatment», in J Prosthet Dent, 1972».
PMID:4508486
DOI:10.1016/0022-3913(72)90113-8 - ↑ Farrar WB, «Controversial syndrome», in J Am Dent Assoc, Elsevier Inc, 1972».
PMID:4503595
DOI:10.14219/jada.archive.1972.0286 - ↑ Eversole LR, Machado L, «Temporomandibular joint internal derangements and associated neuromuscular disorders», in J Am Dent Assoc, 1985».
PMID:3882811
DOI:10.14219/jada.archive.1985.0283 - ↑ Storum KA, Bell WH, «The effect of physical rehabilitation on mandibular function after ramus osteotomies», in J Oral Maxillofac Surg, 1986».
PMID:3456031
DOI:10.1016/0278-2391(86)90188-6 - ↑ Schiffman E, Anderson G, Fricton J, Burton K, Schellhas K, «Diagnostic criteria for intraarticular T.M. disorders», in Community Dent Oral Epidemiol, 1989».
PMID:2791516
DOI:10.1111/j.1600-0528.1989.tb00628.x - ↑ Phillips DJ Jr, Gelb M, Brown CR, Kinderknecht KE, Neff PA, Kirk WS Jr, Schellhas KP, Biggs JH 3rd, Williams B, «Guide to evaluation of permanent impairment of the temporomandibular joint», in Cranio, American Academy of Head, Neck and Facial Pain; American Academy of Orofacial Pain; American Academy of Pain Management; American College of Prosthodontists; American Equilibration Society and Society of Occlusal Studies; American Society of Maxillofacial Surgeons; American Society of Temporomandibular Joint Surgeons; International College of Cranio-mandibular Orthopedics; Society for Occlusal Studies, 1997».
PMID:9586521 - ↑ Talley RL, Murphy GJ, Smith SD, Baylin MA, Haden JL, «Standards for the history, examination, diagnosis, and treatment of temporomandibular disorders(TMD): a position paper», in Cranio, American Academy of Head, Neck and Facial Pain, 1990».
PMID:2098190
DOI:10.1080/08869634.1990.11678302 - ↑ Prayer Galletti S, Colonna MT, Meringolo P, «The psychological aspects of craniocervicomandibular pain dysfunction pathology», in Minerva Stomatol, 1990».
PMID:2398856 - ↑ Truelove Edmond L, Sommers EE, LeResche L, Dworkin SF, Von Korff M, «Clinical diagnostic criteria for TMD. New classification permits multiple diagnoses», in J Am Dent Assoc, 1992».
PMID:1290490
DOI:10.14219/jada.archive.1992.0094 - ↑ Lobbezoo F, Visscher CM, Naeije M, «Some remarks on the RDC/TMD Validation Project: report of an IADR/Toronto-2008 workshop discussion», in J Oral Rehabil, Academic Centre for Dentistry Amsterdam (ACTA), 2010, Amsterdam, The Netherlands».
PMID:20374440
DOI:10.1111/j.1365-2842.2010.02091.x
particularly focusing on the field of the neurophysiology of the masticatory system