Esplorare l'elettroencefalografia con un modello ispirato alla meccanica quantistica
| Title | Esplorare l'elettroencefalografia con un modello ispirato alla meccanica quantistica |
| Authors | Nicholas J. M. Popiel · Colin Metrow · Geofrey Laforge · Adrian M. Owen · Bobby Stojanoski · Andrea Soddu |
| Source | Document |
| Date | 2021 |
| Journal | Sci Rep |
| DOI | 10.1038/s41598-021-97960-7 |
| PUBMED | https://pubmed.ncbi.nlm.nih.gov/34611185 |
| PDF copy | |
| License | CC BY |
| This resource has been identified as a Free Scientific Resource, this is why Masticationpedia presents it here as a mean of gratitude toward the Authors, with appreciation for their choice of releasing it open to anyone's access | |
This is free scientific content. It has been released with a free license, this is why we can present it here now, for your convenience. Free knowledge, free access to scientific knowledge is a right of yours; it helps Science to grow, it helps you to have access to Science
This content was relased with a 'CC BY' license.
You might perhaps wish to thank the Author/s
Free resource by Nicholas J. M. Popiel · Colin Metrow · Geofrey Laforge · Adrian M. Owen · Bobby Stojanoski · Andrea Soddu
|
Nicholas J. M. Popiel,1,2 Colin Metrow,1 Geoffrey Laforge,3 Adrian M. Owen,3,4,5 Bobby Stojanoski,#4,6 and Andrea Soddu#1,3
1The Department of Physics and Astronomy, The University of Western Ontario, London, ON N6A 5B7 Canada
2Cavendish Laboratory, University of Cambridge, Cambridge, CB3 0HE UK
3The Brain and Mind Institute, The University of Western Ontario, London, ON N6A 5B7 Canada
4The Department of Psychology, The University of Western Ontario, London, ON N6A 5B7 Canada
5The Department of Physiology and Pharmacology, The University of Western Ontario, London, ON N6A 5B7 Canada
6Faculty of Social Science and Humanities, University of Ontario Institute of Technology, 2000 Simcoe Street North, Oshawa, ON L1H 7K4 Canada
Abstract
Una questione in sospeso nelle neuroscienze cognitive riguarda il modo in cui il cervello è organizzato in diverse condizioni. Ad esempio, durante la condizione di riposo, il cervello può essere raggruppato in reti affidabili e riproducibili (ad esempio, reti sensoriali, predefinite, esecutive). È interessante notare che le stesse reti emergono durante condizioni attive in risposta a vari compiti. Se modelli simili di attività neurale sono stati trovati in condizioni diverse e, quindi, diversi processi ed esperienze sottostanti dell'ambiente, il cervello è organizzato da un principio organizzativo fondamentale? Per verificarlo, abbiamo applicato formalismi matematici presi in prestito dai meccanismi quantistici per modellare i dati dell'elettroencefalogramma (EEG). Abbiamo scoperto una tendenza per i segnali EEG a essere localizzati nelle regioni anteriori del cervello durante il "riposo" e distribuiti in modo più uniforme mentre sono impegnati in un'attività (cioè, guardando un film). Inoltre, abbiamo trovato valori analoghi al principio di indeterminazione di Heisenberg, suggerendo un'architettura sottostante comune dell'attività cerebrale umana in condizioni di riposo e di attività. Questa architettura sottostante si manifesta nella nuova costante Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle K_{brain}} , che viene estratto dallo stato cerebrale con la minima incertezza. Vorremmo affermare che stiamo usando la matematica della meccanica quantistica, ma non pretendiamo che il cervello si comporti come un oggetto quantistico.
Introduzione
Una questione importante ma eccezionale nella neuroscienza cognitiva contemporanea è la comprensione delle proprietà organizzative dell'attività neurale. Ad esempio, esiste una struttura fondamentale per i modelli spazio-temporali dell'attività cerebrale neurale in condizioni diverse? Un approccio comune utilizzato per rispondere a questa domanda è quello di esaminare il cervello a "riposo". Misure come la connettività funzionale, l'analisi dei componenti indipendenti e le metriche teoriche dei grafici sono state applicate ai dati registrati utilizzando diverse tecniroche di imaging (ad esempio, risonanza magnetica funzionale (fMRI) ed elettroencefalografia (EEG)), per raggruppare aree cerebrali che mostrano schemi di attività simili . Numerosi studi hanno dimostrato che l'attività cerebrale durante il "riposo" può essere raggruppata in reti distinte;[1][2] come reti sensoriali (visive e uditive), modalità predefinita, esecutiva, salienza e attenzionale (ventrale e dorsale) che sono state riprodotte in modo affidabile tra migliaia di partecipanti[3] e sono predittive di misure fenotipiche come la cognizione e le diagnosi cliniche.[4][5][6] Questi risultati suggeriscono che queste reti potrebbero essere un aspetto intrinseco dell'attività neurale.
In effetti, lo stesso insieme di modelli strutturati di attività neurale è stato trovato durante stati "attivi", come durante il completamento di compiti diversi.[7][8][9] Ad esempio, c'è un alto grado di corrispondenza tra le reti estratte durante il riposo e quelle estratte durante i compiti che misurano le capacità sensomotorie[10][11] e cognitive di livello superiore (cioè la memoria di lavoro).[12][13] Anche completare un compito complicato come seguire la trama di un film presenta la stessa architettura di rete osservata nel cervello a riposo.[14] La corrispondenza tra attività e reti basate sul riposo è così forte che l'attività della rete fMRI basata sui compiti può essere prevista dallo stato di riposo[15] e le coppie di reti di riposo-attività possono essere identificate a livello individuale.[16] Insieme, questi risultati suggeriscono che i modelli di attività cerebrale basati sul riposo e sulle attività probabilmente condividono un'architettura neurale sottostante simile, nonostante esperienze e processi cognitivi distinti.[17]
Esistono, tuttavia, differenze importanti tra i modelli di attività cerebrale attivati durante il riposo e i paradigmi basati sulle attività e l'insieme di esperienze e processi cognitivi associati a ciascuno.[18] Ad esempio, la presenza o l'assenza di un compito è accompagnata da un aumento della variabilità su diverse scale, comprese le variazioni della velocità di scarica neuronale nei potenziali di campo,[19][20] la variazione della fMRI dipendente dal livello di ossigeno nel sangue (segnale BOLD)[21] e nelle bande di frequenza EEG.[22] Inoltre, attraverso la stimolazione di corrente continua transcranica (tDCS) è stato dimostrato che la stimolazione del lobo frontale aumenta la propensione a vagare per la mente.[23][24] È importante sottolineare che queste differenze sono associate a cambiamenti nelle proprietà dell'attività neurale ma non a cambiamenti nell'architettura neurale sottostante.
C'è un modo per identificare l'architettura neurale condivisa alla base dei processi cognitivi associati a riposo ed agli stati attivi, quantificando anche come questi processi divergono da quell'architettura condivisa dell'attività neurale? In questo articolo, abbiamo applicato metodi matematici analoghi a quelli della meccanica quantistica e il concetto di spazio delle fasi all'EEG registrato durante il riposo e la visione di film, per estrarre le proprietà spaziali e di transizione dell'attività dinamica neurale. La meccanica quantistica è stata sviluppata per descrivere la dinamica del mondo subatomico in termini di ampiezze di probabilità e densità di stati. I sistemi quantistici (nella formulazione di Schrodinger della meccanica quantistica) sono descritti da funzioni d'onda che quadrano ad una distribuzione di probabilità e che porta alla perdita del determinismo locale e del principio di indeterminazione di Heisenberg (per una panoramica/introduzione all'argomento, vedere.[25] Questo principio di indeterminazione pone un limite fondamentale alla posizione e alla quantità di moto di una particella puntiforme.[26] In sostanza, se la posizione di una particella è nota, c'è un'incertezza di fondo nella sua quantità di moto (non si può dire con precisione a che velocità stia andando) e viceversa. Oltre alla adattamento dell'approccio della funzione d'onda alla meccanica quantistica in questo articolo, abbiamo anche impiegato un modello dello spazio delle fasi. Lo spazio delle fasi è uno strumento ampiamente utilizzato nello studio dei sistemi dinamici, in cui le variabili posizionali sono accoppiate con il loro momento coniugato che stabilisce uno spazio multidimensionale e che descrive tutte le possibili configurazioni di un dato sistema.Questo spazio abbraccia l'intera gamma di stati in cui un sistema può esistere, ciascuno punto (in questo iperspazio) rappresenta un singolo stato del sistema. Lo spazio delle fasi e i suoi formalismi assortiti sono un concetto classico e lo usiamo semplicemente come un altro strumento per analizzare i dati EEG. Qui, i metodi matematici della meccanica quantistica vengono applicati ai dati EEG per estrarre un proxy per lo spazio delle fasi. Questo approccio quasi-quantistico genera naturalmente i concetti di posizione "media", quantità di moto "media" e culmina in un analogo principio di indeterminazione di Heisenberg.
In questo articolo, postuliamo che utilizzando strumenti matematici tratti dalla meccanica quantistica, è possibile realizzare un modello sottostante rappresentativo del compito e dell'attività cerebrale a riposo, in cui le differenze tra le condizioni sono evidenti, ma culmina in un valore costante indipendente dal compito. È importante notare che non stiamo affermando che il cervello si comporti come un oggetto quantistico come alcuni credono.[27][28][29][30] Piuttosto, abbiamo impiegato alcuni degli strumenti analitici dalla formulazione di Schrodinger della meccanica quantistica al cervello con l'obiettivo di ottenere nuove informazioni sulla dinamica cerebrale a riposo e basata sui compiti cognitivi. L'ideazione di questo modello non solo pone domande sulle funzioni del cervello, ma fornisce anche un nuovo approccio all'analisi della miriade di dati disponibili nelle neuroscienze.
Resulti
In questo documento, abbiamo adattato le ampiezze di probabilità della meccanica quantistica per definire nuove metriche per l'esame dei dati EEG: la "posizione media" e il "momento medio" del segnale EEG. Questi sono stati costruiti dalla nostra definizione di "stati cerebrali" basata sul modello quasi quantistico. Ciò ci ha permesso di accertare la frequenza con cui le regioni cerebrali uniche vengono inserite dalla pseudo-funzione d'onda, nonché di esplorare lo spazio delle fasi di valore medio. Infine, è stata stabilita una relazione di incertezza analoga a quella della meccanica quantistica, con la piena derivazione matematica descritta nei metodi.
Valore medio
La "posizione media" dei dati EEG è stata prima estratta eseguendo una trasformata di Hilbert dei corsi temporali pre-elaborati e quindi applicando un vincolo di normalizzazione. Tipicamente, i dati trasformati di Hilbert vengono utilizzati per generare una metrica della dispersione di potenza o per estrarre la fase del segnale.[31][32][33] Invece, abbiamo imposto una nuova condizione di normalizzazione, creando così un'analogia con le funzioni d'onda della meccanica quantistica. Indicando con la trasformata di 'Hilbert il corso del tempo del Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle j} th elettrodo come Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle \Psi_j} , questo equivale a
| Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle \Psi_j(t)=A_j(t)\exp (i\theta_j(t))} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (1)} |
Con Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle i=\sqrt{-1}} . Abbiamo quindi imposto la condizione di normalizzazione,
| Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle \hat{\Psi}_j(t)= \frac{\Psi_j(t)}{\sqrt{\sum_{j=1}^{92}|\Psi_j|^2}}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (2)} |
La sommatoria estesa a 92, corrisponde ai 92 elettrodi selezionati dai 129 originali sulla calotta cranica (canali rimossi dal viso e dal collo per questa analisi). Questo vincolo di normalizzazione ci ha permesso di definire la probabilità al tempo Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle t} dello Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle j} esimo elettrodo come
| Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle P_j(t)=\hat{\Psi}^*_j(t) \times\hat{\Psi}_j(t)} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (3)}
|
Con il * che denota il complesso coniugato.[25] Possiamo quindi descrivere ogni momento come uno "stato cerebrale" che è completamente descritto (nel contesto di questo modello) attraverso la "funzione d'onda". Questo "stato cerebrale" specifica in modo univoco il segnale EEG, e quindi la dinamica di interesse, in ogni momento. Usando questa definizione di probabilità, abbiamo definito due quantità medie di interesse. La posizione media e il momento sono dati esplicitamente da,
| Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle \langle x(t)\rangle=\sum_{j=1}^{92}x_jP_j(t)} Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle \langle p_x(t)\rangle=m{d \over dt}\langle x(t)\rangle=m\sum_{j=1}^{92}x_j{d \over dt}P_j(t)} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (4)} |
Con lo stesso vale per Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle y} .
In pratica
Queste due equazioni sono il modo in cui creiamo i nostri analoghi quasi quantistici. La seconda equazione è un'estensione del teorema di Ehrenfest, che mette in relazione il momento medio di una particella con la derivata temporale della sua posizione media. Dove abbiamo assunto una Hamiltoniana con solo un potenziale spazialmente dipendente.
Si noti che poiché le posizioni sono fisse nello spazio (posizioni degli elettrodi) solo la probabilità cambia nel tempo. In tutto questo articolo la massa Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle m} è stata considerata come unità per entrambi i momenti Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle x} e Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle y} . Ciascuno dei 92 elettrodi è stato proiettato sul piano orizzontale, quindi il Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle j} th elettrodo è stato descritto da un unico punto Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (x_j,y_j)} .
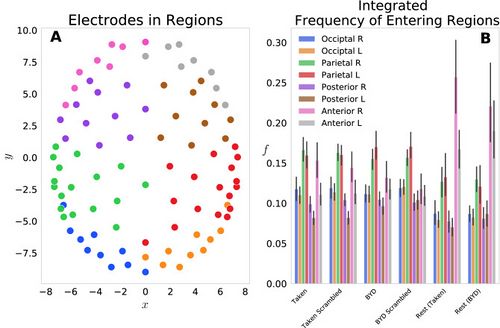
Abbiamo prima esaminato questo modello raggruppando i 92 elettrodi in otto regioni del cuoio capelluto: anteriore L/R, posteriore L/R, parietale L/R, occipitale L/R e le probabilità di ciascun elettrodo nella regione sono state sommate per dare un probabilità a livello di regione. La Figura 1A mostra le posizioni di ciascun elettrodo Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (x_j,y_j)} , con colori diversi che rappresentano ciascuno degli otto gruppi. La figura 1B mostra la frequenza di ingresso in ciascuna regione, raggruppata per le quattro condizioni di attività e due condizioni di riposo.
Ciò riflette il conteggio normalizzato delle probabilità regionali integrate nel tempo.
Abbiamo scoperto che ciascuna regione anteriore veniva inserita più frequentemente a riposo rispetto a quando i soggetti erano impegnati in entrambi i film. In particolare, le regioni anteriori sinistra e destra avevano un cambiamento di stimolo significativo, con Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle P<0.001} (Tukey aggiustato) per preso a Riposo preso—Preso, Riposo preso—Riposo BYD—Riposo BYD e Riposo BYD—Riposo BYD. Ciò è in linea con le scoperte di Axelrod e colleghi che hanno mostrato che l'attivazione nella regione frontale era associata al vagabondaggio della mente.[23][24] Abbiamo riscontrato una soppressione della frequenza nelle regioni posteriori e un aumento della frequenza anteriore a riposo rispetto alle condizioni stimolate, coerentemente con studi fMRI che mostrano una maggiore attivazione nella corteccia cingolata posteriore e nella corteccia prefrontale mediale durante il riposo.[22][24][34][35][36][37] Pertanto, suggerendo che il nostro modello catturi la tendenza frontale associata all'attività cerebrale a riposo.
Spazio delle fasi
Abbiamo anche esplorato lo spazio delle fasi di valore medio di questo sistema. Lo spazio delle fasi per ciascun soggetto è stato tracciato come posizione media e momento lungo la direzione Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle x} , Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (\langle x(t)\rangle,\langle p_x(t)\rangle)} oppure come posizione media e momento lungo la direzione Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle y} ,Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (\langle y(t)\rangle,\langle p_y(t)\rangle)} .
La figura 2 mostra i centroidi dei grafici a dispersione dello spazio delle fasi per ciascun soggetto con un'ellisse che rappresenta l'intervallo di confidenza della deviazione standard. Si noti che i valori vengono riportati solo per gli stimoli intatti poiché un'analisi della varianza mostra che i film criptati e intatti sono indistinguibili nello spazio delle fasi (Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle P<0.85} , Tukey regolato). Le figure 2A e B mostrano la proiezione del baricentro dello spazio delle fasi sul piano attraversato da Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle x} e Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle p_x} per "Bang! Sei morto” e “Preso” rispettivamente, e Fig. 2C ed il piano D Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle y,p_y} . La posizione media lungo l'asse Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle y} Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (\langle y\rangle)} per lo stimolo intatto ("BYD" e "Preso") e le loro forme criptate sono significativamente diverse dalle controparti di riposo pre-stimolo conFailed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle P<0.001} (aggiustato da Tukey) mentre i centroidi di attività positivi e a riposo sono indistinguibili nel piano Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle x} (Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle P<0.05} , Tukey aggiustato).
Le medie del gruppo sono riportate nella Tabella Tabella 11 insieme alle loro deviazioni standard. Questi valori sono il valore medio dei centroidi (media dei punti centrali entro gli stimoli in Fig. 2) per la rispettiva posizione/momento all'interno di ciascun livello di stimolo. Come si vede anche in Fig. 2C e D, c'è una sorprendente differenza di un ordine di grandezza per Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle \langle y\rangle} tra le condizioni di riposo e di attività, ma nessuna differenza marcata in Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle x} , Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle \langle p_x\rangle} o Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle \langle p_y\rangle} .
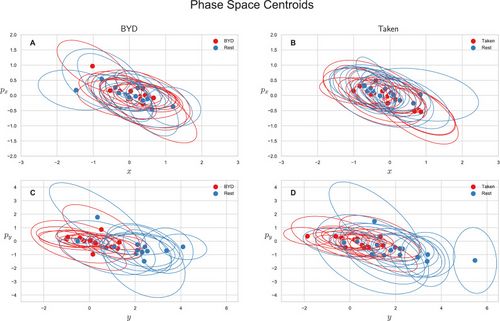
Tabella 1
Medie di gruppo dei centroidi.
| Stimulo | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle \langle x\rangle} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle \langle y\rangle} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle \langle p_x\rangle} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle \langle p_y\rangle} |
|---|---|---|---|---|
| Taken | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (-1.4\pm5.8)\times10^{-1}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (2.4\pm8.0)\times10^{-1}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (-5.8\pm27.0)\times10^{-2}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (-1.0\pm4.1)\times10^{-1}} |
| Taken Scrambled (destrutturato) | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (-7.7\pm35.0)\times10^{-2}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (1.1\pm9.3)\times10^{-1}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (4.1\pm13.0)\times10^{-2}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (6.3\pm35.0)\times10^{-2}} |
| Bang! You’re Dead | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (1.2\pm4.7)\times10^{-1}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (3.5\pm74.0)\times10^{-2}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (2.6\pm33.0)\times10^{-2}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (-3.0\pm42.0)\times10^{-1}} |
| Bang! You’re Dead (destrutturato) | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (1.4\pm5.7)\times10^{-1}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (-2.6\pm7.5)\times10^{-1}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (-1.5\pm2.8)\times10^{-1}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (-5.5\pm53.0)\times10^{-2}} |
| Rest (Pre-Taken) | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (-1.3\pm4.6.0)\times10^{-1}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (2.0\pm1.4)\times10^{0}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (9.1\pm19.0)\times10^{-2}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (-6.3\pm7.3)\times10^{-1}} |
| Rest (Pre-BYD) | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (1.1\pm66.0)\times10^{-3}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (1.9\pm1.2)\times10^{0}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (1.0\pm26.0)\times10^{-2}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (-4.3\pm7.5)\times10^{-1}} |
Differenze significative si notano solo per la fase di riposto acquisito prima di Taken e Bang! Sei morto quando confrontati la posizione Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle y} media con una delle loro controparti di attività (stimolo destrutturato e intatto).
Medie di gruppo dei centroidi.
Questa analisi ha rivelato due risultati notevoli. In primo luogo, c'era una mancanza di differenze significative nella quantità di moto del cervello lungo la direzione Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle x} e Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle y} . In secondo luogo, le medie dei momenti non erano significativamente diverse da 0 a livello di gruppo. I momenti positivi o negativi deriva dalla derivata temporale della probabilità e della posizione dell'elettrodo. Poiché la media dei momenti è 0, c'è un numero uguale di elettrodi anteriori e posteriori con probabilità sia in aumento che in diminuzione.
Inoltre, abbiamo esaminato i cambiamenti nei valori di probabilità sia nello stato di riposo che in quello attivo. Le animazioni delle distribuzioni di probabilità sono presenti nel materiale supplementare 1. In queste animazioni, le differenze di riposo e compito sono evidenti attraverso l'evoluzione della probabilità nel tempo.
Principio di indeterminazione
Nonostante la conferma dei precedenti risultati neuroscientifici e l'apparente successo del nostro modello quasi-quantistico, la nostra domanda di ricerca posta sopra rimane solo una risposta a metà. Utilizzando questo modello, abbiamo notato differenze nelle distribuzioni di probabilità e nei centroidi dello spazio delle fasi a riposo rispetto al compito. Tuttavia, abbiamo ancora cercato un parametro dal modello che sarebbe rimasto lo stesso in riposo e attività. A tal fine, abbiamo definito un analogo principio di indeterminazione di Heisenberg della forma,
| Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle \bigtriangleup x(t)\bigtriangleup p_x(t)\geq K_{brain}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (5)} |
La tabella 2 mostra i valori di questa costante (Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle K_{brain}} ) acquisiti in tutte le condizioni, nonché il valore massimo, il valore medio e la deviazione standard. Abbiamo scoperto che questo modello quasi-quantistico porta a un valore minimo costante su Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle \Delta x(t)\Delta p_x(t)} eFailed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle \Delta y(t)\Delta p_y(t)} di Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle 0,78\pm0,41\tfrac{cm^2}{4ms}} con Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle T=0, P=1} .
Si noti che l'unità di Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle \tfrac{cm^2}{4ms}} è il risultato del campionamento dell'EEG a 250 Hz e della massa considerata come unità. Inoltre, il valore medio e la deviazione standard di queste quantità rimangono coerenti tra le condizioni con un valore medio di Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle 9,3\pm4,4\tfrac{cm^2}{4ms}} (Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle T=0, P=1} ) e una deviazione standard di Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle 18\pm29\tfrac{cm^2}{4ms}} Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle T=0, P=1} ).
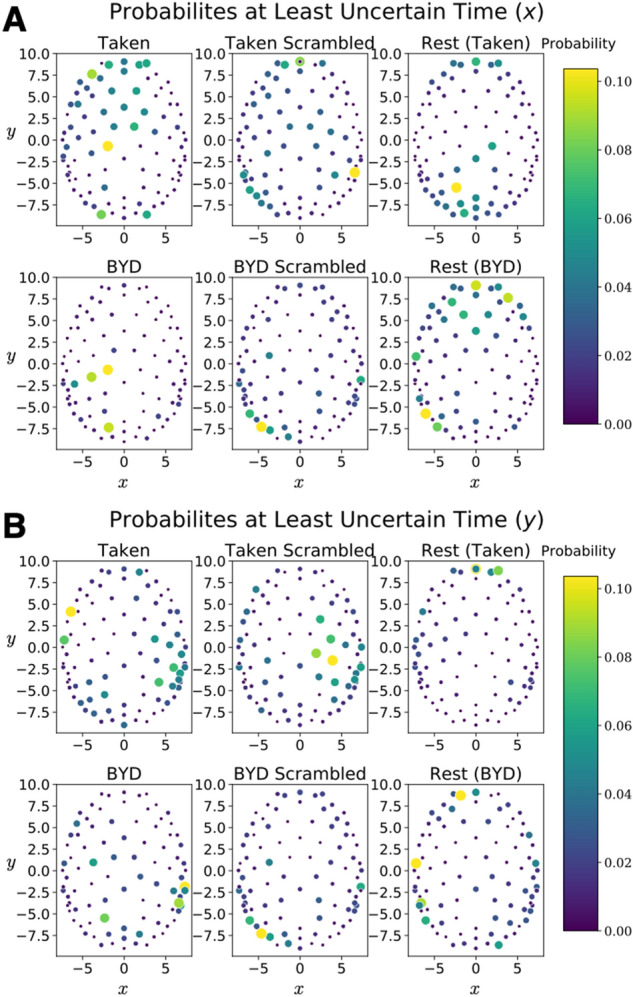
In particolare, il valore massimo varia tra le condizioni, con il valore più grande che si verifica mentre i soggetti guardavano la clip intatta di Bang! Sei morto. Nonostante la posizione media del segnale lungo la direzione Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle y} sia diversa a riposo rispetto a un compito (Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle P<0.001} ), la metodologia matematica quasi quantistica porta a un valore di incertezza costante. Abbastanza sorprendentemente, i valori nella tabella mostrano che l'incertezza media e l'incertezza minima sono le stesse in condizioni diverse, nonostante i massimi varino di oltre due ordini di grandezza. Pertanto, dando ulteriore credito all'idea che questa relazione di incertezza coglie le somiglianze del cervello in condizioni molto diverse. La Figura 3 mostra la distribuzione di probabilità al momento corrispondente al minimo di incertezza sia perFailed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle x} che per Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle y} .
Tabella 2
| Stimolo | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle \Delta x\Delta p_x} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle \Delta y\Delta p_y} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle \Delta x\Delta p_x} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle \Delta y\Delta p_y} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle \Delta x\Delta p_x} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle \Delta y\Delta p_y} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle \Delta x\Delta p_x} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle \Delta y\Delta p_y} |
|---|---|---|---|---|---|---|---|---|
| Taken | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (7\pm2.1)10^{-1}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (7.2\pm1.8)10^{-1}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (1.9\pm1.0)10^{3}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (1.4\pm0.8)10^{3}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (8.2\pm2.2)10^{0}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (8.2\pm2.2)10^{0}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (1.4\pm0.4)10^{1}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (1.3\pm0.4)10^{1}} |
| Taken Destrutturato | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (6.4\pm2.6)10^{-1}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (6.8\pm2.1)10^{-1}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (1.7\pm1.2)10^{3}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (2.1\pm2.2)10^{3}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (8.1\pm1.9)10^{0}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (7.8\pm2.0)10^{0}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (1.4\pm0.4)10^{1}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (1.4\pm0.7)10^{1}} |
| Bang! tu sei morto (BYD) | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (7.6\pm4.9)10^{-1}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (7.5\pm3.1)10^{-1}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (0.1\pm3.1)10^{5}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (0.7\pm1.4)10^{4}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (9.4\pm6.7)10^{0}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (8.3\pm3.6)10^{0}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (4.1\pm8.9)10^{1}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (2.7\pm3.9)10^{1}} |
| Bang! tu sei morto (BYD)
Destrutturato |
Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (7.4\pm3.2)10^{-1}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (7.1\pm2.9)10^{-1}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (2.5\pm1.2)10^{3}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (2.5\pm1.6)10^{3}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (9.3\pm5.1)10^{0}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (8.6\pm4.4)10^{0}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (1.6\pm0.7)10^{1}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (1.5\pm0.8)10^{1}} |
| Rest (Pre-Taken) | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (9.7\pm4.2)10^{-1}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (1.1\pm0.6)10^{0}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (3.5\pm3.1)10^{2}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (3.5\pm1.7)10^{2}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (9.6\pm2.1)10^{0}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (1.3\pm0.4)10^{1}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (1.5\pm0.8)10^{1}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (1.9\pm0.7)10^{1}} |
| Rest (Pre-BYD) | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (6.3\pm3.7)10^{-1}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (8.6\pm6.1)10^{-1}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (3.7\pm2.0)10^{2}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (4.3\pm2.5)10^{2}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (8.7\pm3.3)10^{0}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (1.2\pm0.6)10^{1}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (1.4\pm0.5)10^{1}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\textstyle (1.9\pm0.8)10^{1}} |
Considerando il valore minimo che questi prodotti raggiungono per ogni soggetto, vediamo un valore costante sia in x che in y di Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle 0,78\pm0,41\tfrac{cm^2}{4ms}} , un valore medio di Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle 9,3\pm4,4\tfrac{cm^2}{4ms}} e una deviazione standard costante di Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle 18\pm29\tfrac{cm^2}{4ms}} . L'unità di Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle \tfrac{cm^2}{4ms}} deriva dal campionamento di 250 Hz. I valori massimi differiscono a seconda della stimolazione. I valori sono riportati come media tra soggetti più o meno 1 deviazione standard.
Discussion
Nel presente studio, abbiamo studiato l'estensione spaziale e le proprietà di transizione associate dell'attività neurale nel cervello durante condizioni attive e di riposo e se esistono proprietà di rete sottostanti simili. Abbiamo scoperto che l'applicazione della trasformata di Hilbert ai dati EEG e la sua normalizzazione (Eq. 2) impone una struttura probabilistica al segnale EEG attraverso il cervello (Eq. 3), che abbiamo usato per identificare la probabilità dei modelli spaziali di attività insieme alle transizioni in attività su tutto il cuoio capelluto. Abbiamo riscontrato una maggiore attività anteriore durante il riposo rispetto alla visione del film, sia nell'ampiezza che nello spazio delle fasi. Questo risultato è in linea con i risultati precedenti che mostrano una maggiore attivazione nella regione anteriore durante il riposo.[14][22][34][37][38] Inoltre, normalizzando i segnali EEG con le trasformate di Hilbert ed estraendo valori medi simili a quelli della formulazione della funzione d'onda della meccanica quantistica, siamo stati in grado di calcolare l'incertezza nella "posizione" e nei "momenti" durante il riposo e la visione di film, settata in una nuova costante denominata Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle K_{brain}=0,78\pm0,41\tfrac{cm^2}{4ms}}
È allettante associare la costante relativa alla "posizione" e al "momento" dell'attività neurale a un principio fondamentale, come il principio di indeterminazione di Heisenberg. Tuttavia, non è ancora chiaro cosa significhi questa incertezza. Potrebbe implicare limiti al grado in cui il cervello è accessibile; l'aumento delle informazioni sulla posizione precisa dello stato cerebrale (come descritto dalle nostre "funzioni d'onda" quasi quantistiche) aumenterà l'incertezza su dove sarà in un momento successivo. Questi risultati offrono una prospettiva interessante sul legame tra funzione neurale e processi cognitivi. Ad esempio, quando la "funzione d'onda" si localizza nello spazio lungo un treno di pensieri, ci distraiamo per aumentare l'incertezza, il che potrebbe spiegare perché le menti vagano e i pensieri sono fugaci?
Il valore Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle K_b }
che abbiamo trovato è costante in diverse condizioni di stimolo e indipendente dal numero di elettrodi utilizzati per acquisire i dati? Per testare questo, abbiamo campionato gli elettrodi EEG da 92 a 20 ed eseguito la stessa analisi del testo principale. In linea con 92 canali, abbiamo riscontrato la tendenza anteriore a riposo, ma abbiamo riscontrato che riducendo gli elettrodi a 20 risultava una costante differente Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle K_b= 0,03\pm0,02\tfrac{cm^2}{4ms}}
(Vedi materiale supplementare). Ciò dimostra che il modello è in grado di catturare le differenze di riposo/attività ma potrebbe essere necessario introdurre una condizione di normalizzazione dipendente dal montaggio.
È importante notare che i valori di incertezza di questa forma sono inerenti a qualsiasi variabile coniugata di Fourier, poiché un valore si diffonde in una variabile e si localizza nell'altra. Ciò suggerisce che dopo aver definito il quadrato dell'andamento temporale dell'elettrodo EEG nella trasformata di Hilbert come probabilità ed aver imposto le proprietà di uno spazio di Hilbert sui segnali dell'elettrodo, è possibile estrarre valori di incertezza. Nella meccanica quantistica, questa incertezza stabilisce il limite per le scale che non possono essere osservate. Questo approccio è stato ispirato dalla necessità nelle neuroscienze di nuovi modelli per aiutare a interpretare i dati di neuroimaging. Sebbene questo sia un interessante passo avanti metodologico, dobbiamo comunque determinare se l'incertezza osservata nei dati EEG è supportata da un nuovo principio fondamentale come nella meccanica quantistica o se è solo il risultato di aver costruito due nuove variabili coniugate di Fourier dal Segnale EEG.
È necessario fare ulteriore lavoro per esplorare questa costante rispetto alla ricca tassonomia di compiti e stimoli e ai vari stati di coscienza che sono abitualmente utilizzati nelle neuroscienze cognitive. Questa metodologia potrebbe essere estesa alla fMRI, dove i percorsi temporali BOLD potrebbero essere trasformate di Hilbert creando un analogo tridimensionale del modello EEG presentato in questo articolo.
In definitiva, questo documento ha presentato una nuova metodologia per l'analisi dei dati EEG. Normalizzare i dati e trattarli come un'ampiezza di probabilità ha portato a parametri che cambiavano con la presenza o la mancanza di stimolo, stabilendo contemporaneamente un valore costante indipendente dallo stimolo. Abbiamo applicato con successo un quadro matematico basato sui formalismi della meccanica quantistica al paradigma del riposo e del compito nell'EEG (senza pretendere che il cervello sia un oggetto quantistico). Poiché la neuroscienza continua ad evolversi, anche gli strumenti analitici a sua disposizione devono progredire di conseguenza. Ci auguriamo che questo strumento analitico, insieme ai progressi nella modellazione e nell'apprendimento automatico, aiutino a comprendere la natura della coscienza.
È importante notare che i valori di incertezza di questa forma sono inerenti a qualsiasi variabile coniugata di Fourier, poiché un valore si diffonde in una variabile, si localizza nell'altra. Ciò suggerisce che dopo aver definito il quadrato dell'andamento temporale dell'elettrodo EEG trasformato di Hilbert come probabilità e aver imposto le proprietà di uno spazio di Hilbert sui segnali dell'elettrodo, è possibile estrarre valori di incertezza. Nella meccanica quantistica, questa incertezza stabilisce il limite per le scale che non possono essere osservate. Questo approccio è stato ispirato dalla necessità nelle neuroscienze di nuovi modelli per aiutare a interpretare i dati di neuroimaging. Sebbene questo sia un interessante passo avanti metodologico, dobbiamo comunque determinare se l'incertezza osservata nei dati EEG è supportata da un nuovo principio fondamentale come nella meccanica quantistica, o se è solo il risultato di aver costruito due nuove variabili coniugate di Fourier dal Segnale EEG.
È necessario fare ulteriore lavoro per esplorare questa costante rispetto alla ricca tassonomia di compiti e stimoli e ai vari stati di coscienza che sono abitualmente utilizzati nelle neuroscienze cognitive. Questa metodologia potrebbe essere estesa alla fMRI, dove i corsi temporali BOLD potrebbero essere trasformati da Hilbert creando un analogo tridimensionale del modello EEG presentato in questo articolo.
In definitiva, questo documento ha presentato una nuova metodologia per l'analisi dei dati EEG. Normalizzare i dati e trattarli come un'ampiezza di probabilità ha portato a parametri che cambiavano con la presenza o la mancanza di stimolo, stabilendo contemporaneamente un valore costante indipendente dallo stimolo. Abbiamo applicato con successo un quadro matematico basato sui formalismi della meccanica quantistica al paradigma del riposo e del compito nell'EEG (senza pretendere che il cervello sia un oggetto quantistico). Poiché la neuroscienza continua ad evolversi, anche gli strumenti analitici a sua disposizione devono progredire di conseguenza. Ci auguriamo che questo strumento analitico, insieme ai progressi nella modellazione e nell'apprendimento automatico, aiutino a comprendere la natura della coscienza.
Metodi
Acquisizione dati
Ventotto soggetti sani sono stati reclutati dal Brain and Mind Institute dell'Università dell'Ontario occidentale, in Canada, per partecipare a questo studio. Il consenso scritto informato è stato acquisito prima del test da tutti i partecipanti. L'approvazione etica per questo studio è stata concessa dall'Health Sciences Research Ethics Board e dal Non-Medical Research Ethics Board dell'Università dell'Ontario occidentale e tutta la ricerca è stata eseguita in conformità con le linee guida/normative pertinenti e in conformità con la Dichiarazione di Helsinki.
Due filmati pieni di suspense sono stati usati come stimoli naturalistici in questo studio. Un videoclip dal film muto “Bang! You're Dead" ( Bang! Tu sei morto) e un estratto audio dal film "Taken" sono stati mostrati rispettivamente a 13 e 15 soggetti nelle loro forme originali intatte e distorte. Prima delle due acquisizioni, è stata acquisita una sezione di riposo in cui ai soggetti è stato chiesto di rilassarsi, senza alcuna stimolazione evidente. La presentazione dello stimolo è stata controllata con il plug-in Psychtoolbox per MATLAB[39][39][40][41] su un Apple MacBook Pro da 15″.[42] L'audio è stato presentato in modo binaurale a un volume di ascolto confortevole tramite le cuffie Etymotics ER-1.
I dati EEG sono stati raccolti utilizzando un cuffia a 129 canali (Electrical Geodesics Inc. [EGI], Oregon, USA). Le impedenze degli elettrodi sono state mantenute al di sotto di 50 kΩ con segnali campionati a 250 Hz e riferiti al vertice centrale (Cz). Utilizzando il toolbox EEGLAB MATLAB, i canali rumorosi sono stati identificati e rimossi, quindi interpolati nuovamente nei dati. Un test Kolmogorov-Smirnov (KS) sui dati è stato utilizzato per identificare le regioni che non erano gaussiane. L'analisi delle componenti indipendenti (ICA) è stata quindi utilizzata per identificare visivamente i modelli di attività neurale caratteristici dei movimenti oculari e muscolari che sono stati successivamente rimossi dai dati. La pre-elaborazione dell'EEG è stata eseguita individualmente per ogni soggetto e condizione.
Dei due filmati testati, il primo era un segmento di 8 minuti del film muto televisivo di Alfred Hitchcock “Bang! Sei morto". Questa scena ritrae un bambino di 5 anni che prende in mano la rivoltella di suo zio. Il ragazzo carica un proiettile nella pistola e ci gioca come se fosse un giocattolo. Il ragazzo (e lo spettatore) raramente sa se la pistola ha un proiettile nella sua camera e la suspense aumenta quando il ragazzo gira la camera, la punta verso gli altri e preme il grilletto. In alternativa alla stimolazione visiva, è stato utilizzato anche un estratto audio di 5 minuti dal film "Taken". Questa clip ritrae una conversazione telefonica in cui un padre sente per caso il rapimento delle sue figlie.
Inoltre, sono stati utilizzati due stimoli di controllo "criptati", uno per ogni film. Questo separa le risposte neurali suscitate dalle proprietà sensoriali della visione o dell'ascolto dei film da quelle coinvolte nel seguire la trama. La versione distorta di “Bang! You're Dead" è stato generato isolando i segmenti di 1s mescolando in modo pseudocasuale i segmenti, eliminando così la coerenza temporale della narrazione.[39][43] La versione criptata di "Taken" è stata creata ruotando spettralmente l'audio, rendendo così il discorso indecifrabile.[43][44] I filmati distorti sono stati presentati prima delle versioni intatte per evitare potenziali effetti di trascinamento della narrazione. Prima che i soggetti guardassero/ascoltassero lo stimolo codificato, veniva acquisito un breve segmento di EEG a riposo.
Modello
Ciascuno degli elettrodi Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle j} è descritto da una coppia ordinata Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle x_j,y_j,z_j} nello spazio tridimensionale. Per completare questa analisi, gli elettrodi sono stati prima proiettati sul piano Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle x,y} , rimuovendo la profondità della testa. La figura 1A mostra le posizioni di ciascun elettrodo in questo spazio Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle 2D} . A seguito di questa proiezione, gli andamenti temporali per ciascuno dei 92 elettrodi sono stati trasformate di Hilbert e quindi normalizzati secondo la procedura elencata utilizzando l'Eq. (2). Una probabilità è stata definita in questo spazio di posizione degli elettrodi come il quadrato dell'andamento temporale della trasformata di Hilbert (Eq. 3), analogo alle funzioni d'onda della meccanica quantistica. Otto regioni (L/R anteriore, L/R posteriore, L/R parietale, L/R occipitale) sono state quindi definite raggruppando i 92 elettrodi e le frequenze di ingresso in ciascuna regione fG sono state ottenute sommando le probabilità degli elettrodi all'interno del gruppo, poi integrandosi nel tempo.
| Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle Prob_G(t)=\sum_{j=1}^{92} \Psi_k^* (t)\times\Psi_k (t); f_G=\tfrac{1}{T}\sum_{j=1}^{T}Prob_G(t)} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (6)} |
dove ciascuno degli otto gruppi indicati dal pedice ha un numero diverso di elettrodi costituenti N. Nell'occipite sinistro e destro ci sono 10 elettrodi ciascuno, nel parietale sinistro e destro ci sono 17 elettrodi ciascuno, nel posteriore sinistro e destro ci sono rispettivamente 10 e 11 elettrodi, e nella parte anteriore sinistra e destra ci sono rispettivamente 8 e 9 elettrodi.
Dopo aver ottenuto le frequenze a livello di gruppo, i valori medi per posizione e quantità di moto sono stati calcolati utilizzando le equazioni. (4) e (5) (con espressioni identiche per Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle y} ). Infine, per accertare il nostro analogo principio di indeterminazione, abbiamo cercato espressioni della forma
| Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle \bigtriangleup x=\sqrt{\langle x^2(t)\rangle-\langle x(t)\rangle^2}; \bigtriangleup p_x=\sqrt{\langle p_x^2(t)\rangle-\langle p_x(t)\rangle^2}} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (7)} |
L'espressione for può essere prontamente applicata alle probabilità e posizioni come sopra definite, risultando nel primo termine dato da
| Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle \langle x^2(t)\rangle=\sum_{j=1}^{92}P_j(t) x_j^2} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (8)} |
E il secondo termine dato dal quadrato dell'Eq. (4). Il secondo termine di Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle \Delta P_x} è dato dal quadrato dell'Eq. (5), ma il primo termine è più sfumato. Ciò è dovuto al numero complesso restituito quando si agisce due volte sull'operatore derivato sulla probabilità. Per ovviare a questo, le trasformate di Fourier sono state utilizzate per cambiare l'Eq. (5) nella base della quantità di moto che ha quindi consentito il calcolo efficiente di Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle P_x^2(t)} .
Indicando 0 come la probabilità dello spazio di moto ottenuta attraverso una trasformata di Fourier bidimensionale e non uniforme della pseudo-funzione d'onda dello spazio delle posizioni, l'Eq. (5) può essere riscritto come,
Indicando Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle \tilde{P}_j(t)} come la probabilità dello spazio di moto ottenuta attraverso una trasformata di Fourier bidimensionale e non uniforme della pseudo-funzione d'onda dello spazio delle posizioni, l'Eq. (5) può essere riscritto come,
| Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle \langle p_x(t)\rangle=\sum_{j=1}^{92}\tilde{P}_j(t)p_j} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (9)} |
Portando al primo termine nell'espressione da scrivere come,
| Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle \langle p_x^2(t)\rangle=m^2\sum_{j=1}^{92}\tfrac{x_j^2}{\tilde{p}_j(t)}[{d \over dt}P_j(t)]^2} | Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle (10)} |
Il wrapper Python FINUFFT è stato utilizzato per prendere la trasformata di Fourier utilizzando un tipo 3, 2d FFT non uniforme,[45][46] ed è stato trovato il valore minimo nel tempo della relazione di incertezza. I punti nello spazio della quantità di moto sono stati campionati su Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle p_x\in[-4,4]} e Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle p_y\in[-4,5]} insieme ai due punti aggiuntivi (Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle [-5,-4]} ) e (Failed to parse (MathML with SVG or PNG fallback (recommended for modern browsers and accessibility tools): Invalid response ("Math extension cannot connect to Restbase.") from server "https://wikimedia.org/api/rest_v1/":): {\displaystyle [-4,-5]} )
La figura 4 mostra rispettivamente le probabilità di posizione e quantità di moto nella loro base. Un'animazione che mostra come questi si evolvono nel tempo per le diverse condizioni è presentata nel materiale supplementare 2.

Per calcolare i valori riportati nella tabella 2, è stato trovato il valore corrispondente per ciascun soggetto e questi sono stati utilizzati per calcolare la media di gruppo qui riportata.
Informazioni supplementari
Supplementary Figures.(28M, docx)
Supplementary Information.(375K, docx)
Acknowledgements
We would like to thank Silvano Petrarca for his continued assistance in devising the model. This study was funded by the NSERC Discovery Grant (05578–2014RGPIN), CERC (215063), CIHR Foundation Fund (167264). AMO is a Fellow of the CIFAR Brain, Mind, and Consciousness Program.
Author contributions
N.J.M.P., C.M. and G.L. performed the analysis. A.S., B.S. and N.J.M.P. developed the model. A.S. and B.S. supervised the analysis. N.J.M.P., A.S., G.L. and B.S. wrote the manuscript. A.M.O. revised the manuscript.
Competing interests
The authors declare no competing interests.
Footnotes
Publisher's note
Springer Nature remains neutral with regard to jurisdictional claims in published maps and institutional affiliations.
These authors contributed equally: Bobby Stojanoski and Andrea Soddu.
Supplementary Information
The online version contains supplementary material available at 10.1038/s41598-021-97960-7.
Article information
Sci Rep. 2021; 11: 19771.
Published online 2021 Oct 5. doi: 10.1038/s41598-021-97960-7
PMCID: PMC8492705
PMID: 34611185
Nicholas J. M. Popiel,1,2 Colin Metrow,1 Geoffrey Laforge,3 Adrian M. Owen,3,4,5 Bobby Stojanoski,#4,6 and Andrea Soddu#1,3
1The Department of Physics and Astronomy, The University of Western Ontario, London, ON N6A 5B7 Canada
2Cavendish Laboratory, University of Cambridge, Cambridge, CB3 0HE UK
3The Brain and Mind Institute, The University of Western Ontario, London, ON N6A 5B7 Canada
4The Department of Psychology, The University of Western Ontario, London, ON N6A 5B7 Canada
5The Department of Physiology and Pharmacology, The University of Western Ontario, London, ON N6A 5B7 Canada
6Faculty of Social Science and Humanities, University of Ontario Institute of Technology, 2000 Simcoe Street North, Oshawa, ON L1H 7K4 Canada
Andrea Soddu, Email: asoddu@uwo.ca
Corresponding author.
- Contributed equally.
Received 2021 Apr 28; Accepted 2021 Aug 30.
Copyright © The Author(s) 2021
Open Access
This article is licensed under a Creative Commons Attribution 4.0 International License, which permits use, sharing, adaptation, distribution and reproduction in any medium or format, as long as you give appropriate credit to the original author(s) and the source, provide a link to the Creative Commons licence, and indicate if changes were made. The images or other third party material in this article are included in the article's Creative Commons licence, unless indicated otherwise in a credit line to the material. If material is not included in the article's Creative Commons licence and your intended use is not permitted by statutory regulation or exceeds the permitted use, you will need to obtain permission directly from the copyright holder. To view a copy of this licence, visit http://creativecommons.org/licenses/by/4.0/.
Articles from Scientific Reports are provided here courtesy of == Nature Publishing Group ==
- ↑ Biswal B, Zerrin Yetkin F, Haughton VM, Hyde JS, «Functional connectivity in the motor cortex of resting human brain using echo-planar MRI», in Magn Reson Med, 1995».
PMID:8524021
DOI:10.1002/mrm.1910340409 - ↑ Hutchison RM, Womelsdorfb T, Allenc EA, Bandettini PA, Calhound VD, Corbetta M, Della Penna S, «Dynamic functional connectivity: Promise, issues, and interpretations», in Neuroimage, 2013».
PMID:23707587 - PMCID:PMC3807588
DOI:10.1016/j.neuroimage.2013.05.079 - ↑ Eickhoff SB, Yeo BTT, Genon S, «Imaging-based parcellations of the human brain», in Nat Rev Neurosci, 2018».
PMID:30305712
DOI:10.1038/s41583-018-0071-7 - ↑ Dajani DR, Burrows CA, Odriozola P, Baez A, Nebel MB, Mostofsky SH, Uddin LQ, «Investigating functional brain network integrity using a traditional and novel categorical scheme for neurodevelopmental disorders», in NeuroImage Clin, 2019».
PMID:30708240 - PMCID:PMC6356009
DOI:10.1016/j.nicl.2019.101678 - ↑ Uddin LQ, Karlsgodt KH, «Future directions for examination of brain networks in neurodevelopmental disorders», in J Clin Child Adolesc Psychol, Society of Clinical Child & Adolescent Psychology, 2018».
PMID:29634380 - PMCID:PMC6842321
DOI:10.1080/15374416.2018.1443461 - ↑ Sripada C, Rutherford S, Angstadt M, Thompson WK, Luciana M, Weigard A, Hyde LH, «Prediction of neurocognition in youth from resting state fMRI», in Mol Psychiatry, 2020».
PMID:31427753 - PMCID:PMC7055722
DOI:10.1038/s41380-019-0481-6 - ↑ Biswal BB, Eldreth DA, Motes MA, Rypma B, «Task-dependent individual differences in prefrontal connectivity», in Cereb Cortex, Oxford University Press, 2010, Oxford, UK».
PMID:20064942 - PMCID:PMC2923215
DOI:10.1093/cercor/bhp284
This is an Open Access resource! - ↑ Fox MD, Raichle ME, «Spontaneous fluctuations in brain activity observed with functional magnetic resonance imaging», in Nat Rev Neurosci, 2007».
PMID:17704812
DOI:10.1038/nrn2201 - ↑ Kraus Brian T, Perez Diana, Ladwig Zach, Seitzman Benjamin A, Dworetsky Ally, Petersen Steven E, Gratton Caterina, «Network variants are similar between task and rest states», in Neuroimage, 2021».
PMID:33454409 - PMCID:PMC8080895
DOI:10.1016/j.neuroimage.2021.117743
This is an Open Access resource! - ↑ Kristo Gert, Rutten Geert-Jan, Raemaekers Mathijs, de Gelder Bea, Rombouts Serge ARB, Ramsey Nick F, «Task and task-free FMRI reproducibility comparison for motor network identification», in Hum Brain Mapp, 2014».
PMID:22987751 - PMCID:PMC6869575
DOI:10.1002/hbm.22180 - ↑ Sui J, Adali T, Pearlson GD, Calhoun VD, «An ICA-based method for the identification of optimal FMRI features and components using combined group-discriminative techniques», in Neuroimage, 2009».
PMID:19457398 - PMCID:PMC4356027
DOI:10.1016/j.neuroimage.2009.01.026 - ↑ Calhoun VD, Kiehl KA, Pearlson GD, «Modulation of temporally coherent brain networks estimated using ICA at rest and during cognitive tasks», in Hum Brain Mapp, 2008».
PMID:18438867 - PMCID:PMC2649823
DOI:10.1002/hbm.20581 - ↑ Xie Hua, Calhoun Vince D, Gonzalez-Castillo Javier, Damaraju Eswar, Miller Robyn, Bandettini Peter A, Mitra Sunanda, «Whole-brain connectivity dynamics reflect both task-specific and individual-specific modulation: A multitask study», in Neuroimage, 2018».
PMID:28549798 - PMCID:PMC5700856
DOI:10.1016/j.neuroimage.2017.05.050 - ↑ 14.0 14.1 Naci L, Cusack R, Anello M, Owen AM, «A common neural code for similar conscious experiences in different individuals», in Proc Natl Acad Sci, 2014».
PMID:25225384 - PMCID:PMC4191782
DOI:10.1073/pnas.1407007111 - ↑ Kannurpatti SS, Rypma B, Biswal BB, «Prediction of task-related BOLD fMRI with amplitude signatures of resting-state fMRI», in Front Syst Neurosci, 2012».
PMID:22408609 - PMCID:PMC3294272
DOI:10.3389/fnsys.2012.00007 - ↑ Elliott Maxwell L, Knodt Annchen R, Cooke Megan, Kim M Justin, Melzer Tracy R, Keenan Ross, Ireland David, «General functional connectivity: Shared features of resting-state and task fMRI drive reliable and heritable individual differences in functional brain networks», in Neuroimage, 2019».
PMID:30708106 - PMCID:PMC6462481
DOI:10.1016/j.neuroimage.2019.01.068 - ↑ Cole MW, Ito T, Cocuzza C, Sanchez-Romero R, «The functional relevance of task-state functional connectivity», in Neurosci, 2021».
PMID:33542083 - PMCID:PMC8018740
DOI:10.1523/JNEUROSCI.1713-20.2021 - ↑ Zhang Shu, Li Xiang, Lv Jinglei, Jiang Xi, Guo Lei, Liu Tianming, «Characterizing and differentiating task-based and resting state fMRI signals via two-stage sparse representations», in Brain Imaging Behav, 2016».
PMID:25732072 - PMCID:PMC4559495
DOI:10.1007/s11682-015-9359-7 - ↑ Monier C, Chavane F, Baudot P, Graham LJ, Frégnac Y, «Orientation and direction selectivity of synaptic inputs in visual cortical neurons: A diversity of combinations produces spike tuning», in Neuron, 2003».
PMID:12597863
DOI:10.1016/S0896-6273(03)00064-3 - ↑ Churchland MM, et al. Stimulus onset quenches neural variability: A widespread cortical phenomenon. Nat. Neurosci. 2010;13:369–378. doi: 10.1038/nn.2501. [PMC free article][PubMed] [CrossRef] [Google Scholar]
- ↑ He BJ. Spontaneous and task-evoked brain activity negatively interact. J. Neurosci. 2013;33:4672–4682. doi: 10.1523/JNEUROSCI.2922-12.2013. [PMC free article][PubMed] [CrossRef] [Google Scholar]
- ↑ 22.0 22.1 22.2 Bonnard M, et al. Resting state brain dynamics and its transients: A combined TMS-EEG study. Sci. Rep. 2016;6:1–9. doi: 10.1038/srep31220. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ 23.0 23.1 Axelrod V, Zhu X, Qiu J. Transcranial stimulation of the frontal lobes increases propensity of mind-wandering without changing meta-awareness. Sci. Rep. 2018;8:1–14. doi: 10.1038/s41598-018-34098-z. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ 24.0 24.1 24.2 Axelrod V, Rees G, Lavidor M, Bar M. Increasing propensity to mind-wander with transcranial direct current stimulation. Proc. Natl. Acad. Sci. U. S. A. 2015;112:3314–3319. doi: 10.1073/pnas.1421435112. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ 25.0 25.1 Townsend JS. A Modern Approach to Quantum Mechanics.University Science Books; 2012. [Google Scholar]
- ↑ Heisenberg W. Über den anschaulichen Inhalt der quantentheoretischen Kinematik und Mechanik. Z. Phys. 1927;43:172–198. doi: 10.1007/BF01397280. [CrossRef] [Google Scholar]
- ↑ Penrose R. The Emperor’s New Mind. Viking Penguin; 1990. [Google Scholar]
- ↑ Penrose R. Shadows of the Mind: A Search for the Missing Science of Consciousness. Oxford University Press; 1994. [Google Scholar]
- ↑ Atmanspacher H. Quantum Approaches to Consciousness.Stanford Encyclopedia of Philosophy; 2004. [Google Scholar]
- ↑ Hameroff S. How quantum brain biology can rescue conscious free will. Front. Integr. Neurosci. 2012;6:93. doi: 10.3389/fnint.2012.00093. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Freeman WJ, Vitiello G. Nonlinear brain dynamics as macroscopic manifestation of underlying many-body field dynamics. Phys. Life Rev. 2006;3:93–118. doi: 10.1016/j.plrev.2006.02.001.[CrossRef] [Google Scholar]
- ↑ le Van Quyen M, et al. Comparison of Hilbert transform and wavelet methods for the analysis of neuronal synchrony. J. Neurosci. Methods. 2001;111:83–98. doi: 10.1016/S0165-0270(01)00372-7.[PubMed] [CrossRef] [Google Scholar]
- ↑ Freeman WJ. Deep analysis of perception through dynamic structures that emerge in cortical activity from self-regulated noise. Cogn. Neurodyn. 2009;3:105–116. doi: 10.1007/s11571-009-9075-3.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ 34.0 34.1 Wang RWY, Chang WL, Chuang SW, Liu IN. Posterior cingulate cortex can be a regulatory modulator of the default mode network in task-negative state. Sci. Rep. 2019;9:1–12. [PMC free article][PubMed] [Google Scholar]
- ↑ Uddin LQ, Kelly AMC, Biswal BB, Castellanos FX, Milham MP. Functional connectivity of default mode network components: Correlation, anticorrelation, and causality. Hum. Brain Mapp. 2009;30:625–637. doi: 10.1002/hbm.20531. [PMC free article][PubMed] [CrossRef] [Google Scholar]
- ↑ Stawarczyk D, Majerus S, Maquet P, D’Argembeau A. Neural correlates of ongoing conscious experience: Both task-unrelatedness and stimulus-independence are related to default network activity. PLoS One. 2011;6:e16997. doi: 10.1371/journal.pone.0016997.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ 37.0 37.1 Greicius, M. D., Krasnow, B., Reiss, A. L., Menon, V. & Raichle, M. E. Functional Connectivity in the Resting Brain: A Network Analysis of the Default Mode Hypothesis. www.pnas.org. [PMC free article] [PubMed]
- ↑ Christoff K, Gordon AM, Smallwood J, Smith R, Schooler JW. Experience sampling during fMRI reveals default network and executive system contributions to mind wandering. Proc. Natl. Acad. Sci. U. S. A. 2009;106:8719–8724. doi: 10.1073/pnas.0900234106.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ 39.0 39.1 39.2 Brainard DH. The psychophysics toolbox. Spat. Vis. 1997;10:433–436. doi: 10.1163/156856897X00357. [PubMed] [CrossRef] [Google Scholar]
- ↑ Kleiner M, et al. What’s new in psychtoolbox-3. Perception. 2007;36:1–16. [Google Scholar]
- ↑ Pelli DG. The VideoToolbox software for visual psychophysics: Transforming numbers into movies. Spat. Vis. 1997;10:437–442. doi: 10.1163/156856897X00366. [PubMed] [CrossRef] [Google Scholar]
- ↑ Makeig, S. & Onton, J. ERP features and EEG dynamics: An ICA perspective. In The Oxford Handbook of Event-Related Potential Components (Oxford University Press, 2012). 10.1093/oxfordhb/9780195374148.013.0035.
- ↑ 43.0 43.1 Laforge G, Gonzalez-Lara LE, Owen AM, Stojanoski B. Individualized assessment of residual cognition in patients with disorders of consciousness. NeuroImage Clin. 2020;28:102472. doi: 10.1016/j.nicl.2020.102472. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Naci L, Sinai L, Owen AM. Detecting and interpreting conscious experiences in behaviorally non-responsive patients. Neuroimage. 2017;145:304–313. doi: 10.1016/j.neuroimage.2015.11.059.[PubMed] [CrossRef] [Google Scholar]
- ↑ Barnett AH, Magland J, Klinteberg LAF. A parallel nonuniform fast Fourier transform library based on an “Exponential of semicircle” kernel. SIAM J. Sci. Comput. 2019;41:C479–C504. doi: 10.1137/18M120885X. [CrossRef] [Google Scholar]
- ↑ Barnett, A. H. Aliasing error of the kernel in the nonuniform fast Fourier transform. arXiv:2001.09405 [math.NA] (2020).
particularly focusing on the field of the neurophysiology of the masticatory system