5° Clinical case: Spontaneous Electromyographic Activity
When addressing topics concerning Orofacial Pain (OP) or Temporomandibular Disorders (TMDs) one often comes across statements worthy of more attention such as the statement the influence of unilateral posterior crossbite on changes in spontaneous muscle activity in the resting position mandibular and in maximum voluntary contraction. These statements lead to a deeper knowledge of the phenomenon of spontaneous activity of Motor Units (MUs) which is not trivial given the complexity of the factors and processes involved in this clinical manifestation. For this reason we present a 5th Clinical case: Spontaneous Electromyographic Activity in a referred subject with previous diagnosis of TMDs. By the end of the chapter, you will understand our suggestion regarding increased attention to experimentation design in the field of trigeminal neurophysiology.
Introduction
In this chapter we will address another subject, much discussed but also much followed and proposed as a diagnostic test in particular in patients with Orofacial Pain (OP) and Temporomandibular Disorders (TMDs), that of electromyography in a muscle in resting conditions which causes immediately the usual Hamletic question:
(....maybe!!)
Zieliński et al.[1] noted that changes in electromyographic patterns of masticatory muscles may be associated with the presence of pain due to active myofascial trigger points (MTrPs)[2][3][4][5][6] and furthermore, during electromyography examination, significantly higher values of activity at rest within the anterior temporalis muscle were observed among MTrPs and TMDs patients compared to healthy individuals. The authors conclude that this altered pattern may be related to the presence of active MTrPs in the trapezius muscle, which, as a result of a referred pain mechanism, alters the activity of the anterior temporal (TA)
Furthermore, the same author[7] has reviewed numerous clinical studies demonstrating that depression has a substantial effect on the stomatognathic system, including the activity of the masticatory muscles, which can lead to temporomandibular disorders. Furthermore, an increase in the bioelectrical activity of the masseter muscles was observed in subjects with depressive symptoms.[8] Therefore, the aim of the study by Zieliński et al. was to determine the influence of depression quantified through the axis II protocol of RDC/TMD on the resting bioelectrical activity of the masseter and temporalis muscles. The conclusion was that moderate depression determined on the basis of the RDC/TMDs II axis questionnaire is not related to the resting activity of the selected masticatory muscles and that further research should be continued on a larger group of respondents in order to establish the relationship between psychological factors and bioelectrical parameters of masticatory muscles.
In our opinion it would be somewhat complex and perhaps irrational to try to correlate the activity of the masticatory muscles at rest in subjects suffering from more or less severe depression because the phenomenon of electrical activity in the muscles at rest is called 'spontaneous activity' in neurophysiological jargon and it is a phenomenon with a non-trivial explanation. If this phenomenon is not at least broadly clarified, the myriad of physiopathogenetic interpretations circulating in the dental field can lead to a diagnostic error.
For this reason we will present a clinical case reporting Orofacial Pain (OP) and Temporomandibular Disorders (TMDs) which, unfortunately, had encountered diagnostic difficulties in previous medical experiences.
5° Clinical case: Spontaneous Electromyographic Activity
65-year-old female patient reporting mainly Orofacial Pain (OP) in the left emirate of the face and in particular pain radiating from the masseters to the TMJ and left temporalis muscle. After about 2 years from an episode of sudden loss of consciousness at the moment in which his dentist performed a trochlear for periodontology of the lower left immigrant. From that moment on, sudden pains of the unthoracic type began and then spread to the whole left hemiface even when chewing. Colleagues saw the correlation with chewing and analyzed following the RDC protocol and defined the patient as suffering from Temporomandibular Disorders (TMDs)
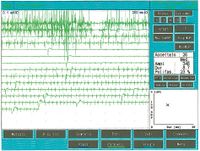
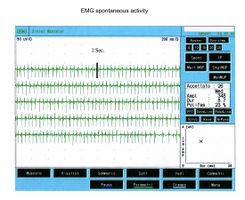
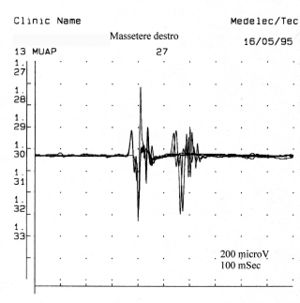
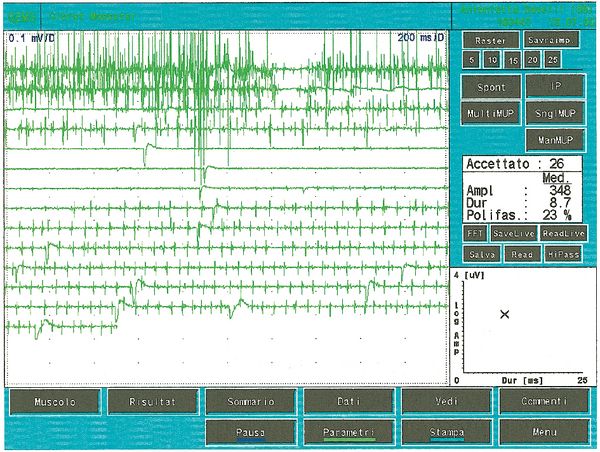
Once it came to our attention, we followed all the gnathological tests (axiography, ATMs images, and surface EMGs) which did not testify for a TMDs but for an undefined but substantially neurological picture. The reason for this interpretation was precisely the execution of the surface EMG which returned the following results. The electromyographic picture of the masseters was determined following a logical sequence shown in figure 1. As can be observed, the lateral asymmetry of the EMG activity with surface electrodes of the masseters in a relaxed state (fig.1A) with the jaw maintained in rest position it was such as to require a needle EMG of the left masseter. The activity recorded with this technique (fig.1B) showed a discharge with a stable frequency of 20 Hz which presupposed a study of the motor unit. The study of the motor units of the left masseter (fig.1C) automatically selected 26 motor units whose shape, duration, spikes and turns of each unit were analysed. The data are reported in the table (fig.1D) Statistically, the following parameters can be detected: average amplitude of, a duration of , of polyphasic units. This clinical picture represents the typical pathophysiological phenomenon in which the patient reports pain but very often the diagnosis remains "difficulty in muscle relaxation", "atypical orofacial pain" or even better "fibromyalgia" and consequently the drug therapy remains symptomatic. Precisely these conditions should give the doctor the opportunity to deepen his research by carrying out and knowing at least in general terms the constituents of a coaxial needle EMG analysis, before referring the patient to a neurologist specialist.
Needle EMG steps
The EMG examination of skeletal muscles consists of four steps:
- Insertion activity when the needle electrode is inserted into the muscle
- Spontaneous activity when the muscle is at rest
- Motor unit potentials evoked by isolated motor discharges during moderate voluntary contraction
- Recruitment or interference pattern during progressive level of contraction
Insertion activity
In one subject, the insertion activity appears as high-frequency positive and negative spikes in a single group and are typically a representation of muscle fiber damage or mechanical stimulation due to needle penetration into the muscle. In our patient this activity occurred with a duration of 80 mS and was referable to a normal picture. Also note the phenomenon of plaque activity. If a needle electrode is held stationary at one point in the muscle, normal muscles at rest show absolutely no electrical activity except in the region of the neuromuscular endplate. These consist of two components: low amplitude (on the order of 10-50 μV) and low duration (1-2 msec) which to the loudspeaker EMG resemble the sound of sea shells on the ear. In our case (fig.1A) the total absence of plaque activity in the right masseter can be explained by the recording performed with surface electrodes which partially reduce the energy of the signal but the activity recorded on the left masseter, again with surface, has a width of . For the same reasoning, this activity should not be considered as plate activity since, as can be seen in fig. 1B, recording of the left masseter performed with a coaxial electrode, the amplitude is . Sometimes plaque potential spikes are indistinguishable in waveform from fibrillation potentials which also show initial negativity when recorded near the plaque. Another curious element is the similarity of the discharge model between the discharges of the neuromuscular spindles and of the plate potentials, so much so that some authors[9] hypothesized that these potentials could originate from the intrafusal muscle fibers. The discussion and the electrophysiological meaning to be given to the electrical activity observable in fig. 1B.
Spontaneous activity
In the first 2 weeks after denervation, the sensitivity of a muscle fiber to acetylcholine (ACh) increases up to 100-fold. This phenomenon known as “denervation hypersensitivity” may explain the spontaneous firing of denervated muscle fibers in response to minute ACh quanta.[10] The fact that the infusion of curare blocks the receptors of the neuromuscular plate but does not abolish the spontaneous discharge, that the denervation of the frog muscle can lead to an increased sensitivity to ACh but not generate spontaneous activity. [11]. These studies have suggested an alternative hypothesis that of slow changes in membrane potentials of metabolic origin which can periodically reach a critical level and evoke propagated spikes.[12]
These studies have suggested an alternative hypothesis that of slow changes in membrane potentials of metabolic origin which can periodically reach a critical level and evoke propagated spikes. Typical spontaneous activity phenomena, however, include fibrillation potentials, positive spike waves, fasciculation potentials, myochemical discharges, and complex repetitive discharges. Without going into overly specialized topics and considering the electrophysiological recordings of the clinical case, it is sufficient to deal with positive spike waves, fibrillation and fasciculation. Positive peak waves are sawtooth discharges that discharge spontaneously and continuously.
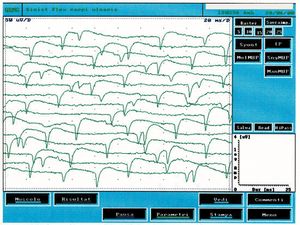
This type of activity is found in denervated muscles but also in a variety of myogenic conditions. In figure 2 it is possible to observe a typical tracing of spontaneous activity of positive peak waves which, compared with the clinical case under examination (fig.1B), are clearly different. By fibrillation, on the other hand, we mean potentials with a duration of and amplitude of with biphasic or triphasic waveforms and initial positivity. Fibrillation potentials triggered by spontaneous oscillations in the membrane potential typically fire at frequencies of with an average of . This phenomenon represents the spontaneous activity of one or more muscle fibers and is pathognomonic of denervation although it can appear in healthy muscles. The presence of reproducible discharges in at least two different areas of muscle usually suggests a secondary motor neuron disorder that includes anterior horn cell pathology, radiculopathies, plexopathies, axonal mono- and polyneuropathies as well as certain myopathies.
In figura 3 possiamo osservare un tipico tracciato di attività spontanea da denervazione e confrontarlo con il tracciato in figura 1C in cui si possono notare delle diversità elettrofisiologiche. L’attività spontanea di fibrillazione ha un ampiezza di , la frequenza risulta essere con andamento random mentre nel caso clinico riportato (fig.1C) l’ampiezza era di e la frequenza più alta () ma particolarmente stabile quasi a significare un pacemaker centrale.
Per evitare confusione terminologica e clinica tra fibrillazione e fascicolazione Danny-Brown e Pennybacker[13] proposero il termine di fascicolazione per descrivere la spontanea contrazione (twitch) di unità motorie. Le fascicolazione, perciò, rappresentano la scarica spontanea di un gruppo di fibre muscolari riferibili all’intera o parziale parte dell’unità motoria. Isolate scariche di una unità motoria con complesse bursts di ripetitive scariche causano movimenti vermicolari della pelle chiamati miochimie.[14]
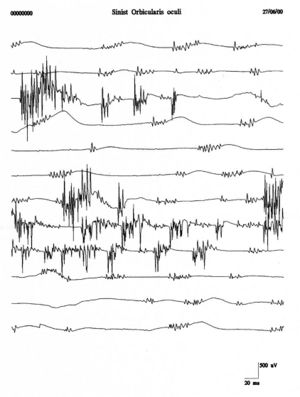
Scariche ripetitive della stessa unità motoria occorrono in bursts a intervalli regolari di con spikes che scaricano a in ciascun burst. I potenziali di fascicolazione sono tipicamente associati con patologie delle cellule delle corna anteriori ma sono anche osservate in radicolopatie, neuropatie da intrappolamento, e la sindrome di fascicolazione dolorosa muscolare. In figura 4 si può osservare un chiaro esempio di fascicolazioni del muscolo orbicolare dell’occhio che confrontato con i tracciati del caso clinico (fig.1B e C) mostra una totale diversità morfologica e di rappresentazione temporale. Questa diversità rafforzerebbe l’esclusione di una patologia da denervazione.
Potenziali di Unità Motoria
Una unità motoria può essere definita dall’ampiezza, il rise time, dalla durata e dalle fasi come verrà meglio descritto nel capitolo 'Elettromiografia'. L’ampiezza registrata varia ampiamente con la posizione della punta dell’elettrodo relativa alla sorgente di corrente ionica scaricata, per cui un operatore esperto seleziona un potenziale di unità motoria con una rise time di per essere certi della vicinanza con la sorgente. L’ampiezza nel range della normalità va da centinaia di ad alcuni e la durata da . Per i muscoli facciali, in particolare, ci si riferisce ai valori riportati da Buchthal [15] il cui range è per una età massima di anni. I potenziali di unità motoria bifasici o trifasici sono presenti anche in muscoli normali con una media di di unità con o più fasi.
Il numero di unità polifasiche aumentano sia nelle miopatie, neuropatie o nelle patologie del motoneurone. La polifasia indica, dunque, una dispersione temporale dei potenziali di fibra muscolari dentro una unità motoria. In alcune anormalità chiamate doppiette o triplette una unità motoria spara due o tre volte ad una intervallo di tempo molto corto e sono rappresentative di un disturbo metabolico associato ad ipereccitabilità del pool motoneurale. In figura 5 possiamo osservare un tipico tracciato a minima attività volontaria di MUAP polifasico ed una doppietta che rappresenta uno stato di patologia del motoneurone. Confrontando questa registrazione di unità motoria patologica con alcune della fig.1C, ed in particolare la 5,7,13 e 23 con i valori di ampiezza rispettivi durata e e 8.4 possiamo affermare che l’attività registrata sul massetere di sinistra, del caso clinico in questione, non ha nessuna caratteristica elettrofisiologica sovrapponibile ad un quadro di danno del II motoneurone.
Pattern Interferenziale
Aumentando la contrazione aumentano molto le unità motorie che iniziano a scaricare molto rapidamente e ciò precludono l’identificazione di potenziali di unità motorie individuali. Questo fenomeno ha dato il nome di pattern interferenziale. La densità degli spikes e la media ampiezza delle risposte sommate sono determinate da una serie di fattori come: l’output discendente dalla corteccia, il numero di motoneuroni capaci di scaricare, la frequenza di scarica di ciascuna unità motoria, la forma d’onda di potenziali individuali e la probabilità della cancellazione di fase (collisione). Nel nostro caso clinico il pattern interfernziale registrato sui masseteri risultò normale sia in ampiezza che in frequenza.
Dall’analisi dettagliata del tracciato EMG relativo al caso clinico descritto possiamo confermare l’assenza di un danno organico dell’unità motoria e/o delle fibre muscolari per i vari motivi esposti quali: l’assenza di attività spontanea, la normale morfologia dell’unità motoria e del reclutamento interferenziale. Rimane ancora da interpretare la presenza di attività EMG registrata sul massetere sinistro (fig.1) che, riferendosi ai concetti sopradescritti, non può essere denominata “attività spontanea” perché non espressione di denervazione, ne “mancato rilassamento muscolare” in quanto il paziente è incapace di rilassare il muscolo volontariamente o con manovre di stiramento, ne di “attività EMG a riposo da disturbo psichico in quanto negativi i tests psicometrici.
E’ stato proposto, con il consenso della paziente, uno studio sperimentale in cui si è tentato di disaccoppiare farmacologicamente l’attività neuronale troncoencefalico da quella corticale. Simultaneamente al disaccoppiamento farmacologico veniva monitorato l’attività EMG con ago coassiale sul massetere sinistro e contestualmente il blink reflex. Il modello sperimentale, che andremo a spiegare brevemente, è stato realizzato attraverso due elementi essenziali e cioè: la scelta dell’anestetico specifico per lo scopo dello studio (propofol) ed il controllo della attività elettrofisiologica troncoencefalica attraverso il blink reflex
Propofol: Gli effetti degli anestetici producono perdita di coscienza, di memoria, cambiamenti dell’attività spontanea, attenuazione dei riflessi di protezione, perdita dei riflessi posturali ed anche effetti sfavorevoli come allucinazioni, euforia ed amnesie. Inoltre essi possono influenzare il livello o l’omeostasi dei neurotrasmettitori nel cervello come la dopamina, noraepinefrina e l’acetilcolina (ACh).[16] La Ach fu il primo neurotrasmettitore ad essere descritto ed i neuroni colinergici sono distribuiti ampiamente nel cervello. I meccanismi colinergici sono conosciuti essere importanti nello striato dove un bilanciamento tra dopamina ed il rilascio di ACh assicurano una normale output motorio,[17] nell’ippocampo e nella corteccia frontale dove Ach gioca un ruolo importante per la regolazione della coscienza, memoria ecc.
Il Propofol si pensa potenziare l’effetto inibitorio dei recettori GABAA ed avere un’azione diversa dai barbiturici o benzodiazepine. Un elegante studio[18] realizzato attraverso microdialisi intracerebrale nel topo ha permesso di dimostrare che il propofol, con dosi di 50 mg/kg, diminuisce il rilascio di ACh dalla corteccia frontale del 85%, del 72 % dall’ippocampo e del 19% dallo striato.
Blink reflex: Il blink è un riflesso che si evoca percuotendo la regione sopraccigliare su un lato della fronte. Elettrofisiologicamente è possibile evocarlo applicando uno stimolo elettrico sull’arcata sopracigliare in corrispondenza del forame sovraorbitario. Le risposte vengono registrate attraverso due elettrodi di superficie posizionati sul muscolo orbicolare dell’occhio di ciascun lato e i potenziali motori possono essere rappresentati principalmente da due eventi e cioè dalla risposta R1 ipsilaterale alla stimolazione e la R2 bilaterale. Queste risposte rappresentano una circuiteria monosinaptica e polisinaptica per la R1 e R2 ripettivamente. La risposta R1 è stata considerata seguire un percorso trigeminale nel ponte mentre la R2 attraverso un percorso adiacente la formazione reticolare raggiunge i nuclei facciali.[19][20][21]
Il principale circuito neuronale del blink reflex è localizzato nel tronco encefalico ma recenti lavori, impiegando la Risonanza Magnetica Funzionale (RMNf), hanno dimostrato che due principali aree nel lobo posteriore dell’emisfero cerebellare, principalmente sul lato ipsilaterale alla stimolazione, sono attivate durante i riflessi di ammicamento nell’uomo.[22]
Procedura sperimentale
L’esperimento consistette nel monitorare simultaneamente la presenza del blink relex ( R1 e R2) e l’attività EMG del massetere sinistro con elettrodo ad ago al momento dell’infusione di Propofol a dosi di che determinò una lieve dissociazione-vigile e con occhi aperti. In questo modo si può affermare, con buona approssimazione, che il farmaco lasciò libere le funzioni mesencefalico-bulbari.
Le risposte EMG (fig. 6) furono le seguenti: al momento dell’introduzione del farmaco si assiste ad una breve perdita cosciente del controllo corticale, che gli anestesisti conoscono clinicamente come ipertono transitorio e che elettrofisiologicamente ha determina un aumento del tono muscolare. In figura 6 (fase 1: prime due traccia superiori) si può osservare l’ aumento della frequenza di scarica delle unità motorie che vanno da , prima dell’esperimento (fig.1B), a della fase 1.( Fig. 6, traccia 1 e 2 superiore)
Dopo il farmaco sembra essersi distribuito alle aree corticali-sottocorticali e questo effetto si manifesta elettrofisiologicamente con un rallentamento della frequenza di scarica EMG (fig. 6 traccia 3 e 4 partendo dall'alto). Dopo altri la saturazione delle aree corticali e, presumibilmente, sottocorticali è completa e si assiste ad una assenza totale dell’attività EMG sul massetere sinistro.(fig. 6 traccia 5,6 e 7 partendo dall'alto) Infine il farmaco viene metabolizzato dopo dal silenzio elettrico e contestualmente riappare la costante attività tonica EMG a (fig.6 traccia 8-14).
Il dato più interessante è stato nella fase 3 in cui vi è l’assenza totale di MUAP mentre il blink reflex era ancora evocabile con le sue componenti R1 e R2. Questo spiegherebbe il pacemaker corticale e/o sottocorticale ma non coinvolgerebbe le strutture troncoencefaliche.
Conclusione
Conclusione sperimentale
L’attività EMG presente nel soggetto esaminato non può essere definita “Attività spontanea” perché non presenta caratteristiche di danno organico delle fibre muscolari e/o del II motoneurone. Se si trattasse di danno delle fibre muscolari l’attività EMG sarebbe rimasta anche dopo somministrazione di di propofol. E’ stato osservato, infatti, che dosi di propofol di fallirono nel annullare le fascicolazioni indotte da somministrazione di 1mg/kg di succinilcolina.[23] L’attività EMG presente nel soggetto non può essere descritta come “Incacacità di rilassamento” perché termine troppo generico sia riferito a condizioni di turbe psichiche che a disturbi distonici. Nelle distonie oromandibolari si assiste,infatti, a fasi di silenzio EMG quando si chiede al paziente di deviare la mandibola su un lato nel tentativo di stirare il muscolo coinvolto. Questo effetto è determinato da un aggiuntivo input delle fibre propriocettive muscolari.
La scomparsa dell’attività EMG a dosi di di propofol, dose capace di interferire con i sistemi corticali, sottocorticali e striatali mantenendo integre le funzioni troncoencefaliche e ponto-bulbari, dimostra che il pacemaker è ad un livello superiore del tronco encefalico.
L’attività EMG registrata si può finalmente definire “Attività EMG involontaria" e risponde ad un pacemaker di origine centrale. Questa continua attività EMG determinerebbe, a lungo andare, un danno delle miofibrille e la mioglobina, sostanza algogena, sarebbe la causa terminale del dolore riferito dalla paziente.
La paziente, dunque, poteva essere affetta con più ampia probabilità da “Distonia focale oromandibolare" più che da "Disordini Tempormandibolari" accompagnata da fenomeni di bruxismo anche diurno. Evidenze farmacologiche, infatti, suggeriscono che il sistema dopaminergico centrale può essere implicato nella patogenesi della distonia cranio cervicale e nel bruxismo.[24] Lobbezo, infatti, attraverso la PET ha dimostrato una anormale distribuzione di lato nei recettori D2 striatali leganti nel bruxismo e nelle distonie cranio cervicali.[25] Il fatto che il trauma periferico possa causare distonia suggerisce che il sistema sensoriale possa essere importante per la patogenesi della distonia focale e, comunque, esso può interagire solo se il paziente è geneticamente predisposto a sviluppare una distonia post-traumatica.[26] Usando la PET la stimolazione dolorosa termica della mano e l’iniezione intradermica di capsicina possono determina un aumento del flusso ematico nel putamen controlaterale e del globus pallido quando comparati con stimoli non dolorosi termici.[27][28] Inoltre l’espressione dei geni per la prodinorfina, c-Fos e c-Jun è alterata a livello spinale e mesencefalico dopo stimoli dolorosi.[29] Nei distonici, impiegando i PET, il picco di flusso sanguigno in risposta alla vibrazione della mano fu significativamente ridotto sia nella corteccia sensoriale primaria che nella motoria supplementare quando comparata con i soggetti normali.[30] Manifestazioni distoniche nei pazienti furono facilmente provocati dal “riflesso tonico di vibrazione” ma furono marcatamente attenuati dal blocco con lidocaina dei fusi neuromuscolari.[31]
Questi autori suggerirono tre meccanismi che possono spiegare l’aumentata sensibilità alla vibrazione: la perdita della normale inibizione delle afferenze Ia, un’alterazione “centrale” ed un’alterazione dell’eccitabilità dei fusi neuromuscolari risultante da una iperattività dei motoneuroni . La perdita della normale inibizione fu anche trovata in altri esperimenti; nei distonici, infatti, è presente una rapida curva del ciclo di recupero del blink reflex e dell’onda H.[32]
Trattamento farmacologico
La paziente rispose positivamente alla somministrazione di “SIRDALUD“ a dosi di 4 mg tre volte al dì più che alla somministrazione di diazepam. La tizanidina ( Sirdalud) è infatti una molecola che agisce centralmente come agente miotonolitico ed è farmacologicamente e chimicamente diverso dal diazepam e baclofen. Questo è un potente inibitore della e rigidità indotta sperimentalmente sul topo e dell’attività polisinaptica nel gatto. Nel gatto decorticato o decerebrato la tizanidina inibisce preferenzialmente la componente tonica dell’attività riflessa. Le azioni della tizanidina derivano dalla propria attività agonista sui recettori noradrenergici delle sub-unità e possono coinvolgere anche l’inibizione del rilascio degli aminoacidi eccitatori dagli interneuroni spinali (EAA).[33] L’azione sul tono muscolare, il minore effetto sedativo rispetto al diazepam ed al baclofen e la minore debolezza muscolare che ne deriva, sono le caratteristiche che hanno indotto la scelta di questo farmaco rispetto agli altri (EAA)
Conclusioni Cliniche
Per giungere ad una conclusione clinica chiara e significativa dobbiamo porci la seguente domanda:
Sono i Disordini Temporomandibolari a causare una alterazione funzionale del sistema Nervoso Centrale trigeminale oppure questa manifestazione clinica potrebbe rappresentare variante di una polineurite cranica acuta benigna, oppure uno stato clinico più complesso?
Una adeguata risposta a questo quesito è stata data da uno studio di Adour KK [34]attraverso uno studio prospettico utilizzando l'esame neuro-otologico e l'elettromiografia. Sette pazienti consecutivi con sintomi cardinali della sindrome da disfunzione dolorosa dell'articolazione temporo-mandibolare (dolore, dolorabilità, clic e limitazione del movimento della mandibola) sono stati esaminati entro una settimana dall'insorgenza dei loro sintomi acuti. Altri tre con sintomi cronici sono stati testati per il confronto con i casi acuti. Tutti e sette i pazienti con la condizione acuta presentavano ipoestesia asintomatica di tutte e tre le divisioni del nervo trigemino e una riduzione del potenziale d'azione dei muscoli volitivi nei muscoli masseteri e temporali. Alla fine di tre settimane l'ipestesia si è risolta in tutti e sette i pazienti e il potenziale d'azione muscolare è tornato alla normalità in sei dei sette. I test elettromiografici del singolo paziente con potenziali d'azione muscolari ridotti persistenti e tre pazienti con sintomi cronici hanno mostrato fibrillazione, ridotti potenziali di rigenerazione polifasica e fascicolazioni spontanee con atrofia clinica e spasmo dei muscoli masseteri e temporali interessati. Altri risultati acuti del nervo cranico includevano ipoestesia unilaterale del glossofaringeo e del secondo nervo cervicale, paralisi motoria del ramo laringeo superiore del nervo vago e aumento della latenza del nervo facciale. Questi risultati suggeriscono una causa organica neuromuscolare, piuttosto che psicofisiologica, della sindrome da disfunzione dolorosa dell'articolazione temporo-mandibolare.
Contrariamente a questa asserzione che vede un disturbo organico neuromotorio alla base di una situazione clinica di TMDs c'è la opinione che l'influenza del crossbite posteriore unilaterale sulle variazioni dell'attività muscolare spontanea nella posizione di riposo mandibolare e nella massima contrazione volontaria sia significativa e confermata da Woźniak K et al.[35]
Avendo già chiarito anche se in modo non approfondito la difficoltà terminologica, clinica e scientifica nella comprensione di fenomeni che rappresentano una alterazione del Sistema Nervoso Centrale trigeminale nell'attività EMG a riposo possiamo solo suggerire più attenzione nel progettare esperimenti di questo tipo. Per esempio Woźniak K et al.[35] giunge a tali conclusioni analizzando la asimmetria tra lati dell'attività EMG a riposo ed a massima volonta di contrazione (MVC) e l'algoritmo impiegato è il seguente:
ma non si è tenuto conto se queste asimmetrie, principalmente evidenti al numeratore siano realmente correlate ad una simmetria organica delle radici motorie trigeminali. Queste conclusioni perciò, sarebbero potute divenire esponenzialmente significative se correlate ai dati in uscita dall'esecuzione dei Potenziali Evocati motori trigeminali bilaterali bRoot-MEPs messi appunto dal nostro gruppo.
Questo avrebbe avuto un esponenziale significato clinico perchè avrebbe confermato una correlazione tra la asimmetria funzionale ( e non organica) tra il crossbite e le attività elettriche neuromotorie.
- ↑ Grzegorz Zieliński, Aleksandra Byś, Jacek Szkutnik, Piotr Majcher, Michał Ginszt. Electromyographic Patterns of Masticatory Muscles in Relation to Active Myofascial Trigger Points of the Upper Trapezius and Temporomandibular Disorders. Diagnostics (Basel) 2021 Apr; 11(4): 580. Published online 2021 Mar 24. doi: 10.3390/diagnostics11040580 PMCID: PMC8063936
- ↑ Fernández-de-Las-Peñas C., Galán-Del-Río F., Alonso-Blanco C., Jiménez-García R., Arendt-Nielsen L., Svensson P. Referred Pain from Muscle Trigger Points in the Masticatory and Neck-Shoulder Musculature in Women with Temporomandibular Disoders. J. Pain. 2010;11:1295–1304. doi: 10.1016/j. jpain.2010.03.005.
- ↑ Peck C., Murray G., Gerzina T. How Does Pain Affect Jaw Muscle Activity? The Integrated Pain Adaptation Model. Aust. Dent. J. 2008;53:201–207. doi: 10.1111/j.1834-7819.2008.00050.x.
- ↑ Pietropaoli D., Ortu E., Giannoni M., Cattaneo R., Mummolo A., Monaco A. Alterations in Surface Electromyography Are Associated with Subjective Masticatory Muscle Pain. Pain Res. Manag. 2019;2019:6256179. doi: 10.1155/2019/6256179.
- ↑ Manfredini D., Cocilovo F., Favero L., Ferronato G., Tonello S., Guarda-Nardini L. Surface Electromyography of Jaw Muscles and Kinesiographic Recordings: Diagnostic Accuracy for Myofascial Pain. J. Oral Rehabil. 2011;38:791–799. doi: 10.1111/j.1365-2842.2011.02218.x.
- ↑ Simons D.G., Travell J.G., Simons L.S. Travell & Simons’ Myofascial Pain and Dysfunction: The Trigger Point Manual. 2nd ed. Williams & Wilkins; Baltimore, MD, USA: 1999.
- ↑ Grzegorz Zieliński, Aleksandra Byś, Michał Ginszt, Michał Baszczowski, Jacek Szkutnik, Piotr Majcher, Piotr Gawda. Depression and Resting Masticatory Muscle Activity. J Clin Med. 2020 Apr; 9(4): 1097. Published online 2020 Apr 12. doi: 10.3390/jcm9041097
- ↑ Stocka A., Sierpinska T., Kuc J., Golebiewska M. Relationship between depression and masticatory muscles function in a group of adolescents. Cranio. 2018;36:390–395. doi: 10.1080/08869634.2017.1364030.
- ↑ Partanen JV, Nousiainen U. : End-plate spikes in the electromyography are fusimotor unit potentials. Neurology 1983; 33:039-1043,
- ↑ Axelsson J, Thesleff S.: A study of super-sensitivity of denervated mammalian skeletal muscles. J Physiol (Lond) 1957:149;178-193
- ↑ Miledi R.: The acetylcholine sensitivity of frog musclefibres after complete or partial denervation. J Physiol (Lond) 1960:151;1-23
- ↑ Thesleff S: Fibrillation in denervated mammalian skeletal muscle. In Cukp WL e Ochoa J (eds): Abnormal Nerves and Muscle as Impulse Genertors. Oxford University Press. Oxford 1982, pp 678-694
- ↑ Danny-Brown D, Pennybacker JB.: Fibrillation and fasciculation in voluntary muscle. Brain 1938; 61: 311-332
- ↑ Sindermann F,Conrad B, Jacobi HM, Prochazka VJ.: Unusual properties of repetitive fasciculation Elctroencephalogr Clin Neurophysiol 1973; 35: 173-179
- ↑ Buchtal F: An introduction to electromyography Scandinavian University Books. Copenhagen 1957
- ↑ Angel A. : Central neuronal pathways and the process of anaesthesia. British Journal of Anaesthesia 1993; 71:148-163
- ↑ Iversen SD.: Behavioural evaluation of cholinergic drug. Life Sciences 1997; 60: 1145-1152
- ↑ Kikuchi T, Wang Y, Sato K, Okumura F.: In vivo effects of propofol on aceylcholine release from the fronatl cortex, hippocampus and striatum studied by intracerebral microdialysis in freely moving rats
- ↑ Ongerboer de Visser BW, Kuypers HG (1978): Late blink reflex changes in lateral medullary lesions. An electrophysiological and neuro-anatomical study of Wallenberg's syndrome. Brain 101: 285-294.
- ↑ Ongerboer de Visser BW (1983b): Comparative study of corneal and blink reflex latencies in patients with segmental or with cerebral lesions. In: Desmedt JE , editor. Advances in neurology. New York: Raven Press. p 757-772.
- ↑ Ongerboer de Visser BW (1983b): Comparative study of corneal and blink reflex latencies in patients with segmental or with cerebral lesions. In: Desmedt JE , editor. Advances in neurology. New York: Raven Press. p 757-772.
- ↑ Dimitrova A, Weber J, Maschke M, Elles HG, Kolb FP, Forsting M, Diener HC, Timmann D. Eyeblink-related areas in human cerebellum as shown by fMRI. Hum Brain Mapp. 2002 Oct;17(2):100-15.
- ↑ Kararmaz A. Kaya S, TurhanogluS, Ozyilmaz A.: Effects of high-dose propofol on succinylcholine-induced fasciculations and myalgia. Acta Anaesthesiol Scand 2003; 47:180-184
- ↑ Watt MW, Tan EK, Jankovic J.: Bruxism and Cranial cervical dystonia: Is there a relationship? Behavioural Sciences. 1999; 17: 196-2011)
- ↑ Lobbezzo F, Soucy JP, Montplaisir JY, Lavigne GJ.: Striatal D2 receptor binding in sleep bruxism: a controlled study with iodine 123 –iodobenzamide and single photon emission computer tomography. J Dent. Res. 1996 : 75 ; 1804-1810
- ↑ Chuldler EH, Dong WK.: The role of basal ganglia in nociception and pain Pain 1995; 60: 3-38
- ↑ Jones AK, Brown WD, Friston KJ, Qi LY,Frackowiak RS.: Cortical and subcortical localization of response to pain in man using positron emission tomography. Proc R Soc Lond B Biol Sci 1991; 244: 39-44
- ↑ Iadarola MJ, Berman KF, Byas-Smith M, Gracely RH, Max M, Seffiro T. et all.: Positron emission tomography (PET) studies of pain and allodynia in normal and patients with chronic neuropathic pain. Soc Neurosci Abstr 1993; 19: 1074
- ↑ Bullitt E.: Introduction of c-Foslike protein whitin the lumbar spinal cord and thalamus of the rat following peripheral stimulation. Brain Res 1989; 493: 391-7
- ↑ Tempel LW, Perlmutter JS.: Abnormal cortical responses in patients with writer’s cramp Neurology 1993; 43: 2252-7
- ↑ Kaji R, Rothwell JC, Katayama M, Ikeda T, Kubori T, Kohara N, Mezaki T, Shibasaki H, Kimura J.: Tonic vibration reflex and muscle afferent block in writer's cramp. Ann Neurol. 1995 Aug;38(2):155-62
- ↑ Tolosa E, Montserrat L, Bayes A.: Blink reflex studies in focal dystonias: enhanced excitability of brainstem interneurons in cranial dystonia and spasmodic torticollis. Mov Disord. 1988;3(1):61-9
- ↑ Coward DM: The drug treatment of spasticity. Sandoz 1997
- ↑ Adour KK. Acute temporomandibular joint pain-dysfunction syndrome: neuro-otologic and electromyographic study. Am J Otolaryngol. 1981 May;2(2):114-22. doi: 10.1016/s0196-0709(81)80028-2.PMID: 7270801
- ↑ 35.0 35.1 Woźniak K, Szyszka-Sommerfeld L, Lichota D. The electrical activity of the temporal and masseter muscles in patients with TMD and unilateral posterior crossbite. Biomed Res Int. 2015;2015:259372. doi: 10.1155/2015/259372. Epub 2015 Mar 26.PMID: 25883948