Difference between revisions of "Dinámica fisiológica en enfermedades desmielinizantes: desentrañar relaciones complejas a través del modelado por computadora"
Tags: Mobile web edit Mobile edit Visual edit |
Tags: Mobile web edit Mobile edit Visual edit |
||
| Line 88: | Line 88: | ||
La discusión anterior plantea el punto importante de que, aunque se ha hablado mucho sobre los mecanismos inmunitarios, su conexión con los cambios clínicos es en gran parte correlacional. Se deben considerar los efectos intermedios sobre la función axonal, es decir, los cambios primarios y secundarios (compensatorios) en la excitabilidad del axón, para apreciar cómo se altera la función neurológica. Esos cambios no son consecuencias simples y directas de la desmielinización sino que, en cambio, sugieren que la fisiología axonal misma cambia en respuesta a la desmielinización. Algunos de esos cambios son adaptativos mientras que otros son desadaptativos, o quizás los cambios adaptativos pueden volverse desadaptativos a medida que evoluciona la situación (estado de mielinización). Si los cambios en la fisiología axonal dictan la manifestación de varios síntomas, entonces el manejo de los síntomas recaerá en gran medida en los tratamientos que tienen como objetivo manipular la fisiología del axón. El desarrollo estratégico de tales tratamientos requiere una comprensión profunda y mecánica de la excitabilidad axonal y su regulación. | La discusión anterior plantea el punto importante de que, aunque se ha hablado mucho sobre los mecanismos inmunitarios, su conexión con los cambios clínicos es en gran parte correlacional. Se deben considerar los efectos intermedios sobre la función axonal, es decir, los cambios primarios y secundarios (compensatorios) en la excitabilidad del axón, para apreciar cómo se altera la función neurológica. Esos cambios no son consecuencias simples y directas de la desmielinización sino que, en cambio, sugieren que la fisiología axonal misma cambia en respuesta a la desmielinización. Algunos de esos cambios son adaptativos mientras que otros son desadaptativos, o quizás los cambios adaptativos pueden volverse desadaptativos a medida que evoluciona la situación (estado de mielinización). Si los cambios en la fisiología axonal dictan la manifestación de varios síntomas, entonces el manejo de los síntomas recaerá en gran medida en los tratamientos que tienen como objetivo manipular la fisiología del axón. El desarrollo estratégico de tales tratamientos requiere una comprensión profunda y mecánica de la excitabilidad axonal y su regulación. | ||
=== | === Patobiología del axón === | ||
==== | ==== Cambios Estructurales y Moleculares ==== | ||
Los axones se ven profundamente afectados por la desmielinización. La morfología del axón se vuelve irregular o hinchada, a menudo con una apariencia de cuentas. También se observa acumulación focal de proteínas (por transporte axonal rápido). En las placas activas crónicas, la pérdida axonal del 20% al 80% es evidente dentro de la sustancia blanca periplaca y la sustancia blanca distante normal.<ref>Moll N.M., Rietsch A.M., Thomas S., Ransohoff A.J., Lee J.C., Fox R., Chang A., Ransohoff R.M., Fisher E. Multiple sclerosis normal-appearing white matter: Pathology-imagig correlations. Ann. Neurol. 2011;70:764–773. doi: 10.1002/ana.22521. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> En las placas activas tempranas y activas crónicas, se cree que el daño es causado por factores inflamatorios e inmunitarios liberados durante la desmielinización inflamatoria aguda. Los mediadores propuestos incluyen proteasas, citoquinas, excitotoxinas y radicales libres. Los antígenos neuronales son objetivos de la reacción inmunitaria que conduce a la inflamación del SNC. Otros factores que causan disfunción axonal o muerte incluyen la falta de apoyo trófico de la mielina y los oligodendrocitos, el daño de los factores inmunes solubles o celulares que aún están presentes en la placa inactiva y la falla mitocondrial crónica en el contexto de una mayor demanda de energía..<ref name=":7">Lucchinetti C., Brück W., Parisi J., Scheithauer B., Rodriguez M., Lassmann H. Heterogeneity of multiple sclerosis lesions: Implications for the pathogenesis of demyelination. Ann. Neurol. 2000;47:707–717. doi: 10.1002/1531-8249(200006)47:6<707::AID-ANA3>3.0.CO;2-Q. [PubMed] [CrossRef] [Google Scholar]</ref> También se ha atribuido un papel crítico para los oligodendrocitos y las células de Schwann en la supervivencia del axón a los peroxisomas, el metabolismo de los lípidos y la desintoxicación de especies reactivas de oxígeno (ROS)..<ref>Kassmann C.M., Nave K.A. Oligodendroglial impact on axonal function and survival— A hypothesis. Curr. Opin. Neurol. 2008;21:235–241. doi: 10.1097/WCO.0b013e328300c71f. [PubMed] [CrossRef] [Google Scholar]</ref> | |||
La remielinización a menudo se observa como placas de sombra formadas por el reclutamiento de precursores de oligodendrocitos indiferenciados que migran hacia las lesiones y las rodean, lo que permite capas delgadas de remielinización..<ref>Scolding N., Franklin R. Axon loss in multiple sclerosis. Lancet. 1998;352:340–341. doi: 10.1016/S0140-6736(05)60463-1. [PubMed] [CrossRef] [Google Scholar]</ref>Este proceso ocurre principalmente en placas activas agudas, pero también en fases crónicas. Esta observación desencadenó el desarrollo de un nuevo anticuerpo monoclonal dirigido contra LINGO-1 (Anti-LINGO-1). La unión de LINGO-1 a los receptores Nogo previene los procesos de remielinización en el SNC; la inhibición de esta interacción permite una remielinización significativa en animales con encefalomielitis autoinmune experimental.<ref>Mi S., Miller R.H., Lee X., Scott M.L., Shulag-Morskaya S., Shao Z., Chang J., Thill G., Levesque M., Zhang M., et al. LINGO-1 negatively regulates myelination by oligodendrocytes. Nat. Neurosci. 2005;8:745–751. doi: 10.1038/nn1460. [PubMed] [CrossRef] [Google Scholar]</ref> | |||
Durante el proceso de la enfermedad, los linfocitos y macrófagos autorreactivos pueden cruzar la barrera hematoencefálica y acumularse en el cerebro y la médula espinal..<ref>Bittner S., Ruck T., Schuhmann M.K., Herrmann A.M., Maati H.M., Bobak N., Göbel K., Langhauser F., Stegner D., Ehling P., et al. 2013 Endothelial TWIK-related potassium channel-1 (TREK1) regulates immune-cell trafficking into the CNS. Nat. Med. 2013;19:1161–1165. doi: 10.1038/nm.3303. [PubMed] </ref>Los linfocitos reguladores (Treg) no logran suprimir las células efectoras, en su mayoría células CD8+ citotóxicas.<ref>Viglietta V., Baecher-Allan C., Weiner H.L., Hafler D.A. Loss of functional suppression by CD4+CD25+ regulatory T cells in patients with multiple sclerosis. J. Exp. Med. 2004;199:971–999. doi: 10.1084/jem.20031579.[PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> La liberación de citocinas proinflamatorias recluta microglía ingenua, que se pone en contacto con una unidad de oligodendrocitos-mielina mediante interacciones con Fc y receptores del complemento. A continuación, se transmite una señal desencadenante de muerte citotóxica a través del factor de necrosis tumoral α (TNFα) unido a la superficie..<ref>Zajicek J.P., Wing M., Scolding N.J., Compston D.A. Interactions between oligodendrocytes and microglia. A major role for complement and tumour necrosis factor in oligodendrocyte adherence and killing. Brain. 1992;115:1611–1631. [PubMed] [Google Scholar]</ref>Esto ocurre junto con un extenso daño axonal..<ref name=":1" /> | |||
Lucchinetti el al.<ref name=":7" /> | Lucchinetti el al.<ref name=":7" /> propusieron cuatro inmunopatrones distintos de formación de placas que se encuentran en pacientes en diferentes etapas de la enfermedad. Las placas de tipo I y II están dominadas por inflamación de linfocitos T y macrófagos y se cree que imitan los modelos de encefalomielitis autoinmune de células T o de células T más anticuerpos, respectivamente. La pérdida de mielina en las placas de tipo I puede deberse a factores tóxicos liberados por los macrófagos activados, mientras que el depósito de IgG y complemento sugiere un papel de los anticuerpos en las placas de tipo II. Por el contrario, los patrones III y IV muestran distrofia de oligodendrocitos grandes. Se cree que el patrón III está relacionado con lesiones inducidas por hipoxia que son impulsadas por defectos en la función mitocondrial,<ref name=":8">Nikić I., Merkler D., Sorbara C., Brinkoetter M., Kreutzfeldt M., Bareyre F.M., Brück W., Bishop D., Misgeld T., Kerschensteiner M. A reversible form of axon damage in experimental autoimmune encephalomyelitis and multiple sclerosis. Nat. Med. 2011;17:495–499. doi: 10.1038/nm.2324. [PubMed] [CrossRef] [Google Scholar]</ref> mientras que las lesiones de patrón IV se asocian con una muerte profunda no apoptótica de los oligodendrocitos en la sustancia blanca periplaca. | ||
Barnett | Barnett y Prineas<ref>Barnett M.H., Prineas J.W. Relapsing and remitting multiple sclerosis: Pathology of the newly forming lesion. Ann. Neurol. 2004;55:458–468. doi: 10.1002/ana.20016. [PubMed] [CrossRef] [Google Scholar]</ref> analizó las lesiones de los pacientes directamente después del inicio de una recaída, durante la cual estaba en curso la formación activa de placa. Sus resultados sugieren que la apoptosis de los oligodendrocitos y la activación glial ocurren durante la formación activa temprana de la placa en ausencia de linfocitos inflamatorios o fagocitos de mielina. Propusieron que la vulnerabilidad de los oligodendrocitos, descrita en el patrón de tipo III de Lucchinetti, está presente en las primeras etapas de toda formación de placa y es el desencadenante de la necrosis postapoptótica posterior que inicia la fagocitosis de mielina por parte de los macrófagos en etapas posteriores. Los análisis in vitro de este proceso han implicado cascadas del complemento, factores de necrosis tumoral o segundos mensajeros gaseosos..<ref>Van der Laan L.J., Ruuls S.R., Weber K.S., Lodder I.J., Döpp E.A., Dijkstra C.D. Macrophage phagocytosis of myelin ''in vitro'' determined by flow cytometry: Phagocytosis is mediated by CR3 and induces production of tumor necrosis factor-α and nitric oxide. J. Neuroimmunol. 1996;70:145–152. doi: 10.1016/S0165-5728(96)00110-5. [PubMed] [CrossRef] [Google Scholar]</ref> Aunque la identificación de las placas y el seguimiento de su progreso tienen un valor clínico importante, solo hay una correlación modesta entre la carga de lesiones desmielinizantes determinada por resonancia magnética convencional y la discapacidad clínica de los pacientes con EM (véase antes). | ||
==== | ==== Cambios Funcionales ==== | ||
Los mecanismos de deterioro funcional durante la desmielinización a menudo incluyen la interrupción de los iones transmembrana Na+, K+ y Ca2+, la dispersión de sus canales iónicos correspondientes, una disminución en la eficiencia de la conducción de AP y la crisis metabólica resultante (Figura 3). La desmielinización puede explicar fácilmente la falla de conducción dentro del axón afectado. Si la conducción no falla por completo, la velocidad de conducción puede, sin embargo, reducirse y la ralentización diferencial entre diferentes axones puede causar retrasos variables en la conducción que dan como resultado picos desincronizados. | |||
La desmielinización también permite que los axones denudados se yupen estrechamente, preparando así el escenario para las interacciones efápticas y la diafonía..<ref name=":1" /> La reflexión también puede ocurrir debido a un desajuste de impedancia entre las longitudes de axón mielinizado y no mielinizado. Por otra parte, la hiperexcitabilidad no puede atribuirse directamente a la desmielinización; en cambio, se deben invocar cambios secundarios en la excitabilidad intrínseca para explicar fenómenos como la generación de picos ectópicos y la posdescarga (AD). Las alteraciones en la excitabilidad probablemente representen cambios compensatorios destinados a restaurar la función después de la interrupción causada directamente por la desmielinización, de acuerdo con un proceso denominado plasticidad homeostática.,<ref>Wang G., Thompson S.M. Maladaptive homeostatic plasticity in a rodent model of central pain syndrome: Thalamic hyperexcitability after spinothalamic tract lesions. J. Neurosci. 2008;28:11959–11969. doi: 10.1523/JNEUROSCI.3296-08.2008. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref>pero esa compensación evidentemente puede ser desadaptativa. Cada uno de los desenlaces antes mencionados, que no son excluyentes entre sí, contribuyen a producir diferentes síntomas observados en las enfermedades desmielinizantes. | |||
Los síntomas paroxísticos caracterizados por el inicio repentino o la intensificación de síntomas como espasmos o dolor punzante probablemente surgen de la EA o de otro tipo de picos inapropiados de tipo ráfaga. Tales patrones de picos sugieren interacciones altamente no lineales entre las corrientes de iones contribuyentes.<ref name=":9">Coggan J.S., Prescott S.A., Bartol T.M., Sejnowski T.J. Imbalance of ionic conductances contributes to diverse symptoms of demyelination. Proc. Natl. Acad. Sci. USA. 2010;107:20602–20609. doi: 10.1073/pnas.1013798107.[PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref name=":10">Coggan J.S., Ocker G.K., Sejnowski T.J., Prescott S.A. Explaining pathological changes in axonal excitability through dynamical analysis of conductance-based models. J. Neural Eng. 2011;8 doi: 10.1088/1741-2560/8/6/065002. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> y podría, al menos en teoría, involucrar interacciones entre diferentes regiones de la neurona.<ref name=":11">Coggan J.S., Prescott S.A., Sejnowski T.J. Cooperativity between remote sites of ectopic spiking allows afterdischarge to be initiated and maintained at different locations. J. Comput. Neurosci. 2015;39:17–28. doi: 10.1007/s10827-015-0562-8. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> A diferencia de las formas más genéricas de hiperexcitabilidad (p. ej., aumento de la tasa de activación o reducción del umbral), estos patrones específicos están limitados en cuanto a los mecanismos precisos a través de los cuales pueden surgir. Por lo tanto, identificar los cambios en los canales iónicos que subyacen a esas formas específicas de hiperexcitabilidad puede ayudar a restringir la búsqueda de cambios en los canales iónicos responsables de formas asociadas, aunque menos distintivas, de hiperexcitabilidad. | |||
La interrupción del equilibrio energético en una neurona también podría tener un impacto profundo en el bienestar de las neuronas (Figura 3). De hecho, los cambios compensatorios pueden lograr restaurar ciertas funciones pero, sin revertir el problema principal, pueden surgir otros problemas. Por ejemplo, incluso si el bloqueo de conducción se evita mediante un cambio compensatorio apropiado en la excitabilidad (es decir, uno que no resulte en hiperexcitabilidad), el sistema puede ser menos eficiente energéticamente. La pérdida de los ahorros de energía que ofrece la conducción saltatoria induce la producción de energía mitocondrial compensatoria que puede provocar daño oxidativo y neurodegeneración.<ref name=":8" /><ref name=":12">Aon M.A., Cortassa S., Akar F.G., Brown D.A., Zhou L., O’Rourke B. From mitochondrial dynamics to arrhythmias. Int. J. Biochem. Cell Biol. 2009;41:1940–1948. doi: 10.1016/j.biocel.2009.02.016. [PMC free article][PubMed] [CrossRef] [Google Scholar]</ref><ref name=":13">Su K., Bourdette D., Forte M. Mitochondrial dysfunction and neurodegeneration in multiple sclerosis. Front. Physiol. 2013;4doi: 10.3389/fphys.2013.00169. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> | |||
Hacer un seguimiento de esta larga lista de cambios neurobiológicos, comprender las interrelaciones entre esos cambios y, en última instancia, vincular esos cambios con las manifestaciones clínicas y aplicar un tratamiento eficaz no es una tarea fácil. Para este fin, el modelado computacional es una herramienta invaluable. Las simulaciones no solo sirven para organizar la información que ya se conoce, sino que también identifican lagunas cruciales en el conocimiento. Por lo tanto, el uso juicioso del modelado computacional puede permitir una comprensión más integral y facilitar la aplicación más efectiva de esa comprensión, como se analiza a continuación. | |||
=== Computational Modeling === | === Computational Modeling === | ||
Revision as of 13:41, 5 May 2023
| Title | Dinámica fisiológica en enfermedades desmielinizantes: desentrañar relaciones complejas a través del modelado por computadora |
| Authors | Jay S. Coggan · Stefan Bittner · Klaus M. Stiefel · Sven G. Meuth · Steven A. Prescott |
| Source | Document |
| Date | 2021 |
| Journal | Int J Mol Sci. |
| DOI | 10.3390/ijms160921215 |
| PUBMED | https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4613250/#!po=53.5714 |
| PDF copy | |
| License | CC BY |
| This resource has been identified as a Free Scientific Resource, this is why Masticationpedia presents it here as a mean of gratitude toward the Authors, with appreciation for their choice of releasing it open to anyone's access | |
This is free scientific content. It has been released with a free license, this is why we can present it here now, for your convenience. Free knowledge, free access to scientific knowledge is a right of yours; it helps Science to grow, it helps you to have access to Science
This content was relased with a 'CC BY' license.
You might perhaps wish to thank the Author/s
Dinámica fisiológica en enfermedades desmielinizantes: desentrañar relaciones complejas a través del modelado por computadora
Free resource by Jay S. Coggan · Stefan Bittner · Klaus M. Stiefel · Sven G. Meuth · Steven A. Prescott
|
Physiological Dynamics in Demyelinating Diseases: Unraveling Complex Relationships through Computer Modeling
Jay S. Coggan, Stefan Bittner, [...], and Steven A. Prescott
Additional article information
Abstracta
A pesar de la intensa investigación, hay pocos tratamientos disponibles para la mayoría de los trastornos neurológicos. Las enfermedades desmielinizantes no son una excepción. Quizás esto no sea sorprendente considerando la naturaleza multifactorial de estas enfermedades, que implican interacciones complejas entre las células del sistema inmunitario, la glía y las neuronas. En el caso de la esclerosis múltiple, por ejemplo, no hay unanimidad entre los investigadores sobre la causa o incluso qué sistema o tipo de célula podría ser la zona cero. Esta situación impide el desarrollo y la aplicación estratégica de terapias basadas en mecanismos. Discutiremos cómo el modelado computacional aplicado a preguntas en diferentes niveles biológicos puede ayudar a vincular observaciones dispares y descifrar mecanismos complejos cuyas soluciones no son susceptibles de reduccionismo simple. Al hacer predicciones comprobables y revelar brechas críticas en el conocimiento existente, estos modelos pueden ayudar a dirigir la investigación y proporcionarán un marco riguroso en el que integrar nuevos datos a medida que se recopilan. Hoy en día, no hay escasez de datos; el desafío es darle sentido a todo. En ese sentido, el modelado computacional es una herramienta invaluable que podría, en última instancia, transformar la forma en que entendemos, diagnosticamos y tratamos las enfermedades desmielinizantes.
Palabras clave: mielina, desmielinización, esclerosis múltiple, enfermedad neurodegenerativa, modelo computacional, descubrimiento de fármacos
Introducción
Los sistemas nerviosos de los vertebrados a menudo se dividen en materia gris y blanca según su apariencia y funciones funcionales correspondientes. Mientras que la materia gris se compone principalmente de cuerpos celulares y dendritas, la materia blanca contiene principalmente axones y recibe su nombre de las láminas de membrana lipídica llamadas mielina que se enrollan estrechamente alrededor de esos axones..[1] La mielina se origina a partir de diferentes clases de células gliales denominadas oligodendrocitos en el sistema nervioso central (SNC) y células de Schwann en el sistema nervioso periférico (SNP).
El aislamiento eléctrico proporcionado por las láminas de mielina mejora la función axonal al aumentar tanto la eficiencia energética como la velocidad de conducción de los potenciales de acción (AP). Estas dos funciones pueden haber cambiado su importancia relativa durante la evolución..[2] La mielina apareció por primera vez en el Ordovícico (485 a 443 ma, o millones de años antes del presente) después de la separación de los ancestros de la lamprea y el mixino del resto de los linajes de vertebrados..[3] Con algunas excepciones interesantes,[4][5] La mielina o estructuras análogas se encuentran en todos los vertebrados y es fundamental para el correcto funcionamiento de sus sistemas nerviosos. El tiempo aproximado de la evolución de la mielina se puede deducir del tiempo conocido de divergencia entre cordados sin (agnatha) y con (todos los demás vertebrados) mielina.
La envoltura de mielina se ve interrumpida por tramos no mielinizados, espaciados regularmente, conocidos como nódulos de Ranvier. La mielina acelera la conducción al restringir el flujo de carga transmembrana a través de los canales iónicos ubicados dentro de los nódulos. Dentro de los llamados entrenudos, la corriente fluye por el axón y muy poca pasa a través de la membrana celular aislada. El AP se regenera en cada nodo donde la densidad de los canales de sodio y potasio dependientes de voltaje es muy alta. Este proceso se denomina “conducción saltatoria” ya que el PA parece saltar de nodo en nodo. Las interrupciones en este sistema de comunicaciones de fuego rápido pueden estar asociadas con una serie de disfunciones del sistema nervioso..[6]
En varios aspectos, los axones parecen operar en límites físicos. Un ejemplo interesante es que el tamaño de los axones parece estar limitado por el ruido térmico intrínseco a las proteínas del canal iónico; cualquier axón de menos de 0,1 μm sería inútil para la transferencia de información debido a sus altos niveles de ruido.[7]Curiosamente, 0,1 μm es también aproximadamente el diámetro de axón más pequeño observado en los sistemas nerviosos [7]. Este y otros hallazgos similares sugieren que los axones y sus subestructuras son dispositivos biológicos finamente sintonizados, pero que la sintonía evidentemente puede verse interrumpida en condiciones patológicas..[8]
La desmielinización pone en marcha cambios funcionales que son importantes para las características clínicas pero que no se explican fácilmente por cambios inmunológicos o radiológicos. La ubicación de una placa predice qué sistema se verá afectado (motor frente a sensorial, visual frente a táctil), pero no cómo se verá afectado. Esto destaca la importancia de evaluar la función (además de la estructura) y cómo cambia después de la desmielinización. Después de presentar las enfermedades desmielinizantes, discutiremos cómo las manifestaciones clínicas de esas enfermedades reflejan diversos cambios patológicos en la función del axón. Argumentaremos que la comprensión de esos cambios y la capitalización total de esa comprensión con fines diagnósticos y terapéuticos pueden beneficiarse enormemente del modelado computacional.
Enfermedades desmielinizantes
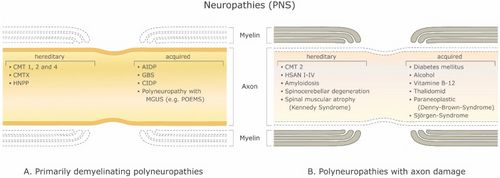
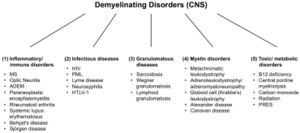
Hay un gran número de enfermedades desmielinizantes que afectan tanto al SNP (Figura 1) como al SNC (Figura 2). Las etiologías son heterogéneas y van desde trastornos genéticos hasta mecanismos metabólicos, infecciosos o autoinmunitarios. La esclerosis múltiple (EM) es el más prevalente de estos trastornos, con un estimado de 3 millones de pacientes en todo el mundo. Su causa subyacente es incierta, pero se cree que implica una predisposición genética a los agentes ambientales.[9][10]y puede involucrar componentes inmunológicos, de respuesta al trauma, biofísicos, genéticos y/o metabólicos.[10]Los síntomas y lesiones deben ser múltiples tanto en el tiempo como en el espacio. Es decir, debe haber múltiples episodios en el tiempo, involucrando partes desconectadas del sistema nervioso central. No está claro si la desmielinización inflamatoria es un evento primario o secundario dentro del proceso de la enfermedad..[9][11][12] La mayoría de los tratamientos tienen como objetivo el sistema inmunitario o la barrera hematoencefálica, pero el control de los síntomas neurológicos a través de la modulación de la excitabilidad axonal también juega un papel importante (ver más abajo).
Evaluación clínica de la esclerosis múltiple
Los síntomas son diversos y pueden ocurrir en todas las combinaciones dentro de un paciente individual. El diagnóstico requiere que haya múltiples lesiones y episodios sintomáticos a lo largo del tiempo, involucrando partes desconectadas del SNC. Además, los síntomas tienden a estar mal correlacionados con las medidas radiológicas. En la gran mayoría de los casos, las características clínicas individuales no se correlacionan bien con los hallazgos de la resonancia magnética, especialmente para las lesiones cerebrales..[13][14][15] Esta disociación clínico-radiológica exige una mejor comprensión teórica de los síntomas de desmielinización y los cambios biofísicos subyacentes que los acompañan, lo que por supuesto plantea la pregunta de qué sucede exactamente con los axones afectados.
Los síntomas a menudo son intermitentes y pueden incluir pérdida de función (síntomas negativos como entumecimiento, debilidad muscular, hormigueo, ceguera, incontinencia, pérdida de la función sexual, pérdida del equilibrio, dificultad para hablar, estreñimiento, fatiga incapacitante, depresión, disfunción cognitiva , incapacidad para tragar, alteración de la marcha y pérdida del control de la respiración) y ganancia de función (síntomas positivos como espasmos, espasticidad, calambres, dolor, visión borrosa o doble, urgencia o vacilación urinaria, náuseas, entre otros).[16] Los primeros criterios de diagnóstico diferencial incluyen el signo de Lhermitte (sensaciones relacionadas con la flexión del cuello) y el fenómeno de Uhthoff (empeoramiento de los síntomas dependiente de la temperatura). El diagnóstico diferencial de la EM sigue de cerca los criterios de McDonald.[17]
En los estudios de diagnóstico en humanos de potenciales evocados visuales, sensoriales o motores (VEP, SEP, MEP), solo se puede medir con precisión la latencia o la velocidad de conducción (con variaciones de aproximadamente 30% a 40% entre diferentes laboratorios). Pero estas medidas dan poca pista sobre los mecanismos subyacentes que involucran el enlentecimiento o el bloqueo de la conducción, o factores morfológicos o funcionales tales como ramificación, desmielinización, remielinización, afinamiento axonal (disminución del área transversal), atenuación o rebrote, cambios en la conducción relacionados con la temperatura. , o malpolarización (hiper o hipo). No obstante, el tipo de lesión desmielinizante puede dar pistas sobre la etiología y, por tanto, orientar el tratamiento; por ejemplo, los factores genéticos parecen estar más fuertemente correlacionados con los procesos de enfermedad internodal y las disfunciones inmunológicas causan anomalías paranodales..[18]
Una serie de pruebas se utilizan de forma rutinaria para evaluar la función neural. En la electroneurografía, se aplica un breve estímulo eléctrico a un nervio periférico en una posición predefinida anatómicamente para medir la latencia y la amplitud del potencial de acción compuesto en otra ubicación a lo largo del nervio. Los resultados deben interpretarse en combinación con los hallazgos y las pruebas clínicas (p. ej., electromiografía) pero, lo que es más importante, las diferentes enfermedades exhiben diferentes patrones de cambios electroneurográficos. Esto es importante no solo para fines de diagnóstico, sino que también puede indicar cambios patológicos específicos en la función del axón que, a su vez, podrían ayudar a guiar la elección de la terapia (si se entendiera la patobiología del axón; ver más abajo). Mediante el seguimiento del umbral, se midió la excitabilidad en humanos para varias enfermedades desmielinizantes periféricas, incluida la enfermedad de Charcot-Marie-Tooth tipo 1A (CMT1A), la polineuropatía desmielinizante inflamatoria crónica (CIDP), el síndrome de Guillain-Barré (GBS) y la neuropatía motora multifocal (MMN).[19][20][21][22][23][24][25] El desafío radica en interpretar esas observaciones. Para ello, el grupo de Stephanova ha simulado progresivamente mayores grados de desmielinización sistemática y focal de las fibras motoras para intentar explicar los cambios fisiológicos observados[26][27][28][29][30][31] (ver la sección Modelado a continuación).
Participación de los cuerpos celulares
La progresión de la EM remitente-recurrente (EMRR) a la EM progresiva secundaria (SPMS) se asocia con una mayor afectación de la patología de la materia gris, aunque la afectación axonal/de la materia gris ya se puede observar en las primeras etapas de la enfermedad.[32][33][34][35] El daño a la sustancia gris se considera el mecanismo subyacente de la progresión de la enfermedad y la discapacidad permanente en los pacientes con EM, y se mide por la pérdida de la fracción parenquimatosa cerebral o el volumen cerebral por resonancia magnética o clínicamente por la progresión en la escala expandida del estado de discapacidad (EDSS).[36] La transición de RRMS a SPMS es un presagio por la falta de terapias para combatir el deterioro físico y cognitivo exacerbado que enfrentan la mayoría de los pacientes con SPMS.[9][37]
Tratamiento
Las principales intervenciones para la EM implican la modulación de la respuesta inmunitaria con, por ejemplo, metilprednisolona, interferón beta, acetato de glatiramer o fingolimod, o evitando que las células inflamatorias crucen la BHE (anticuerpos monoclonales, p. ej., Tysabri (anti α4-integrina, Natalizumab )). Muy recientemente, los dos primeros agentes orales (fumarato y teriflunomida), así como el anticuerpo dirigido anti-CD52 Natalizumab, fueron aprobados para el tratamiento de la EMRR, que puede tratarse con éxito con terapias de primera línea como interferones, acetato de glatiramer o fingolimod, o con terapias de segunda línea, pero las formas progresivas (PPMS, SPMS) aún representan una necesidad biomédica no cubierta.[38] Los antineoplásicos se utilizan en casos extremadamente avanzados o difíciles.[39]
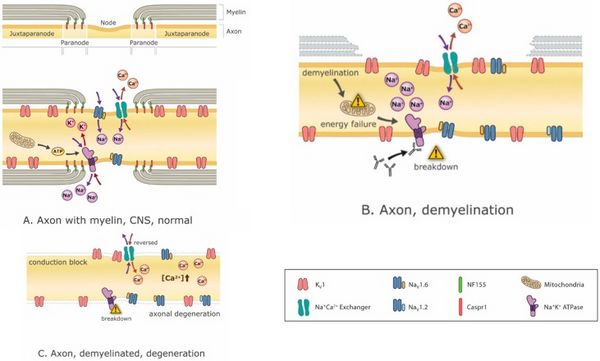
Los medicamentos modificadores de la enfermedad son fundamentales para detener o al menos atenuar el proceso de desmielinización, pero también lo es controlar los síntomas que surgen de cualquier desmielinización que ya haya ocurrido. La modulación de canales iónicos es cada vez más prometedora con la llegada de nuevos bloqueadores de canales iónicos como Ampyra (bloqueo de canales K).[40][41] El bloqueo de los canales de potasio está destinado a mejorar la excitabilidad de los axones. El problema es que tales intervenciones, si bien son efectivas para tratar los síntomas negativos y restaurar la función, tienden a exacerbar los síntomas positivos.[42]Por el contrario, el tratamiento de los síntomas positivos, como los espasmos, con antiepilépticos como la carbamazepina, por ejemplo, puede exacerbar los síntomas negativos..[43] De hecho, el bloqueo de los canales de Na+ no solo reduce los síntomas positivos, sino que también puede ser neuroprotector (porque la acumulación de Na+ hace que los mecanismos de intercambio de Na+/Ca2+ carguen las neuronas con Ca2+, que es excitotóxico)[44] (Figura 3), pero estos beneficios se obtienen a expensas de los síntomas negativos. Por lo tanto, y especialmente en un paciente que presenta una mezcla de síntomas positivos y negativos, las opciones de tratamiento son restringidas.
La discusión anterior plantea el punto importante de que, aunque se ha hablado mucho sobre los mecanismos inmunitarios, su conexión con los cambios clínicos es en gran parte correlacional. Se deben considerar los efectos intermedios sobre la función axonal, es decir, los cambios primarios y secundarios (compensatorios) en la excitabilidad del axón, para apreciar cómo se altera la función neurológica. Esos cambios no son consecuencias simples y directas de la desmielinización sino que, en cambio, sugieren que la fisiología axonal misma cambia en respuesta a la desmielinización. Algunos de esos cambios son adaptativos mientras que otros son desadaptativos, o quizás los cambios adaptativos pueden volverse desadaptativos a medida que evoluciona la situación (estado de mielinización). Si los cambios en la fisiología axonal dictan la manifestación de varios síntomas, entonces el manejo de los síntomas recaerá en gran medida en los tratamientos que tienen como objetivo manipular la fisiología del axón. El desarrollo estratégico de tales tratamientos requiere una comprensión profunda y mecánica de la excitabilidad axonal y su regulación.
Patobiología del axón
Cambios Estructurales y Moleculares
Los axones se ven profundamente afectados por la desmielinización. La morfología del axón se vuelve irregular o hinchada, a menudo con una apariencia de cuentas. También se observa acumulación focal de proteínas (por transporte axonal rápido). En las placas activas crónicas, la pérdida axonal del 20% al 80% es evidente dentro de la sustancia blanca periplaca y la sustancia blanca distante normal.[45] En las placas activas tempranas y activas crónicas, se cree que el daño es causado por factores inflamatorios e inmunitarios liberados durante la desmielinización inflamatoria aguda. Los mediadores propuestos incluyen proteasas, citoquinas, excitotoxinas y radicales libres. Los antígenos neuronales son objetivos de la reacción inmunitaria que conduce a la inflamación del SNC. Otros factores que causan disfunción axonal o muerte incluyen la falta de apoyo trófico de la mielina y los oligodendrocitos, el daño de los factores inmunes solubles o celulares que aún están presentes en la placa inactiva y la falla mitocondrial crónica en el contexto de una mayor demanda de energía..[46] También se ha atribuido un papel crítico para los oligodendrocitos y las células de Schwann en la supervivencia del axón a los peroxisomas, el metabolismo de los lípidos y la desintoxicación de especies reactivas de oxígeno (ROS)..[47]
La remielinización a menudo se observa como placas de sombra formadas por el reclutamiento de precursores de oligodendrocitos indiferenciados que migran hacia las lesiones y las rodean, lo que permite capas delgadas de remielinización..[48]Este proceso ocurre principalmente en placas activas agudas, pero también en fases crónicas. Esta observación desencadenó el desarrollo de un nuevo anticuerpo monoclonal dirigido contra LINGO-1 (Anti-LINGO-1). La unión de LINGO-1 a los receptores Nogo previene los procesos de remielinización en el SNC; la inhibición de esta interacción permite una remielinización significativa en animales con encefalomielitis autoinmune experimental.[49]
Durante el proceso de la enfermedad, los linfocitos y macrófagos autorreactivos pueden cruzar la barrera hematoencefálica y acumularse en el cerebro y la médula espinal..[50]Los linfocitos reguladores (Treg) no logran suprimir las células efectoras, en su mayoría células CD8+ citotóxicas.[51] La liberación de citocinas proinflamatorias recluta microglía ingenua, que se pone en contacto con una unidad de oligodendrocitos-mielina mediante interacciones con Fc y receptores del complemento. A continuación, se transmite una señal desencadenante de muerte citotóxica a través del factor de necrosis tumoral α (TNFα) unido a la superficie..[52]Esto ocurre junto con un extenso daño axonal..[10]
Lucchinetti el al.[46] propusieron cuatro inmunopatrones distintos de formación de placas que se encuentran en pacientes en diferentes etapas de la enfermedad. Las placas de tipo I y II están dominadas por inflamación de linfocitos T y macrófagos y se cree que imitan los modelos de encefalomielitis autoinmune de células T o de células T más anticuerpos, respectivamente. La pérdida de mielina en las placas de tipo I puede deberse a factores tóxicos liberados por los macrófagos activados, mientras que el depósito de IgG y complemento sugiere un papel de los anticuerpos en las placas de tipo II. Por el contrario, los patrones III y IV muestran distrofia de oligodendrocitos grandes. Se cree que el patrón III está relacionado con lesiones inducidas por hipoxia que son impulsadas por defectos en la función mitocondrial,[53] mientras que las lesiones de patrón IV se asocian con una muerte profunda no apoptótica de los oligodendrocitos en la sustancia blanca periplaca.
Barnett y Prineas[54] analizó las lesiones de los pacientes directamente después del inicio de una recaída, durante la cual estaba en curso la formación activa de placa. Sus resultados sugieren que la apoptosis de los oligodendrocitos y la activación glial ocurren durante la formación activa temprana de la placa en ausencia de linfocitos inflamatorios o fagocitos de mielina. Propusieron que la vulnerabilidad de los oligodendrocitos, descrita en el patrón de tipo III de Lucchinetti, está presente en las primeras etapas de toda formación de placa y es el desencadenante de la necrosis postapoptótica posterior que inicia la fagocitosis de mielina por parte de los macrófagos en etapas posteriores. Los análisis in vitro de este proceso han implicado cascadas del complemento, factores de necrosis tumoral o segundos mensajeros gaseosos..[55] Aunque la identificación de las placas y el seguimiento de su progreso tienen un valor clínico importante, solo hay una correlación modesta entre la carga de lesiones desmielinizantes determinada por resonancia magnética convencional y la discapacidad clínica de los pacientes con EM (véase antes).
Cambios Funcionales
Los mecanismos de deterioro funcional durante la desmielinización a menudo incluyen la interrupción de los iones transmembrana Na+, K+ y Ca2+, la dispersión de sus canales iónicos correspondientes, una disminución en la eficiencia de la conducción de AP y la crisis metabólica resultante (Figura 3). La desmielinización puede explicar fácilmente la falla de conducción dentro del axón afectado. Si la conducción no falla por completo, la velocidad de conducción puede, sin embargo, reducirse y la ralentización diferencial entre diferentes axones puede causar retrasos variables en la conducción que dan como resultado picos desincronizados.
La desmielinización también permite que los axones denudados se yupen estrechamente, preparando así el escenario para las interacciones efápticas y la diafonía..[10] La reflexión también puede ocurrir debido a un desajuste de impedancia entre las longitudes de axón mielinizado y no mielinizado. Por otra parte, la hiperexcitabilidad no puede atribuirse directamente a la desmielinización; en cambio, se deben invocar cambios secundarios en la excitabilidad intrínseca para explicar fenómenos como la generación de picos ectópicos y la posdescarga (AD). Las alteraciones en la excitabilidad probablemente representen cambios compensatorios destinados a restaurar la función después de la interrupción causada directamente por la desmielinización, de acuerdo con un proceso denominado plasticidad homeostática.,[56]pero esa compensación evidentemente puede ser desadaptativa. Cada uno de los desenlaces antes mencionados, que no son excluyentes entre sí, contribuyen a producir diferentes síntomas observados en las enfermedades desmielinizantes.
Los síntomas paroxísticos caracterizados por el inicio repentino o la intensificación de síntomas como espasmos o dolor punzante probablemente surgen de la EA o de otro tipo de picos inapropiados de tipo ráfaga. Tales patrones de picos sugieren interacciones altamente no lineales entre las corrientes de iones contribuyentes.[57][58] y podría, al menos en teoría, involucrar interacciones entre diferentes regiones de la neurona.[59] A diferencia de las formas más genéricas de hiperexcitabilidad (p. ej., aumento de la tasa de activación o reducción del umbral), estos patrones específicos están limitados en cuanto a los mecanismos precisos a través de los cuales pueden surgir. Por lo tanto, identificar los cambios en los canales iónicos que subyacen a esas formas específicas de hiperexcitabilidad puede ayudar a restringir la búsqueda de cambios en los canales iónicos responsables de formas asociadas, aunque menos distintivas, de hiperexcitabilidad.
La interrupción del equilibrio energético en una neurona también podría tener un impacto profundo en el bienestar de las neuronas (Figura 3). De hecho, los cambios compensatorios pueden lograr restaurar ciertas funciones pero, sin revertir el problema principal, pueden surgir otros problemas. Por ejemplo, incluso si el bloqueo de conducción se evita mediante un cambio compensatorio apropiado en la excitabilidad (es decir, uno que no resulte en hiperexcitabilidad), el sistema puede ser menos eficiente energéticamente. La pérdida de los ahorros de energía que ofrece la conducción saltatoria induce la producción de energía mitocondrial compensatoria que puede provocar daño oxidativo y neurodegeneración.[53][60][61]
Hacer un seguimiento de esta larga lista de cambios neurobiológicos, comprender las interrelaciones entre esos cambios y, en última instancia, vincular esos cambios con las manifestaciones clínicas y aplicar un tratamiento eficaz no es una tarea fácil. Para este fin, el modelado computacional es una herramienta invaluable. Las simulaciones no solo sirven para organizar la información que ya se conoce, sino que también identifican lagunas cruciales en el conocimiento. Por lo tanto, el uso juicioso del modelado computacional puede permitir una comprensión más integral y facilitar la aplicación más efectiva de esa comprensión, como se analiza a continuación.
Computational Modeling
Especially when paired with traditional experiments, computational modeling is indispensable for making sense of inconsistent data and complex mechanisms. These benefits are exemplified by the application of simulations in other fields, such as epilepsy.[62] Here we survey some of the history of computational modeling of axons, ion conductances, the physiology of myelin and demyelination, the immune system, mitochondria and other biological factors that are critical for understanding demyelinating diseases. Our review is not exhaustive but will provide a broad introduction to past, present, and future efforts in this area.
Modeling Axons
The computational modeling of axons has evolved taxonomically, from squid to mammalian tissues with a corresponding increase in sophistication. The Hodgkin and Huxley (HH) model, which provided the first thorough explanation of AP generation, was derived from experiments in unmyelinated giant axons of squid,[63][64] but this early model has proven to be an invaluable tool from which later, more sophisticated models of myelinated axons have evolved.
The spatial and biophysical heterogeneity conferred by the addition of myelin, and the consequent formation of nodes and internodal regions, represents a significant increase in axon complexity. The first computational model of a myelinated axon was a one-dimensional model that collapsed the myelin sheath into the underlying passive axolemma, used a uniform spatial step size to form the discrete approximation used in the numerical solution and employed a HH characterization of the nodal membrane.[65] Goldman & Albus[66] modified this model to include a description of the nodal membrane derived from experimental data on Xenopus laevis myelinated nerve fibers as determined by Frankenhaeuser & Huxley.[67] Subsequent studies have used the same basic form for the model with some variations for the representation of the axolemma.[15][68][69][70][71][72][73][74][75][76] The single cable model, describing the axon and all of its conductance and capacitance properties in one cable equation, has dominated the field until the present day despite the introduction of double cable models by Blight.[77] In double cable models, the internodal axolemma and the myelin sheath are independently represented. The double cable model has been expanded by Halter and Clark[78] to explore effects of the complex geometry of CNS oligodendrocytes (or Schwann cells in the case of the PNS).
Newer models have also improved upon previous simplifications including the anatomical complexity of the node of Ranvier, the distribution of ionic channels in the axon beneath the myelin sheath, the different electrical properties of the myelin sheath and the axolemma, and accommodation of possible current flow within the periaxonal space.[78][79][80][81][82] Anatomical representations of the paranodal area have allowed more detailed assessment of the effects of traumatic brain injury (TBI) on myelinated axons.[83] One of the most anatomically sophisticated models includes representation of the complex aqueous sheath structure of myelin lamellae as a series of interconnecting parallel lamellae in a model of motor nerves.[30][80]
Newer models have also considered the non-uniform distribution of ion channels throughout the axon [19,84,85,86,87,88,89,90].[19][84][85][86][87][88][89][90] Beyond ion channels, energy-dependent pumps and other ion-transport mechanisms provide important therapeutic targets for a number of neurological disorders.[91][92][93] In that respect, regulating transmembrane ion gradients costs significant energy and itself becomes an important consideration (see below).[94] This is especially true since the small volume of axons renders them prone to ion concentration changes that can dramatically impact driving forces, and can become problematic in models that assume constant intracellular and extracellular concentrations. But recent models have also dealt with such issues (see below).
All of the aforementioned models focus on simulating the change in axon membrane potential but one does not necessarily have experimental access to that variable, which of course complicates efforts to compare simulation and experimental data. Indeed, since extracellular recordings are the primary source of electrophysiological data from human subjects, the mathematical description of the extracellular field potential is of great interest clinically. Mathematical evaluations based on Laplace equations and Fourier transforms are used for calculating these potentials (sometimes referred to as line-source modeling, e.g.,.[82][95]
Modeling Specific Mechanisms
Beyond modeling normal axonal function, models can be used to explore particular mechanisms of axonal dysfunction especially when combined with experimental results that might better pinpoint mechanisms.[96] For example, Barrett and Barrett[97] showed that the depolarizing afterpotential (DAP) is sensitive to changes in conductance densities and capacitative changes that might occur during demyelination. A model by Blight was designed for simulation of his experimental recording conditions[77][98] and represents a single internode with multiple discrete segments and adjacent nodes and internodes in single lumped-parameter segments. This model included K+ channels in the axolemma of the single multi-segmented internode and treats the remainder as purely passive.
Building on this work, with careful attention to anatomical and electrophysiological details, McIntyre et al.[81] addressed the role of the DAP and afterhyperpolarization (AHP) in the recovery cycle—the distinct pattern of threshold fluctuation following a single action potential exhibited by human nerves. The simulations suggested distinct roles for active and passive Na+ and K+ channels in both afterpotentials and proposed that differences in the AP shape, strength-duration relationship, and the recovery cycle of motor and sensory nerve fibers can be attributed to kinetic differences in nodal Na+ conductances. Richardson et al.[99] also found that alteration to the standard “perfect insulator” model is necessary to reproduce DAPs during high-frequency stimulation.
The temperature sensitivity of demyelination effects has also been investigated computationally. Zlochiver[100] modeled persistent resonant reflection across a single focal demyelination plaque and found that this effect was sensitive to temperature and axon diameter. All of these examples demonstrated the power of simulations to examine specific mechanisms to explain observed phenomena from the clinic and offer guidance for future research.
As mentioned above, distinct changes in axon function are likely to manifest certain gain- or loss-of-function symptoms. If one could reproduce those changes in a computational model, the necessary parameter changes needed to convert the model between normal and abnormal operation could be used to predict the underlying pathology. Ideally this can lead to specific experiments in which the suspect ion channel, for example, is directly manipulated to see if its acute alteration is sufficient to reproduce or reverse certain pathological changes. Recent studies from the Prescott lab illustrate this process.[101][102] This success of these studies depended on advanced techniques including the dynamic clamp technique, used to switch between normal and abnormal spiking patterns and optogenetic tools. The next step is to link changes in axon function with disease symptoms (or their behavioural correlates in animal models).
In auditory nerve experiments, Tagoe and colleagues[103] demonstrated that hearing loss related to morphological changes at paranodes and juxtaparanodes, including the elongation of the auditory nerve around nodes of Ranvier, can result from exposure to lound noise, Extending this work, Hamann and collegues built a computational model to examine possible mechanisms. Their model suggested that it is more likely that a decrease in the density of Na-channels, rather than a redistribution of Na or K channels in general, is responsible for the conduction inhibition associated with acoustic over-exposure.[104] This experiment-model tandem demonstrates the revelatory potential of pairing computational models with laboratory experiments.
With a myelinated axon multi-layered model Stephanova and colleagues have had on-going success identifying likely anatomical and physiological deficiencies underlying various symptoms and conditions related to demyelination by making comparisons to the threshold tracking measurements from patients including latencies, refractoriness (the increase in threshold current during the relative refractory period), refractory period, supernormality, and threshold electrotonus values including stimulus-response measures such as current-threshold relationships.[21] For example, they found that mild internodal systematic demyelination (ISD) is a specific indicator for CMT1A. Mild paranodal systematic demyelination (PSD) and paranodal systematic demyelination (PISD) are specific indicators for CIPD and its subtypes. Severe focal demyelinations, internodal and paranodal, paranodal-internodal (IFD and PFD, PIFD) are specific indicators for acquired demyelinating neuropathies such as GBS and MMN [18] (see Figure 1).
Mild systematic and severe focal demyelination correspond to hereditary (CMT1A) and acquired (CIDP, GBS and MMN) neuropathies (Table 1). It was also found that 70% systematic demyelination is insufficient to cause symptoms and 96% is required for conduction block at a single node [18]. Thus, there is a large safety factor for focal demyelination. With their temperature-dependent version of the model of the myelinated human motor nerve fiber, Stephanova and Daskalova[105] showed that the electrotonic potentials in patients with CIDP are in high risk for blocking during hypo- and even mild hyperthermia and suggest mechanisms involving increased magnitude of polarizing nodal and depolarizing internodal electrotonic potentials, inward rectifier K+ and leak K+ currents increase with temperature, and the accommodation to long-lasting hyperpolarization is greater than to depolarization.
| Table 1
Correspondence between types of demyelination and diseases according to Stephanova and Dimitrov.[18] | |
|---|---|
| Type of Demyelination | Corresponding Disease (PNS) |
| Internodal systematic demyelination (ISD) | Charcot-Marie-Tooth Disease Type 1A (CMT1A) |
| Paranodal systematic demyelination (PSD) | Chronic inflammatory demyelinating polyneuropathy (CIDP) |
| Paranodal + internodal demyelination (PISD) | Chronic inflammatory demyelinating polyneuropathy (CIPD) subtypes |
| Internodal focal demyelination (IFD) | Guillain-Barré (GBS) |
| Paranodal focal demyelination (PFD) | Multifocal Motor Neuropathy (MMN) |
| Paranodal + focal demyelination (PIFD) | Multifocal Motor Neuropathy (MMN) |
Simple Models and Nonlinear Dynamical Analysis
Given the temporal dissociation between the manifestation of symptoms and the rates of demyelination and remyelination, homeostatic processes undoubtedly occur within axons, which include the redistribution of ion channels in demyelinated plaques.[106][107] But given the diversity of ion channels expressed by different axons and only patchy knowledge of how expression levels change, building detailed models to investigate those homeostatic processes is problematic. Especially under those conditions, highly simplified models can help identify fundamental principles, as exemplified by joint use of modified HH and Morris-Lecar models [57,58]. The results of those studies suggested a simple explanation for the breadth of symptoms encountered during demyelination by revealing that the ratio of Na+ to leak K+ conductance, g(Na)/g(L), acted as a four-way switch controlling excitability patterns that included failure of AP propagation, normal AP propagation, AD, and spontaneous spiking.
Further studies with this model suggested the potential for competition or cooperation between different regions of the same neuron.[59] Cooperativity between remote sites of ectopic spiking allows AD to be initiated and maintained at different locations within a single axon, thus providing a compelling explanation for the temporal and spatial discontinuities of pain and other symptoms presented by MS patients. Remarkably, in a recent study of demyelinated axons in a cuprizone mouse model, experimental evidence was seen for a redistribution of ion channels from the node of Ranvier, enhanced ectopic excitability along with antidromically propagated APs from the demyelinated plaque, as well as a compensatory shift in the excitability of membranes proximal to the soma.[108] All of these observations concur or are consistent with the computational model predictions of Coggan and colleagues and imply the success of the computational approach to guiding laboratory studies.
Furthermore, these simplified models enabled application of mathematical tools to examine the nonlinear mechanisms by which AD is initiated and terminated.[57][58][59] Bifurcation analysis revealed the underlying bistability of axon excitability under pathological conditions, as well as the factors controlling the transition from one attractor state to another. AD, for example, requires a slow inward current that allows for two stable attractor states, one corresponding to quiescence and the other to repetitive spiking (a limit cycle). Termination of AD was explained by the attractor associated with repetitive spiking being destroyed. This occurred when ultra-slow negative feedback in the form of intracellular Na+ accumulation caused the destruction of the limit-cycle attractor state [58]. Other studies using bifurcation analysis suggest that ion concentration changes can introduce slow dynamics that may be important for understanding pathological outcomes [94,109].[94][109]
Modeling at Small Scales
Studies mentioned above highlight the importance of ion concentration changes but each of them only considered those changes at a relatively course scale. By comparison, the study by Lorpreore et al.[110] tackled the daunting problem of modeling three-dimensional electro-diffusion of ion fluxes in micro and nano-domains surrounding ion channels at the node of Ranvier. In this unique model, the fluxes of ions are calculated by Poisson-Nernst-Planck equations with finite volume techniques. The fluxes and electric potentials were evaluated within voxels formed by a Delaunay-Voronoi mesh of the axon interior and exterior close to the membrane. Importantly, the algorithm was validated and results agreed with cable model predictions. Divergence from cable model predictions at smaller cluster sizes revealed the importance of each channel’s own electric field.
The above example highlights the point that models can simulate more than ion channels and membrane potential. Indeed, models can and must dig deeper into biophysical mechanisms like electro-diffusion and into signaling pathways that ultimately serve to regulate ion channel function and expression. A promising method called Biochemical Systems Theory (BST) may be useful in the future for pre-screening the effects of drugs at the systemic level. Broome and Coleman[111] demonstrated the power of this technique by modeling several biochemical pathways in neurons associated with cell death during MS including reactive oxygen and nitrogen species formation, Ca2+ dynamics, death complex formation, apoptotic factor release, and inflammatory responses together with three different states: normal, MS disease and treatment. At the atomic-level, a computational model of myelin basic protein (MBP) structure was carried-out because post-translational modifications of MBP may contribute to demyelination in MS.[112] It is important to understand its 3D structure to predict interaction sites with other molecules but a crystal structure for this protein might never be measured directly. This type of modeling may, therefore, represent an effective way to predict the structure by combining knowledge of amino acid sequence with information from similar proteins. The challenge for and the true power of modeling lies in connecting mechanisms that operate at vastly different scales, from molecular structure to the nervous system as a whole, and beyond, to address how the nervous system interacts with the immune system.
Models of Immune Factors. While there are numerous computational models of the immune system,[113] those related to MS typically model genetic interaction networks, either represented as sets of ordinary differential equations (ODEs) or Boolean networks. One systems biology model of a possible cellular mechanism of RRMS found breakdown in homeostasis of effector (Teff) and regulatory T (Treg) cells.[114][115] By changing parameters in the Teff-Treg feedback loop, under continual stochastic external stimulus from antigens, the model reproduced spontaneous and apparently stochastic immune relapses. The irreversible damage from each episode accumulates over time. Novel predictions include the suggestion that the timing of Treg immunotherapy in the immune response cycle is critical in determining whether intervention is beneficial or deleterious.
Models of Mitochondrial Dysfunction. As mentioned above, myelin enables more energy efficient AP conduction along the axon. The increased energy demands placed on the demyelinated axon represents yet another challenge to the afflicted neuron. Beyond the loss of saltatory conduction, there is mounting evidence of a critical role for astrocytes and oligodendrocytes in supplying energy to neurons and this process has also been the subject of computational modeling.[116]
There are many ways mitochondrial function can go awry and the compensatory pathways are equally complicated.[53][60][61] For example, mitochondrial dysfunction can be rooted in perturbed Ca2+ signaling within mitochondria, disrupted proton gradients or electron chain, reduction-oxidation imbalance as well as the consequences of reduced ATP availability, locally and globally. Multi-scale models of heart, for example, have been used to link altered mitochrondrial Ca2+ signaling to arrhythmia [60]. Using mitochondrial network modeling, this study demonstrated how even slightly too much reactive oxygen species can trigger a cell-wide collapse of mitochondrial membrane potential. This is an excellent example of how a computational model can link processes occurring at different levels, and it is precisely these linkages that must be established in the field of demyelination diseases.
Missing Links and the Need for Integration
Within the field of demyelinating diseases, modeling efforts have traditionally focused on axon models aimed at explaining various aspects of excitability. But as outlined above, those models have undergone tremendous evolution in complexity. In the process, models at different biological scales have begun to coalesce. For instance, models have now begun to address the regulation of ion concentrations and the consequences thereof for slow excitability changes, energy consumption, and toxicity. A computational approach will be necessary for integrating parallel and multifactorial etiologies associated with cognitive decline such as immune system signaling, energy metabolism, grey and white matter interactions, and genetic networks [117].[117] These continued efforts are starting to uncover the vast and interconnected feedback loops that operate across a broad range of spatial and temporal scales. That said, such efforts are still in their infancy and wide gaps remain in the modeling of demyelinating diseases. It is easier to describe what has been modeled than what has not. A truly integrated model involving multiple cell types that addresses all the hypothesized etiological factors remains unrealized. Among the unexplored or under-explored but potentially useful targets for modeling are grey matter pathology, myelin sheath aqueous layers, energy metabolism, and perhaps most importantly, multi-scale or integrated modeling. One should recognize that the necessary tools exist in other fields of study and can, therefore, be readily applied to the study of demyelination diseases.
Conclusions
The normal physiological function of the CNS or PNS relies on a highly regulated interplay of neurons, glia, vasculature and immune cells. This process encompasses and integrates numerous cellular and signaling components that produce a dynamical, computational whole. When any part goes awry, the entire system is forced to compensate. Even when compensation manages to rescue the most obvious consequences of demyelination, certain processes may not return to a completely normal state, which can lead to problems on longer time scales. The resulting symptoms are a confusing mixture of direct and compensatory changes that continuously evolve. The overall complexity has proven to be intractable to efficient experimental dissection. The application of computational modeling techniques represents an invaluable approach to help break the impasse and engender a new era of understanding and discovery.
Acknowledgments
Support provided by the Canadian Institutes of Health Research New Investigator Award and the Ontario Early Researcher Award (SAP). We thank Heiki Blum for assistance with figure preparation.
Author Contributions
All authors contributed to the writing of this manuscript. Figures were provided by Sven G. Meuth.
Conflicts of Interest
The authors declare no conflict of interest.
Article information
Int J Mol Sci. 2015 Sep; 16(9): 21215–21236. Published online 2015 Sep 7. doi: 10.3390/ijms160921215 PMCID: PMC4613250 PMID: 26370960 Jay S. Coggan,1,* Stefan Bittner,2 Klaus M. Stiefel,1 Sven G. Meuth,2 and Steven A. Prescott3,4 Christoph Kleinschnitz, Academic Editor 1NeuroLinx Research Institute, La Jolla, CA 92039, USA; E-Mail: gro.xniloruen@sualk 2Department of Neurology, Institute of Physiology, Universitätsklinikum Münster, 48149 Münster, Germany; E-Mails: moc.kooltuo@renttib-nafets (S.B.); ed.retsneumku@htuem.nevs (S.G.M.) 3Neurosciences and Mental Health, the Hospital for Sick Children, Toronto, ON M5G 1X8, Canada; E-Mail: ac.sdikkcis@ttocserp.evets 4Department of Physiology and the Institute of Biomaterials and Biomedical Engineering, University of Toronto, Toronto, ON M5G 1X8, Canada
- Author to whom correspondence should be addressed; E-Mail: gro.xniloruen@yaj; Tel.: +1-858-243-6720.
Received 2015 May 26; Accepted 2015 Aug 25. Copyright © 2015 by the authors; licensee MDPI, Basel, Switzerland. This article is an open access article distributed under the terms and conditions of the Creative Commons Attribution license (http://creativecommons.org/licenses/by/4.0/). Articles from International Journal of Molecular Sciences are provided here courtesy of Multidisciplinary Digital Publishing Institute (MDPI)
Bibliography
- ↑ Virchow R. Uber das ausgebreitete Vorkommen einer dem Nervenmark analogen Substanz in den tierischen Geweben. Virchows Arch. Pathol. Anat. 1854;6:562–572. doi: 10.1007/BF02116709. [CrossRef] [Google Scholar]
- ↑ Stiefel K.M., Torben-Nielsen B., Coggan J.S. Proposed evolutionary changes in the role of myelin. Front. Neurosci. 2013;8 doi: 10.3389/fnins.2013.00202.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Bullock T.H., Moore J.K., Fields R.D. Evolution of myelin sheaths: Both lamprey and hagfish lack myelin. Neurosci. Lett. 1984;48:145–148. doi: 10.1016/0304-3940(84)90010-7. [PubMed] [CrossRef] [Google Scholar]
- ↑ Davis A.D., Weatherby T.M., Hartline D.K., Lenz P.H. Myelin-like sheaths in copepod axons. Nature. 1999;398:571–571. doi: 10.1038/19212. [PubMed] [CrossRef] [Google Scholar]
- ↑ Hartline D.K., Colman D.R. Rapid conduction and the evolution of giant axons and myelinated fibers. Curr. Biol. 2007;17:R29–R35. doi: 10.1016/j.cub.2006.11.042. [PubMed] [CrossRef] [Google Scholar]
- ↑ Arancibia-Carcamo I.L., Attwell D. The node of ranvier in CNS pathology. Acta Neuropathol. 2014;128:161–175. doi: 10.1007/s00401-014-1305-z.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Faisal A.A., White J.A., Laughlin S.B. Ion-channel noise places limits on the miniaturization of the brain’s wiring. Curr. Biol. 2005;15:1143–1149. doi: 10.1016/j.cub.2005.05.056. [PubMed] [CrossRef] [Google Scholar]
- ↑ Babbs C.F., Riyi S. Subtle paranodal injury slows impulse conduction in a mathematical model of myelinated axons. PLoS ONE. 2013;8:e67767. doi: 10.1371/journal.pone.0067767. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ 9.0 9.1 9.2 Trapp B.D., Nave K.A. Multiple sclerosis: An immune or neurodegenerative disorder? Annu. Rev. Neurosci. 2008;31:247–69. doi: 10.1146/annurev.neuro.30.051606.094313. [PubMed] [CrossRef] [Google Scholar]
- ↑ 10.0 10.1 10.2 10.3 Compston A., Coles A. Multiple sclerosis. Lancet. 2008;372:1502–1517. doi: 10.1016/S0140-6736(08)61620-7. [PubMed] [CrossRef] [Google Scholar]
- ↑ Ostermann P.O., Westerberg C.E. Paroxysmal attacks in multiple sclerosis. Brain. 1975;98:189–202. doi: 10.1093/brain/98.2.189. [PubMed] [CrossRef] [Google Scholar]
- ↑ Twomey J.A., Espir M.L. Paroxysmal symptoms as the first manifestations of multiple sclerosis. J. Neurol. Neurosurg. Psychiatry. 1980;43:296–304. doi: 10.1136/jnnp.43.4.296. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Seewann A., Vrenken H., van der Valk P., Blezer E.L., Knol D.L., Castelijns J.A., Polman C.H., Pouwels P.J., Barkhof F., Geurts J.J. Diffusely abnormal white matter in chronic multiple sclerosis: Imaging and histopathologic analysis. Arch. Neurol. 2009;66:601–609. doi: 10.1001/archneurol.2009.57. [PubMed] [CrossRef] [Google Scholar]
- ↑ Ceccarelli A., Bakshi R., Neema M. MRI in multiple sclerosis: A review of the current literature. Curr. Opin. Neurol. 2012;25:402–409. doi: 10.1097/WCO.0b013e328354f63f. [PubMed] [CrossRef] [Google Scholar]
- ↑ 15.0 15.1 Moore J.W., Joyner R.W., Brill M.H., Waxman S.D., Najar-Joa M. Simulations of conduction in uniform myelinated fibers. Relative sensitivity to changes in nodal and internodal parameters. Biophys. J. 1978;21:147–160. doi: 10.1016/S0006-3495(78)85515-5. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Waxman S.G., Kocsis J.D., Stys P.K. The Axon: Structure, Function and Pathophysiology. Oxford University Press; New York, NY, USA: 1995. [Google Scholar]
- ↑ Polman C.H., Reingold S.C., Banwell B., Clanet M., Cohen J.A., Filippi M., Fujihara K., Havrdova E., Hutchinson M., Kappos L., et al. Diagnostic criteria for multiple sclerosis: 2010 revisions to the McDonald criteria. Ann. Neurol. 2011;69:292–302. doi: 10.1002/ana.22366. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ 18.0 18.1 Stephanova D.I., Dimitrov B. Computational Neuroscience: Simulated Demyelinating Neuropathies and Neuronopathies. CRC Press; Boca Raton, FL, USA: 2013. [Google Scholar]
- ↑ 19.0 19.1 Bostock H., Baker M., Reid G. Changes in excitability of human motor axons underlying post-ischaemic fasciculations: Evidence for two stable states. J. Physiol. 1991;441:537–557. doi: 10.1113/jphysiol.1991.sp018766.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Mogyoros I., Kiernan M.C., Burke D., Bostock H. Strength-duration properties of sensory and motor axons in amyotrophic lateral sclerosis. Brain. 1998;121:851–859. doi: 10.1093/brain/121.5.851. [PubMed] [CrossRef] [Google Scholar]
- ↑ 21.0 21.1 Kiernan M.C., Burke D., Andersen K.V., Bostock H. Multiple measures of axonal excitability: A new approach in clinical testing. Muscle Nerve. 2000;23:399–409. doi: 10.1002/(SICI)1097-4598(200003)23:3<399::AID-MUS12>3.0.CO;2-G. [PubMed] [CrossRef] [Google Scholar]
- ↑ Cappelen-Smith C., Kuwabara S., Lin C.S., Mogyoros I., Burke D. Membrane properties in chronic inflammatory demyelinating polyneuropathy. Brain. 2001;124:2439–2447. doi: 10.1093/brain/124.12.2439. [PubMed] [CrossRef] [Google Scholar]
- ↑ Kuwabara S., Ogawara K., Sung J.Y., Mori M., Kanai K., Hattori T., Yuki N., MLin C.S., Burke D., Bostock H. Differences in membrane properties of axonal and demyelinating Guillain-Barré syndromes. Ann. Neurol. 2002;52:180–187. doi: 10.1002/ana.10275. [PubMed] [CrossRef] [Google Scholar]
- ↑ Nodera H., Bostock H., Kuwabara S., Sakamoto T., Asanuma K., Jia-Ying S., Ogawara K., Hattori N., Hirayama M., Sobue G., et al. Nerve excitability properties in Charcot-Marie-Tooth disease type 1A. Brain. 2004;127:203–211. doi: 10.1093/brain/awh020. [PubMed] [CrossRef] [Google Scholar]
- ↑ Sung M.H., Simon R. In silico simulation of inhibitor drug effects on nuclear factor-κB pathway dynamics. Mol. Pharmacol. 2004;66:70–75. doi: 10.1124/mol.66.1.70. [PubMed] [CrossRef] [Google Scholar]
- ↑ Stephanova D.I., Daskalova M. Differences in potentials and excitability properties in simulated cases of demyelinating neuropathies. Part III. Paranodal internodal demyelination. Clin. Neurophysiol. 2005;116:2334–2341. doi: 10.1016/j.clinph.2005.07.013. [PubMed] [CrossRef] [Google Scholar]
- ↑ Stephanova D.I., Daskalova M.S. Differences between the channels, currents and mechanisms of conduction slowing/block and accommodative processes in simulated cases of focal demyelinating neuropathies. Eur. Biophys. J. 2008;37:829–842. doi: 10.1007/s00249-008-0284-1. [PubMed] [CrossRef] [Google Scholar]
- ↑ Stephanova D.I., Alexandrov A.S. Simulating mild systematic and focal demyelinating neuropathies: Membrane property abnormalities. J. Integr. Neurosci. 2006;5:595–623. doi: 10.1142/S0219635206001331. [PubMed] [CrossRef] [Google Scholar]
- ↑ Stephanova D.I., Daskalova M., Alexandrov A.S. Channels, currents and mechanisms of accommodative processes in simulated cases of systematic demyelinating neuropathies. Brain Res. 2007;1171:138–151. doi: 10.1016/j.brainres.2007.07.029. [PubMed] [CrossRef] [Google Scholar]
- ↑ 30.0 30.1 Stephanova D.I., Krustev S.M., Negrev N., Daskalova M. The myelin sheath aqueous layers improve the membrane properties of simulated chronic demyelinating neuropathies. J. Integr. Neurosci. 2011;10:105–120. doi: 10.1142/S0219635211002646. [PubMed] [CrossRef] [Google Scholar]
- ↑ Stephanova D.I., Alexandrov A.S., Kossev A., Christova L. Simulating focal demyelinating neuropathies: Membrane property abnormalities. Biol. Cybern. 2007;96:195–208. doi: 10.1007/s00422-006-0113-5. [PubMed] [CrossRef] [Google Scholar]
- ↑ Bø L., Geurts J.J., Mörk S.J., van der Valk P. Grey matter pathology in multiple sclerosis. Acta Neurol. Scand. Suppl. 2006;183:48–50. doi: 10.1111/j.1600-0404.2006.00615.x. [PubMed] [CrossRef] [Google Scholar]
- ↑ Geurts J.J., Barkhof F. Grey matter pathology in multiple sclerosis. Lancet Neurol. 2008;7:841–851. doi: 10.1016/S1474-4422(08)70191-1. [PubMed] [CrossRef] [Google Scholar]
- ↑ Zivadinov R., Pirko I. Advances in understanding gray matter pathology in multiple sclerosis: Are we ready to redefine disease pathogenesis? BMC Neurol. 2012;12 doi: 10.1186/1471-2377-12-9. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Popescu B.F., Lucchinetti C.F. Pathology of demyelinating diseases. Annu. Rev. Pathol. 2012;7:185–217. doi: 10.1146/annurev-pathol-011811-132443.[PubMed] [CrossRef] [Google Scholar]
- ↑ Kurtzke J.F., Beebe G.W., Nagler B., Nefzger M.D., Auth T.L., Kurland L.T. Studies on the natural history of multiple sclerosis: V. Long-term survival in young men. Arch. Neurol. 1970;22:215–225. doi: 10.1001/archneur.1970.00480210025003. [PubMed] [CrossRef] [Google Scholar]
- ↑ Rao S.M., Leo G.J., Bernardin L., Unverzagt F. Cognitive dysfunction in multiple sclerosis. I. Frequency, patterns, and prediction. Neurology. 1991;41:685–691. doi: 10.1212/WNL.41.5.685. [PubMed] [CrossRef] [Google Scholar]
- ↑ Meuth S.G., Bittner S., Ulzheimer J.C., Kleinschnitz C., Kieseier B.C., Wiendl H. Therapeutic approaches to multiple sclerosis: An update on failed, interrupted, or inconclusive trials of neuroprotective and alternative treatment strategies. BioDrugs. 2010;24:317–330. doi: 10.2165/11537190-000000000-00000. [PubMed] [CrossRef] [Google Scholar]
- ↑ Goldenberg M.M. Multiple sclerosis review. Pharm. Ther. 2012;37:137–139.[PMC free article] [PubMed] [Google Scholar]
- ↑ Göbel K., Wedell J.H., Herrmann A.M., Wachsmuth L., Pankratz S., Bittner S., Budde T., Kleinschnitz C., Faber C., Wiendl H., et al. 4-Aminopyridine ameliorates mobility but not disease course in an animal model of multiple sclerosis. Exp. Neurol. 2013;248:62–71. doi: 10.1016/j.expneurol.2013.05.016.[PubMed] [CrossRef] [Google Scholar]
- ↑ Krishnan A.V., Kiernan M.C. Sustained-release fampridine and the role of ion channel dysfunction in multiple sclerosis. Mult. Scler. 2013;19:385–391. doi: 10.1177/1352458512463769. [PubMed] [CrossRef] [Google Scholar]
- ↑ Bowe C.M., Kocsis J.D., Targ E.F., Waxman S.G. Physiological effects of 4-aminopyridine on demyelinated mammalian motor and sensory fibers. Ann. Neurol. 1987;22:264–268. doi: 10.1002/ana.410220212. [PubMed] [CrossRef] [Google Scholar]
- ↑ Sakurai M., Kanazawa I. Positive symptoms in multiple sclerosis: Their treatment with sodium channel blockers, lidocaine and mexiletine. J. Neurol. Sci. 1999;162:162–168. doi: 10.1016/S0022-510X(98)00322-0. [PubMed]
- ↑ Mattson M.P., Guthrie P.B., Kater S.B. A role for Na+-dependent Ca2+extrusion in protection against neuronal excitotoxicity. FASEB J. 1989;3:2519–2526. [PubMed] [Google Scholar]
- ↑ Moll N.M., Rietsch A.M., Thomas S., Ransohoff A.J., Lee J.C., Fox R., Chang A., Ransohoff R.M., Fisher E. Multiple sclerosis normal-appearing white matter: Pathology-imagig correlations. Ann. Neurol. 2011;70:764–773. doi: 10.1002/ana.22521. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ 46.0 46.1 Lucchinetti C., Brück W., Parisi J., Scheithauer B., Rodriguez M., Lassmann H. Heterogeneity of multiple sclerosis lesions: Implications for the pathogenesis of demyelination. Ann. Neurol. 2000;47:707–717. doi: 10.1002/1531-8249(200006)47:6<707::AID-ANA3>3.0.CO;2-Q. [PubMed] [CrossRef] [Google Scholar]
- ↑ Kassmann C.M., Nave K.A. Oligodendroglial impact on axonal function and survival— A hypothesis. Curr. Opin. Neurol. 2008;21:235–241. doi: 10.1097/WCO.0b013e328300c71f. [PubMed] [CrossRef] [Google Scholar]
- ↑ Scolding N., Franklin R. Axon loss in multiple sclerosis. Lancet. 1998;352:340–341. doi: 10.1016/S0140-6736(05)60463-1. [PubMed] [CrossRef] [Google Scholar]
- ↑ Mi S., Miller R.H., Lee X., Scott M.L., Shulag-Morskaya S., Shao Z., Chang J., Thill G., Levesque M., Zhang M., et al. LINGO-1 negatively regulates myelination by oligodendrocytes. Nat. Neurosci. 2005;8:745–751. doi: 10.1038/nn1460. [PubMed] [CrossRef] [Google Scholar]
- ↑ Bittner S., Ruck T., Schuhmann M.K., Herrmann A.M., Maati H.M., Bobak N., Göbel K., Langhauser F., Stegner D., Ehling P., et al. 2013 Endothelial TWIK-related potassium channel-1 (TREK1) regulates immune-cell trafficking into the CNS. Nat. Med. 2013;19:1161–1165. doi: 10.1038/nm.3303. [PubMed]
- ↑ Viglietta V., Baecher-Allan C., Weiner H.L., Hafler D.A. Loss of functional suppression by CD4+CD25+ regulatory T cells in patients with multiple sclerosis. J. Exp. Med. 2004;199:971–999. doi: 10.1084/jem.20031579.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Zajicek J.P., Wing M., Scolding N.J., Compston D.A. Interactions between oligodendrocytes and microglia. A major role for complement and tumour necrosis factor in oligodendrocyte adherence and killing. Brain. 1992;115:1611–1631. [PubMed] [Google Scholar]
- ↑ 53.0 53.1 53.2 Nikić I., Merkler D., Sorbara C., Brinkoetter M., Kreutzfeldt M., Bareyre F.M., Brück W., Bishop D., Misgeld T., Kerschensteiner M. A reversible form of axon damage in experimental autoimmune encephalomyelitis and multiple sclerosis. Nat. Med. 2011;17:495–499. doi: 10.1038/nm.2324. [PubMed] [CrossRef] [Google Scholar]
- ↑ Barnett M.H., Prineas J.W. Relapsing and remitting multiple sclerosis: Pathology of the newly forming lesion. Ann. Neurol. 2004;55:458–468. doi: 10.1002/ana.20016. [PubMed] [CrossRef] [Google Scholar]
- ↑ Van der Laan L.J., Ruuls S.R., Weber K.S., Lodder I.J., Döpp E.A., Dijkstra C.D. Macrophage phagocytosis of myelin in vitro determined by flow cytometry: Phagocytosis is mediated by CR3 and induces production of tumor necrosis factor-α and nitric oxide. J. Neuroimmunol. 1996;70:145–152. doi: 10.1016/S0165-5728(96)00110-5. [PubMed] [CrossRef] [Google Scholar]
- ↑ Wang G., Thompson S.M. Maladaptive homeostatic plasticity in a rodent model of central pain syndrome: Thalamic hyperexcitability after spinothalamic tract lesions. J. Neurosci. 2008;28:11959–11969. doi: 10.1523/JNEUROSCI.3296-08.2008. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ 57.0 57.1 Coggan J.S., Prescott S.A., Bartol T.M., Sejnowski T.J. Imbalance of ionic conductances contributes to diverse symptoms of demyelination. Proc. Natl. Acad. Sci. USA. 2010;107:20602–20609. doi: 10.1073/pnas.1013798107.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ 58.0 58.1 Coggan J.S., Ocker G.K., Sejnowski T.J., Prescott S.A. Explaining pathological changes in axonal excitability through dynamical analysis of conductance-based models. J. Neural Eng. 2011;8 doi: 10.1088/1741-2560/8/6/065002. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ 59.0 59.1 59.2 Coggan J.S., Prescott S.A., Sejnowski T.J. Cooperativity between remote sites of ectopic spiking allows afterdischarge to be initiated and maintained at different locations. J. Comput. Neurosci. 2015;39:17–28. doi: 10.1007/s10827-015-0562-8. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ 60.0 60.1 Aon M.A., Cortassa S., Akar F.G., Brown D.A., Zhou L., O’Rourke B. From mitochondrial dynamics to arrhythmias. Int. J. Biochem. Cell Biol. 2009;41:1940–1948. doi: 10.1016/j.biocel.2009.02.016. [PMC free article][PubMed] [CrossRef] [Google Scholar]
- ↑ 61.0 61.1 Su K., Bourdette D., Forte M. Mitochondrial dysfunction and neurodegeneration in multiple sclerosis. Front. Physiol. 2013;4doi: 10.3389/fphys.2013.00169. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Soltesz I., Staley K. Computational Neuroscience in Epilepsy. 1st ed. Elsevier; London, UK: 2008. [Google Scholar]
- ↑ Hodgkin A.L., Huxley A.F. The components of membrane conductance in the giant axon of Loligo. J. Physiol. 1952;116:473–496. doi: 10.1113/jphysiol.1952.sp004718. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Hodgkin A.L., Huxley A.F. Currents carried by sodium and potassium ions through the membrane of the giant axon of Loligo. J. Physiol. 1952;116:449–472. doi: 10.1113/jphysiol.1952.sp004717. [PMC free article] [PubMed]
- ↑ Fitzhugh R. Computation of impulse initiation and saltatory conduction in a myelinated nerve fiber. Biophys. J. 1962;2:11–21. doi: 10.1016/S0006-3495(62)86837-4. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Goldman L., Albus J.S. Computation of impulse conduction in myelinated fibers; theoretical basis of the velocity-diameter relation. Biophys. J. 1968;8:596–607. doi: 10.1016/S0006-3495(68)86510-5. [PMC free article][PubMed] [CrossRef] [Google Scholar]
- ↑ Frankenhaeuser B., Huxley A.F. The action potential in the myelinated nerve fiber of Xenopus laevis as computed on the basis of voltage clamp data. J. Physiol. 1964;171:302–315. doi: 10.1113/jphysiol.1964.sp007378.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Smith R.S., Koles Z.J. Myelinated nerve fibers: Computed effect of myelin thickness on conduction velocity. Am. J. Physiol. 1970;219:1256–1258.[PubMed] [Google Scholar]
- ↑ Hutchinson N.A., Koles Z.J., Smith R.S. Conduction velocity in myelinated nerve fibres of Xenopus laevis. J. Physiol. 1970;208:279–289. doi: 10.1113/jphysiol.1970.sp009119. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Koles Z.J., Rasminsky M. A computer simulation of conduction in demyelinated nerve fibres. J. Physiol. 1972;227:351–364. doi: 10.1113/jphysiol.1972.sp010036. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Hardy W.L. Propagation speed in myelinated nerve. II. Theoretical dependence on external Na and on temperature. Biophys. J. 1973;13:1071–1089. doi: 10.1016/S0006-3495(73)86046-1. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Schauf C.L., Davis F.A. Impulse conduction in multiple sclerosis: A theoretical basis for modification by temperature and pharmacological agents. J. Neurol. Neurosurg. Psychiatry. 1974;37:152–161. doi: 10.1136/jnnp.37.2.152.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Brill M.H., Waxman S.G., Moore J.W., Joyner R.W. Conduction velocity and spike configuration in myelinated fibres: Computed dependence on internode distance. J. Neurol. Neurosurg. Psychiatry. 1977;40:769–774. doi: 10.1136/jnnp.40.8.769. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Waxman S.G., Brill M.H. Conduction through demyelinated plaques in multiple sclerosis: Computer simulations of facilitation by short internodes. J. Neurol. Neurosurg. Psychiatry. 1978;41:408–416. doi: 10.1136/jnnp.41.5.408.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Wood S.L., Waxman S.G., Kocsis J.D. Conduction of trans of impulses in uniform myelinated fibers: Computed dependence on stimulus frequency. Neuroscience. 1982;7:423–430. doi: 10.1016/0306-4522(82)90276-7. [PubMed] [CrossRef] [Google Scholar]
- ↑ Goldfinger M.D. Computation of high safety factor impulse propagation at axonal branch points. Neuroreport. 2000;11:449–456. doi: 10.1097/00001756-200002280-00005. [PubMed] [CrossRef] [Google Scholar]
- ↑ 77.0 77.1 Blight A.R. Computer simulation of action potentials and afterpotentials in mammalian myelinated axons: The case for a lower resistance myelin sheath. Neuroscience. 1985;15:13–31. doi: 10.1016/0306-4522(85)90119-8. [PubMed] [CrossRef] [Google Scholar]
- ↑ 78.0 78.1 Halter J.A., Clark J.W., Jr. A distributed-parameter model of the myelinated nerve fiber. J. Theor. Biol. 1991;148:345–382. doi: 10.1016/S0022-5193(05)80242-5. [PubMed] [CrossRef] [Google Scholar]
- ↑ Schwarz J.R., Eikhof G. Na currents and action potentials in rat myelinated nerve fibres at 20 and 37 °C. Pflugers Arch. 1987;409:569–577. doi: 10.1007/BF00584655. [PubMed] [CrossRef] [Google Scholar]
- ↑ 80.0 80.1 Stephanova D.I. Myelin as longitudinal conductor: A multi-layered model of the myelinated human motor nerve fibre. Biol. Cybern. 2001;84:301–308. doi: 10.1007/s004220000213. [PubMed] [CrossRef] [Google Scholar]
- ↑ 81.0 81.1 McIntyre C.C., Richardson A.G., Grill W.M. Modeling the excitability of mammalian nerve fibers: Influence of afterpotentials on the recovery cycle. J. Neurophysiol. 2002;87:995–1006. [PubMed] [Google Scholar]
- ↑ 82.0 82.1 Einziger P.D., Livshitz L.M., Mizrahi J. Generalized cable equation model for myelinated nerve fiber. IEEE Trans. Biomed. Eng. 2005;52:1632–1642. doi: 10.1109/TBME.2005.856031. [PubMed] [CrossRef] [Google Scholar]
- ↑ Volman V., Ng L. Primary paranode demyelination modulates slowly developing axonal depolarization in a model of axonal injury. J. Neural Comput. 2014;37:439–457. [PubMed] [Google Scholar]
- ↑ Stephanova D.I., Bostock H. A Distributed-parameter model of the myelinated human motor nerve fibre: Temporal and spatial distributions of action potentials and ionic currents. Biol. Cybern. 1995;73:275–280. doi: 10.1007/BF00201429. [PubMed] [CrossRef] [Google Scholar]
- ↑ Chiu S.Y., Ritchie J.M. On the physiological role of internodal potassium channels and the security of conduction in myelinated nerve fibres. Proc. R. Soc. Lond. B Biol. Sci. 1984;220:415–422. doi: 10.1098/rspb.1984.0010.[PubMed] [CrossRef] [Google Scholar]
- ↑ Brismar T., Schwarz J.R. Potassium permeability in rat myelinated nerve fibres. Acta Physiol. Scand. 1985;124:141–148. doi: 10.1111/j.1748-1716.1985.tb07645.x. [PubMed] [CrossRef] [Google Scholar]
- ↑ Chiu S.Y., Schwarz W. Sodium and potassium currents in acutely demyelinated internodes of rabbit sciatic nerves. J. Physiol. 1987;391:631–649. doi: 10.1113/jphysiol.1987.sp016760. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Baker M., Bostock H., Grafe P., Martius P. Function and distribution of three types of rectifying channel in rat spinal root myelinated axons. J. Physiol. 1987;383:45–67. [PMC free article] [PubMed] [Google Scholar
- ↑ Röper J., Schwarz J.R. Heterogeneous distribution of fast and slow potassium channels in myelinated rat nerve fibres. J. Physiol. 1989;416:93–110. doi: 10.1113/jphysiol.1989.sp017751. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Bittner S., Meuth S.G. Targeting ion channels for the treatment of autoimmune neuroinflammation. Ther. Adv. Neurol. Disord. 2013;6:322–336. doi: 10.1177/1756285613487782. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Waxman S.G., Ritchie J.M. Molecular dissection of the myelinated axon. Ann. Neurol. 1993;33:121–136. doi: 10.1002/ana.410330202. [PubMed] [CrossRef] [Google Scholar]
- ↑ Bittner S., Budde T., Wiendl H., Meuth S.G. From the background to the spotlight: TASK channels in pathological conditions. Brain Pathol. 2010;20:999–1009. doi: 10.1111/j.1750-3639.2010.00407.x. [PMC free article][PubMed] [CrossRef] [Google Scholar]
- ↑ Ehling P., Bittner S., Budde T., Wiendl H., Meuth S.G. Ion channels in autoimmune neurodegeneration. FEBS Lett. 2011;585:3836–3842. doi: 10.1016/j.febslet.2011.03.065. [PubMed] [CrossRef] [Google Scholar]
- ↑ 94.0 94.1 Hübel N., Dahlem M.A. Dynamics from seconds to hours in Hodgkin-Huxley model with time-dependent ion concentrations and buffer reservoirs. PLoS Comput. Biol. 2014;10:e1003941. doi: 10.1371/journal.pcbi.1003941.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Ganapathy L., Clark J.W. Extracellular currents and potentials of the active myelinated nerve fibre. Biophys. J. 1987;52:749–761. doi: 10.1016/S0006-3495(87)83269-1. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Prescott S.A. Pathological changes in peripheral nerve excitability. In: Jaeger D., Jung R., editors. Encyclopedia of Computational Neurosci. 1st ed. Springer-Verlag; New York, NY, USA: 2015. [Google Scholar]
- ↑ Barrett E.F., Barrett J.N. Intracellular recording from vertebrate myelinated axons: Mechanism of the depolarizing afterpotential. J. Physiol. 1982;323:117–144. doi: 10.1113/jphysiol.1982.sp014064. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Blight A.R., Someya S. Depolarizing afterpotentials in myelinated axons of mammalian spinal cord. Neuroscience. 1985;15:1–12. doi: 10.1016/0306-4522(85)90118-6. [PubMed] [CrossRef] [Google Scholar]
- ↑ Richardson A.G., McIntyre C.C., Grill W.M. Modelling the effects of electric fields on nerve fibres: Influence of the myelin sheath. Med. Biol. Eng. Comput. 2000;38:438–446. doi: 10.1007/BF02345014. [PubMed] [CrossRef] [Google Scholar]
- ↑ Zlochiver S. Persistent reflection underlies ectopic activity in multiple sclerosis: A numerical study. Biol. Cybern. 2010;102:181–196. doi: 10.1007/s00422-009-0361-2. [PubMed] [CrossRef] [Google Scholar]
- ↑ Ratté S., Zhu Y., Lee K.Y., Prescott S.A. Criticality and degeneracy in injury-induced changes in primary afferent excitability and the implications for neuropathic pain. Elife. 2014;3:e02370. doi: 10.7554/eLife.02370.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Zhu Y., Feng B., Schwartz E.S., Gebhart G.F., Prescott S.A. Novel method to assess axonal excitability using channelrhodopsin-based photoactivation. J. Neurophysiol. 2015;113:2242–2249. doi: 10.1152/jn.00982.2014.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Tagoe T., Barker M., Jones A., Allcock N., Hamann M. Auditory nerve perinodal dysmyelination in noise-induced hearing loss. J. Neurosci. 2014;12:2684–2688. doi: 10.1523/JNEUROSCI.3977-13.2014.
- ↑ Brown A.M., Hamann M. Computational modeling of the effects of auditory nerve dysmyelination. Front. Neuroanat. 2014;8doi: 10.3389/fnana.2014.00073. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Stephanova D.I., Daskalova M. Electrotonic potentials in simulated chronic inflammatory demyelinating polyneuropathy at 20 °C–42 °C. J. Integr. Neurosci. 2015;27:1–18. doi: 10.1142/S0219635215500119. [PubMed] [CrossRef] [Google Scholar]
- ↑ Rasminsky M. Hyperexcitability of pathologically myelinated axons and positive symptoms in multiple sclerosis. Adv. Neurol. 1981;31:289–297.[PubMed] [Google Scholar]
- ↑ Ulrich J., Groebke-Lorenz W. The optic nerve in multiple sclerosis: A morphological study with retrospective clinicopathological correlation. Neuro-Ophthalmology. 1983;3:149–159. doi: 10.3109/01658108309009732.[CrossRef] [Google Scholar]
- ↑ Hamada M.S., Kole M.H. Myelin loss and axonal ion channel adaptations associated with gray matter neuronal hyperexcitability. J. Neurosci. 2015;35:7272–7786. [PMC free article] [PubMed] [Google Scholar]
- ↑ Yu N., Morris C.E., Joós B., Longtin A. Spontaneous excitation patterns computed for axons with injury-like impairments of sodium channels and Na/K pumps. PLoS Comput. Biol. 2012;8:e1002664. doi: 10.1371/journal.pcbi.1002664. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Lopreore C.L., Bartol T.M., Coggan J.S., Keller D.X., Sosinsky G.E., Ellisman M.H., Sejnowski T.J. Computational modeling of three-dimensional electrodiffusion in biological systems: Application to the node of Ranvier. Biophys. J. 2008;95:2624–2635. doi: 10.1529/biophysj.108.132167.
- ↑ Broome T.M., Cole.man R.A. A mathematical model of cell death in multiple sclerosis. J. Neurosci. Methods. 2011;201:420–425. doi: 10.1016/j.jneumeth.2011.08.008. [PubMed] [CrossRef] [Google Scholar]
- ↑ Ridsdale R.A., Beniac D.R., Tompkins T.A., Moscarello M.A., Harauz G. Three-dimensional structure of myelin basic protein. II. Molecular modeling and considerations of predicted structures in multiple sclerosis. J. Biol. Chem. 1997;272:4269–4275. doi: 10.1074/jbc.272.7.4269. [PubMed] [CrossRef] [Google Scholar]
- ↑ Pigozzo A.B., Macedo G.C., Santos R.W., Lobosco M. On the computational modeling of the innate immune system. BMC Bioinform. 2013;14 doi: 10.1186/1471-2105-14-S6-S7. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Doerck S., Göbel K., Weise G., Schneider-Hohendorf T., Reinhardt M., Hauff P., Schwab N., Linker R., Mäurer M., Meuth S.G., et al. Temporal pattern of ICAM-I mediated regulatory T cell recruitment to sites of inflammation in adoptive transfer model of multiple sclerosis. PLoS ONE. 2010;5:e15478. doi: 10.1371/journal.pone.0015478. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ De Mendizábal N.V., Carneiro J., Solé R.V., Goñi J., Bragard J., Martinez-Forero I., Martinez-Pasamar S., Sepulcre J., Torrealdea J., Bagnato F., et al. Modeling the effector-regulatory T cell cross-regulation reveals the intrinsic character of relapses in Multiple Sclerosis. BMC Syst. Biol. 2011;5doi: 10.1186/1752-0509-5-114. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Jolivet R., Coggan J.S., Allaman I., Magistretti P.J. Multi-timescale modeling of activity-dependent metabolic coupling in the neuron-glia-vasculature ensemble. PLoS Comput. Biol. 2015;11:e1004036. doi: 10.1371/journal.pcbi.1004036. [PMC free article] [PubMed] [CrossRef]
- ↑ Zeis T., Allaman I., Gentner M., Schroder K., Tschopp J., Magistretti P.J., Schaeren-Wiemers N. Metabolic gene expression changes in astrocytes in Multiple Sclerosis cerebral cortex are indicative of immune-mediated signaling. Brain Behav. Immun. 2015;48:315–325. doi: 10.1016/j.bbi.2015.04.013.[PubMed] [CrossRef] [Google Scholar]








