Difference between revisions of "Dinámica fisiológica en enfermedades desmielinizantes: desentrañar relaciones complejas a través del modelado por computadora"
Tags: Mobile web edit Mobile edit Visual edit |
Tags: Mobile web edit Mobile edit Visual edit |
||
| (13 intermediate revisions by the same user not shown) | |||
| Line 45: | Line 45: | ||
Additional article information | Additional article information | ||
== | == Abstracta == | ||
A pesar de la intensa investigación, hay pocos tratamientos disponibles para la mayoría de los trastornos neurológicos. Las enfermedades desmielinizantes no son una excepción. Quizás esto no sea sorprendente considerando la naturaleza multifactorial de estas enfermedades, que implican interacciones complejas entre las células del sistema inmunitario, la glía y las neuronas. En el caso de la esclerosis múltiple, por ejemplo, no hay unanimidad entre los investigadores sobre la causa o incluso qué sistema o tipo de célula podría ser la zona cero. Esta situación impide el desarrollo y la aplicación estratégica de terapias basadas en mecanismos. Discutiremos cómo el modelado computacional aplicado a preguntas en diferentes niveles biológicos puede ayudar a vincular observaciones dispares y descifrar mecanismos complejos cuyas soluciones no son susceptibles de reduccionismo simple. Al hacer predicciones comprobables y revelar brechas críticas en el conocimiento existente, estos modelos pueden ayudar a dirigir la investigación y proporcionarán un marco riguroso en el que integrar nuevos datos a medida que se recopilan. Hoy en día, no hay escasez de datos; el desafío es darle sentido a todo. En ese sentido, el modelado computacional es una herramienta invaluable que podría, en última instancia, transformar la forma en que entendemos, diagnosticamos y tratamos las enfermedades desmielinizantes. | |||
Palabras clave: mielina, desmielinización, esclerosis múltiple, enfermedad neurodegenerativa, modelo computacional, descubrimiento de fármacos | |||
== Introducción == | |||
Los sistemas nerviosos de los vertebrados a menudo se dividen en materia gris y blanca según su apariencia y funciones funcionales correspondientes. Mientras que la materia gris se compone principalmente de cuerpos celulares y dendritas, la materia blanca contiene principalmente axones y recibe su nombre de las láminas de membrana lipídica llamadas mielina que se enrollan estrechamente alrededor de esos axones..<ref>Virchow R. Uber das ausgebreitete Vorkommen einer dem Nervenmark analogen Substanz in den tierischen Geweben. Virchows Arch. Pathol. Anat. 1854;6:562–572. doi: 10.1007/BF02116709. [CrossRef] [Google Scholar]</ref> La mielina se origina a partir de diferentes clases de células gliales denominadas oligodendrocitos en el sistema nervioso central (SNC) y células de Schwann en el sistema nervioso periférico (SNP). | |||
El aislamiento eléctrico proporcionado por las láminas de mielina mejora la función axonal al aumentar tanto la eficiencia energética como la velocidad de conducción de los potenciales de acción (AP). Estas dos funciones pueden haber cambiado su importancia relativa durante la evolución..<ref>Stiefel K.M., Torben-Nielsen B., Coggan J.S. Proposed evolutionary changes in the role of myelin. Front. Neurosci. 2013;8 doi: 10.3389/fnins.2013.00202.[PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> La mielina apareció por primera vez en el Ordovícico (485 a 443 ma, o millones de años antes del presente) después de la separación de los ancestros de la lamprea y el mixino del resto de los linajes de vertebrados..<ref>Bullock T.H., Moore J.K., Fields R.D. Evolution of myelin sheaths: Both lamprey and hagfish lack myelin. Neurosci. Lett. 1984;48:145–148. doi: 10.1016/0304-3940(84)90010-7. [PubMed] [CrossRef] [Google Scholar]</ref> Con algunas excepciones interesantes,<ref>Davis A.D., Weatherby T.M., Hartline D.K., Lenz P.H. Myelin-like sheaths in copepod axons. Nature. 1999;398:571–571. doi: 10.1038/19212. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Hartline D.K., Colman D.R. Rapid conduction and the evolution of giant axons and myelinated fibers. Curr. Biol. 2007;17:R29–R35. doi: 10.1016/j.cub.2006.11.042. [PubMed] [CrossRef] [Google Scholar]</ref> La mielina o estructuras análogas se encuentran en todos los vertebrados y es fundamental para el correcto funcionamiento de sus sistemas nerviosos. El tiempo aproximado de la evolución de la mielina se puede deducir del tiempo conocido de divergencia entre cordados sin (agnatha) y con (todos los demás vertebrados) mielina. | |||
La envoltura de mielina se ve interrumpida por tramos no mielinizados, espaciados regularmente, conocidos como nódulos de Ranvier. La mielina acelera la conducción al restringir el flujo de carga transmembrana a través de los canales iónicos ubicados dentro de los nódulos. Dentro de los llamados entrenudos, la corriente fluye por el axón y muy poca pasa a través de la membrana celular aislada. El AP se regenera en cada nodo donde la densidad de los canales de sodio y potasio dependientes de voltaje es muy alta. Este proceso se denomina “conducción saltatoria” ya que el PA parece saltar de nodo en nodo. Las interrupciones en este sistema de comunicaciones de fuego rápido pueden estar asociadas con una serie de disfunciones del sistema nervioso..<ref>Arancibia-Carcamo I.L., Attwell D. The node of ranvier in CNS pathology. Acta Neuropathol. 2014;128:161–175. doi: 10.1007/s00401-014-1305-z.[PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> | |||
En varios aspectos, los axones parecen operar en límites físicos. Un ejemplo interesante es que el tamaño de los axones parece estar limitado por el ruido térmico intrínseco a las proteínas del canal iónico; cualquier axón de menos de 0,1 μm sería inútil para la transferencia de información debido a sus altos niveles de ruido.<ref>Faisal A.A., White J.A., Laughlin S.B. Ion-channel noise places limits on the miniaturization of the brain’s wiring. Curr. Biol. 2005;15:1143–1149. doi: 10.1016/j.cub.2005.05.056. [PubMed] [CrossRef] [Google Scholar]</ref>Curiosamente, 0,1 μm es también aproximadamente el diámetro de axón más pequeño observado en los sistemas nerviosos [7]. Este y otros hallazgos similares sugieren que los axones y sus subestructuras son dispositivos biológicos finamente sintonizados, pero que la sintonía evidentemente puede verse interrumpida en condiciones patológicas..<ref>Babbs C.F., Riyi S. Subtle paranodal injury slows impulse conduction in a mathematical model of myelinated axons. PLoS ONE. 2013;8:e67767. doi: 10.1371/journal.pone.0067767. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> | |||
La desmielinización pone en marcha cambios funcionales que son importantes para las características clínicas pero que no se explican fácilmente por cambios inmunológicos o radiológicos. La ubicación de una placa predice qué sistema se verá afectado (motor frente a sensorial, visual frente a táctil), pero no cómo se verá afectado. Esto destaca la importancia de evaluar la función (además de la estructura) y cómo cambia después de la desmielinización. Después de presentar las enfermedades desmielinizantes, discutiremos cómo las manifestaciones clínicas de esas enfermedades reflejan diversos cambios patológicos en la función del axón. Argumentaremos que la comprensión de esos cambios y la capitalización total de esa comprensión con fines diagnósticos y terapéuticos pueden beneficiarse enormemente del modelado computacional. | |||
== Enfermedades desmielinizantes == | |||
[[File:Jay S. Coggan1.jpeg|thumb|Figura 1: Trastornos desmielinizantes del sistema nervioso periférico (SNP). ('''A''') Polineuropatías desmielinizantes primarias y ('''B''') Polineuropatías con daño axonal. Abreviaturas: CMT 1, 2 y 4: enfermedad de Charcot-Marie-Tooth; CMTX: enfermedad de Charcot-Marie-Tooth ligada al cromosoma X; HNPP: neuropatía hereditaria con tendencia a parálisis por presión; AIDP: polineuropatía desmielinizante inflamatoria aguda; SGB: Síndrome de Guillain-Barré. CIDP: polineuropatía desmielinizante inflamatoria crónica; MGUS: gammapatía monoclonal de significado indeterminado; POEMAS: polineuropatía, organomegalia, endocrinopatía o edema M-proteína y anomalías cutáneas; HSAN I-IV: neuropatía sensitiva y autonómica hereditaria.|500x500px]]Hay un gran número de enfermedades desmielinizantes que afectan tanto al SNP (Figura 1) como al SNC (Figura 2). Las etiologías son heterogéneas y van desde trastornos genéticos hasta mecanismos metabólicos, infecciosos o autoinmunitarios. La esclerosis múltiple (EM) es el más prevalente de estos trastornos, con un estimado de 3 millones de pacientes en todo el mundo. Su causa subyacente es incierta, pero se cree que implica una predisposición genética a los agentes ambientales.<ref name=":0">Trapp B.D., Nave K.A. Multiple sclerosis: An immune or neurodegenerative disorder? Annu. Rev. Neurosci. 2008;31:247–69. doi: 10.1146/annurev.neuro.30.051606.094313. [PubMed] [CrossRef] [Google Scholar]</ref><ref name=":1">Compston A., Coles A. Multiple sclerosis. Lancet. 2008;372:1502–1517. doi: 10.1016/S0140-6736(08)61620-7. [PubMed] [CrossRef] [Google Scholar]</ref>y puede involucrar componentes inmunológicos, de respuesta al trauma, biofísicos, genéticos y/o metabólicos.<ref name=":1" />Los síntomas y lesiones deben ser múltiples tanto en el tiempo como en el espacio. Es decir, debe haber múltiples episodios en el tiempo, involucrando partes desconectadas del sistema nervioso central. No está claro si la desmielinización inflamatoria es un evento primario o secundario dentro del proceso de la enfermedad..<ref name=":0" /><ref>Ostermann P.O., Westerberg C.E. Paroxysmal attacks in multiple sclerosis. Brain. 1975;98:189–202. doi: 10.1093/brain/98.2.189. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Twomey J.A., Espir M.L. Paroxysmal symptoms as the first manifestations of multiple sclerosis. J. Neurol. Neurosurg. Psychiatry. 1980;43:296–304. doi: 10.1136/jnnp.43.4.296. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> La mayoría de los tratamientos tienen como objetivo el sistema inmunitario o la barrera hematoencefálica, pero el control de los síntomas neurológicos a través de la modulación de la excitabilidad axonal también juega un papel importante (ver más abajo). | |||
[[File:Jay S. Coggan 2.jpeg|left|thumb|Figura 2: Trastornos desmielinizantes del sistema nervioso central (SNC). Abreviaturas: MS: esclerosis múltiple; ADEM: encefalomielitis aguda diseminada; VIH: virus de la inmunodeficiencia humana; LMP: leucoencefalopatía multifocal progresiva; HTLV-1: virus linfotrópico T humano 1; PRES: síndrome de encefalopatía posterior reversible.]] | |||
=== Evaluación clínica de la esclerosis múltiple === | |||
Los síntomas son diversos y pueden ocurrir en todas las combinaciones dentro de un paciente individual. El diagnóstico requiere que haya múltiples lesiones y episodios sintomáticos a lo largo del tiempo, involucrando partes desconectadas del SNC. Además, los síntomas tienden a estar mal correlacionados con las medidas radiológicas. En la gran mayoría de los casos, las características clínicas individuales no se correlacionan bien con los hallazgos de la resonancia magnética, especialmente para las lesiones cerebrales..<ref>Seewann A., Vrenken H., van der Valk P., Blezer E.L., Knol D.L., Castelijns J.A., Polman C.H., Pouwels P.J., Barkhof F., Geurts J.J. Diffusely abnormal white matter in chronic multiple sclerosis: Imaging and histopathologic analysis. Arch. Neurol. 2009;66:601–609. doi: 10.1001/archneurol.2009.57. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Ceccarelli A., Bakshi R., Neema M. MRI in multiple sclerosis: A review of the current literature. Curr. Opin. Neurol. 2012;25:402–409. doi: 10.1097/WCO.0b013e328354f63f. [PubMed] [CrossRef] [Google Scholar]</ref><ref name=":2">Moore J.W., Joyner R.W., Brill M.H., Waxman S.D., Najar-Joa M. Simulations of conduction in uniform myelinated fibers. Relative sensitivity to changes in nodal and internodal parameters. Biophys. J. 1978;21:147–160. doi: 10.1016/S0006-3495(78)85515-5. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> Esta disociación clínico-radiológica exige una mejor comprensión teórica de los síntomas de desmielinización y los cambios biofísicos subyacentes que los acompañan, lo que por supuesto plantea la pregunta de qué sucede exactamente con los axones afectados. | |||
Los síntomas a menudo son intermitentes y pueden incluir pérdida de función (síntomas negativos como entumecimiento, debilidad muscular, hormigueo, ceguera, incontinencia, pérdida de la función sexual, pérdida del equilibrio, dificultad para hablar, estreñimiento, fatiga incapacitante, depresión, disfunción cognitiva , incapacidad para tragar, alteración de la marcha y pérdida del control de la respiración) y ganancia de función (síntomas positivos como espasmos, espasticidad, calambres, dolor, visión borrosa o doble, urgencia o vacilación urinaria, náuseas, entre otros).<ref>Waxman S.G., Kocsis J.D., Stys P.K. The Axon: Structure, Function and Pathophysiology. Oxford University Press; New York, NY, USA: 1995. [Google Scholar]</ref> Los primeros criterios de diagnóstico diferencial incluyen el signo de Lhermitte (sensaciones relacionadas con la flexión del cuello) y el fenómeno de Uhthoff (empeoramiento de los síntomas dependiente de la temperatura). El diagnóstico diferencial de la EM sigue de cerca los criterios de McDonald.<ref>Polman C.H., Reingold S.C., Banwell B., Clanet M., Cohen J.A., Filippi M., Fujihara K., Havrdova E., Hutchinson M., Kappos L., et al. Diagnostic criteria for multiple sclerosis: 2010 revisions to the McDonald criteria. Ann. Neurol. 2011;69:292–302. doi: 10.1002/ana.22366. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> | |||
En los estudios de diagnóstico en humanos de potenciales evocados visuales, sensoriales o motores (VEP, SEP, MEP), solo se puede medir con precisión la latencia o la velocidad de conducción (con variaciones de aproximadamente 30% a 40% entre diferentes laboratorios). Pero estas medidas dan poca pista sobre los mecanismos subyacentes que involucran el enlentecimiento o el bloqueo de la conducción, o factores morfológicos o funcionales tales como ramificación, desmielinización, remielinización, afinamiento axonal (disminución del área transversal), atenuación o rebrote, cambios en la conducción relacionados con la temperatura. , o malpolarización (hiper o hipo). No obstante, el tipo de lesión desmielinizante puede dar pistas sobre la etiología y, por tanto, orientar el tratamiento; por ejemplo, los factores genéticos parecen estar más fuertemente correlacionados con los procesos de enfermedad internodal y las disfunciones inmunológicas causan anomalías paranodales..<ref name=":3">Stephanova D.I., Dimitrov B. Computational Neuroscience: Simulated Demyelinating Neuropathies and Neuronopathies. CRC Press; Boca Raton, FL, USA: 2013. [Google Scholar]</ref> | |||
Una serie de pruebas se utilizan de forma rutinaria para evaluar la función neural. En la electroneurografía, se aplica un breve estímulo eléctrico a un nervio periférico en una posición predefinida anatómicamente para medir la latencia y la amplitud del potencial de acción compuesto en otra ubicación a lo largo del nervio. Los resultados deben interpretarse en combinación con los hallazgos y las pruebas clínicas (p. ej., electromiografía) pero, lo que es más importante, las diferentes enfermedades exhiben diferentes patrones de cambios electroneurográficos. Esto es importante no solo para fines de diagnóstico, sino que también puede indicar cambios patológicos específicos en la función del axón que, a su vez, podrían ayudar a guiar la elección de la terapia (si se entendiera la patobiología del axón; ver más abajo). Mediante el seguimiento del umbral, se midió la excitabilidad en humanos para varias enfermedades desmielinizantes periféricas, incluida la enfermedad de Charcot-Marie-Tooth tipo 1A (CMT1A), la polineuropatía desmielinizante inflamatoria crónica (CIDP), el síndrome de Guillain-Barré (GBS) y la neuropatía motora multifocal (MMN).<ref name=":4">Bostock H., Baker M., Reid G. Changes in excitability of human motor axons underlying post-ischaemic fasciculations: Evidence for two stable states. J. Physiol. 1991;441:537–557. doi: 10.1113/jphysiol.1991.sp018766.[PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>Mogyoros I., Kiernan M.C., Burke D., Bostock H. Strength-duration properties of sensory and motor axons in amyotrophic lateral sclerosis. Brain. 1998;121:851–859. doi: 10.1093/brain/121.5.851. [PubMed] [CrossRef] [Google Scholar]</ref><ref name=":5">Kiernan M.C., Burke D., Andersen K.V., Bostock H. Multiple measures of axonal excitability: A new approach in clinical testing. Muscle Nerve. 2000;23:399–409. doi: 10.1002/(SICI)1097-4598(200003)23:3<399::AID-MUS12>3.0.CO;2-G. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Cappelen-Smith C., Kuwabara S., Lin C.S., Mogyoros I., Burke D. Membrane properties in chronic inflammatory demyelinating polyneuropathy. Brain. 2001;124:2439–2447. doi: 10.1093/brain/124.12.2439. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Kuwabara S., Ogawara K., Sung J.Y., Mori M., Kanai K., Hattori T., Yuki N., MLin C.S., Burke D., Bostock H. Differences in membrane properties of axonal and demyelinating Guillain-Barré syndromes. Ann. Neurol. 2002;52:180–187. doi: 10.1002/ana.10275. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Nodera H., Bostock H., Kuwabara S., Sakamoto T., Asanuma K., Jia-Ying S., Ogawara K., Hattori N., Hirayama M., Sobue G., et al. Nerve excitability properties in Charcot-Marie-Tooth disease type 1A. Brain. 2004;127:203–211. doi: 10.1093/brain/awh020. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Sung M.H., Simon R. In silico simulation of inhibitor drug effects on nuclear factor-κB pathway dynamics. Mol. Pharmacol. 2004;66:70–75. doi: 10.1124/mol.66.1.70. [PubMed] [CrossRef] [Google Scholar]</ref> El desafío radica en interpretar esas observaciones. Para ello, el grupo de Stephanova ha simulado progresivamente mayores grados de desmielinización sistemática y focal de las fibras motoras para intentar explicar los cambios fisiológicos observados<ref>Stephanova D.I., Daskalova M. Differences in potentials and excitability properties in simulated cases of demyelinating neuropathies. Part III. Paranodal internodal demyelination. Clin. Neurophysiol. 2005;116:2334–2341. doi: 10.1016/j.clinph.2005.07.013. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Stephanova D.I., Daskalova M.S. Differences between the channels, currents and mechanisms of conduction slowing/block and accommodative processes in simulated cases of focal demyelinating neuropathies. Eur. Biophys. J. 2008;37:829–842. doi: 10.1007/s00249-008-0284-1. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Stephanova D.I., Alexandrov A.S. Simulating mild systematic and focal demyelinating neuropathies: Membrane property abnormalities. J. Integr. Neurosci. 2006;5:595–623. doi: 10.1142/S0219635206001331. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Stephanova D.I., Daskalova M., Alexandrov A.S. Channels, currents and mechanisms of accommodative processes in simulated cases of systematic demyelinating neuropathies. Brain Res. 2007;1171:138–151. doi: 10.1016/j.brainres.2007.07.029. [PubMed] [CrossRef] [Google Scholar]</ref><ref name=":6">Stephanova D.I., Krustev S.M., Negrev N., Daskalova M. The myelin sheath aqueous layers improve the membrane properties of simulated chronic demyelinating neuropathies. J. Integr. Neurosci. 2011;10:105–120. doi: 10.1142/S0219635211002646. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Stephanova D.I., Alexandrov A.S., Kossev A., Christova L. Simulating focal demyelinating neuropathies: Membrane property abnormalities. Biol. Cybern. 2007;96:195–208. doi: 10.1007/s00422-006-0113-5. [PubMed] [CrossRef] [Google Scholar]</ref> (ver la sección Modelado a continuación). | |||
=== Participación de los cuerpos celulares === | |||
La progresión de la EM remitente-recurrente (EMRR) a la EM progresiva secundaria (SPMS) se asocia con una mayor afectación de la patología de la materia gris, aunque la afectación axonal/de la materia gris ya se puede observar en las primeras etapas de la enfermedad.<ref>Bø L., Geurts J.J., Mörk S.J., van der Valk P. Grey matter pathology in multiple sclerosis. Acta Neurol. Scand. Suppl. 2006;183:48–50. doi: 10.1111/j.1600-0404.2006.00615.x. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Geurts J.J., Barkhof F. Grey matter pathology in multiple sclerosis. Lancet Neurol. 2008;7:841–851. doi: 10.1016/S1474-4422(08)70191-1. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Zivadinov R., Pirko I. Advances in understanding gray matter pathology in multiple sclerosis: Are we ready to redefine disease pathogenesis? BMC Neurol. 2012;12 doi: 10.1186/1471-2377-12-9. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>Popescu B.F., Lucchinetti C.F. Pathology of demyelinating diseases. Annu. Rev. Pathol. 2012;7:185–217. doi: 10.1146/annurev-pathol-011811-132443.[PubMed] [CrossRef] [Google Scholar]</ref> El daño a la sustancia gris se considera el mecanismo subyacente de la progresión de la enfermedad y la discapacidad permanente en los pacientes con EM, y se mide por la pérdida de la fracción parenquimatosa cerebral o el volumen cerebral por resonancia magnética o clínicamente por la progresión en la escala expandida del estado de discapacidad (EDSS).<ref>Kurtzke J.F., Beebe G.W., Nagler B., Nefzger M.D., Auth T.L., Kurland L.T. Studies on the natural history of multiple sclerosis: V. Long-term survival in young men. Arch. Neurol. 1970;22:215–225. doi: 10.1001/archneur.1970.00480210025003. [PubMed] [CrossRef] [Google Scholar]</ref> La transición de RRMS a SPMS es un presagio por la falta de terapias para combatir el deterioro físico y cognitivo exacerbado que enfrentan la mayoría de los pacientes con SPMS.<ref name=":0" /><ref>Rao S.M., Leo G.J., Bernardin L., Unverzagt F. Cognitive dysfunction in multiple sclerosis. I. Frequency, patterns, and prediction. Neurology. 1991;41:685–691. doi: 10.1212/WNL.41.5.685. [PubMed] [CrossRef] [Google Scholar]</ref> | |||
==== Tratamiento ==== | |||
Las principales intervenciones para la EM implican la modulación de la respuesta inmunitaria con, por ejemplo, metilprednisolona, interferón beta, acetato de glatiramer o fingolimod, o evitando que las células inflamatorias crucen la BHE (anticuerpos monoclonales, p. ej., Tysabri (anti α4-integrina, Natalizumab )). Muy recientemente, los dos primeros agentes orales (fumarato y teriflunomida), así como el anticuerpo dirigido anti-CD52 Natalizumab, fueron aprobados para el tratamiento de la EMRR, que puede tratarse con éxito con terapias de primera línea como interferones, acetato de glatiramer o fingolimod, o con terapias de segunda línea, pero las formas progresivas (PPMS, SPMS) aún representan una necesidad biomédica no cubierta.<ref>Meuth S.G., Bittner S., Ulzheimer J.C., Kleinschnitz C., Kieseier B.C., Wiendl H. Therapeutic approaches to multiple sclerosis: An update on failed, interrupted, or inconclusive trials of neuroprotective and alternative treatment strategies. BioDrugs. 2010;24:317–330. doi: 10.2165/11537190-000000000-00000. [PubMed] [CrossRef] [Google Scholar]</ref> Los antineoplásicos se utilizan en casos extremadamente avanzados o difíciles.<ref>Goldenberg M.M. Multiple sclerosis review. Pharm. Ther. 2012;37:137–139.[PMC free article] [PubMed] [Google Scholar]</ref> | |||
Los medicamentos modificadores de la enfermedad son fundamentales para detener o al menos atenuar el proceso de desmielinización, pero también lo es controlar los síntomas que surgen de cualquier desmielinización que ya haya ocurrido. La modulación de canales iónicos es cada vez más prometedora con la llegada de nuevos bloqueadores de canales iónicos como Ampyra (bloqueo de canales K).<ref>Göbel K., Wedell J.H., Herrmann A.M., Wachsmuth L., Pankratz S., Bittner S., Budde T., Kleinschnitz C., Faber C., Wiendl H., et al. 4-Aminopyridine ameliorates mobility but not disease course in an animal model of multiple sclerosis. Exp. Neurol. 2013;248:62–71. doi: 10.1016/j.expneurol.2013.05.016.[PubMed] [CrossRef] [Google Scholar]</ref><ref>Krishnan A.V., Kiernan M.C. Sustained-release fampridine and the role of ion channel dysfunction in multiple sclerosis. Mult. Scler. 2013;19:385–391. doi: 10.1177/1352458512463769. [PubMed] [CrossRef] [Google Scholar]</ref> El bloqueo de los canales de potasio está destinado a mejorar la excitabilidad de los axones. El problema es que tales intervenciones, si bien son efectivas para tratar los síntomas negativos y restaurar la función, tienden a exacerbar los síntomas positivos.<ref>Bowe C.M., Kocsis J.D., Targ E.F., Waxman S.G. Physiological effects of 4-aminopyridine on demyelinated mammalian motor and sensory fibers. Ann. Neurol. 1987;22:264–268. doi: 10.1002/ana.410220212. [PubMed] [CrossRef] [Google Scholar]</ref>Por el contrario, el tratamiento de los síntomas positivos, como los espasmos, con antiepilépticos como la carbamazepina, por ejemplo, puede exacerbar los síntomas negativos..<ref>Sakurai M., Kanazawa I. Positive symptoms in multiple sclerosis: Their treatment with sodium channel blockers, lidocaine and mexiletine. J. Neurol. Sci. 1999;162:162–168. doi: 10.1016/S0022-510X(98)00322-0. [PubMed] </ref> De hecho, el bloqueo de los canales de Na+ no solo reduce los síntomas positivos, sino que también puede ser neuroprotector (porque la acumulación de Na+ hace que los mecanismos de intercambio de Na+/Ca2+ carguen las neuronas con Ca2+, que es excitotóxico)<ref>Mattson M.P., Guthrie P.B., Kater S.B. A role for Na+-dependent Ca2+extrusion in protection against neuronal excitotoxicity. FASEB J. 1989;3:2519–2526. [PubMed] [Google Scholar]</ref> (Figura 3), pero estos beneficios se obtienen a expensas de los síntomas negativos. Por lo tanto, y especialmente en un paciente que presenta una mezcla de síntomas positivos y negativos, las opciones de tratamiento son restringidas. | |||
[[File:Jay S. Coggan 3.jpeg|center|thumb|600x600px|Mecanismos de la neurodegeneración relacionada con la desmielinización. La desmielinización puede resultar progresivamente en desequilibrios iónicos, crisis energética, bloqueo de conducción y eventualmente neurodegeneración. '''(A''') un nódulo normal de Ranvier con regiones yuxtaparanodal, paranodal y ganglionar intactas, que representa <math>Na^+,K^+,Ca^+</math>iones que fluyen a través de sus respectivos canales con mitocondrias que suministran ATP para energía dependiente <math>Na^+,K^+ ATP</math>ases que restablecen los gradientes de iones agotados por el flujo de iones a través de los canales. Numerosos canales iónicos diferentes están presentes en el axón, pero aquí solo se representa un pequeño subconjunto; ('''B''') la desmielinización parcial da como resultado la dispersión de los canales iónicos nodales, la insuficiencia energética y los desequilibrios de los gradientes iónicos; ('''C''') la desmielinización completa puede resultar en bloqueo de conducción y degeneración axonal debido a la acumulación de intracelular <math>Ca^+</math>que resulta de la crisis energética y la interrupción de los equilibrios iónicos. Abreviaturas: <math>K_v1</math>: canal de potasio tipo 1;; <math>Na_{v}1.6</math> and <math>Na_{v}1.2</math>: canales de sodio tipos 1.6 y 1.2;; <math>Na^+,Ca^+</math> Intercambiador: <math>Na^+,Ca^+</math> cambio de bomba; <math>Na^+,K^+ ATP</math>asa: dependiente de ATP (energía)<math>Na^+,K^+</math> cambio de bomba; CASPR1: proteína asociada a contactina 1 (molécula de interacción entre célula mielinizante con axón); <math>NF55</math>: neurofascina 155 (molécula de interacción predominante entre la mielina y el axón en la unión axoglial paranodal).]] | |||
La discusión anterior plantea el punto importante de que, aunque se ha hablado mucho sobre los mecanismos inmunitarios, su conexión con los cambios clínicos es en gran parte correlacional. Se deben considerar los efectos intermedios sobre la función axonal, es decir, los cambios primarios y secundarios (compensatorios) en la excitabilidad del axón, para apreciar cómo se altera la función neurológica. Esos cambios no son consecuencias simples y directas de la desmielinización sino que, en cambio, sugieren que la fisiología axonal misma cambia en respuesta a la desmielinización. Algunos de esos cambios son adaptativos mientras que otros son desadaptativos, o quizás los cambios adaptativos pueden volverse desadaptativos a medida que evoluciona la situación (estado de mielinización). Si los cambios en la fisiología axonal dictan la manifestación de varios síntomas, entonces el manejo de los síntomas recaerá en gran medida en los tratamientos que tienen como objetivo manipular la fisiología del axón. El desarrollo estratégico de tales tratamientos requiere una comprensión profunda y mecánica de la excitabilidad axonal y su regulación. | |||
=== Patobiología del axón === | |||
==== Cambios Estructurales y Moleculares ==== | |||
Los axones se ven profundamente afectados por la desmielinización. La morfología del axón se vuelve irregular o hinchada, a menudo con una apariencia de cuentas. También se observa acumulación focal de proteínas (por transporte axonal rápido). En las placas activas crónicas, la pérdida axonal del 20% al 80% es evidente dentro de la sustancia blanca periplaca y la sustancia blanca distante normal.<ref>Moll N.M., Rietsch A.M., Thomas S., Ransohoff A.J., Lee J.C., Fox R., Chang A., Ransohoff R.M., Fisher E. Multiple sclerosis normal-appearing white matter: Pathology-imagig correlations. Ann. Neurol. 2011;70:764–773. doi: 10.1002/ana.22521. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> En las placas activas tempranas y activas crónicas, se cree que el daño es causado por factores inflamatorios e inmunitarios liberados durante la desmielinización inflamatoria aguda. Los mediadores propuestos incluyen proteasas, citoquinas, excitotoxinas y radicales libres. Los antígenos neuronales son objetivos de la reacción inmunitaria que conduce a la inflamación del SNC. Otros factores que causan disfunción axonal o muerte incluyen la falta de apoyo trófico de la mielina y los oligodendrocitos, el daño de los factores inmunes solubles o celulares que aún están presentes en la placa inactiva y la falla mitocondrial crónica en el contexto de una mayor demanda de energía..<ref name=":7">Lucchinetti C., Brück W., Parisi J., Scheithauer B., Rodriguez M., Lassmann H. Heterogeneity of multiple sclerosis lesions: Implications for the pathogenesis of demyelination. Ann. Neurol. 2000;47:707–717. doi: 10.1002/1531-8249(200006)47:6<707::AID-ANA3>3.0.CO;2-Q. [PubMed] [CrossRef] [Google Scholar]</ref> También se ha atribuido un papel crítico para los oligodendrocitos y las células de Schwann en la supervivencia del axón a los peroxisomas, el metabolismo de los lípidos y la desintoxicación de especies reactivas de oxígeno (ROS)..<ref>Kassmann C.M., Nave K.A. Oligodendroglial impact on axonal function and survival— A hypothesis. Curr. Opin. Neurol. 2008;21:235–241. doi: 10.1097/WCO.0b013e328300c71f. [PubMed] [CrossRef] [Google Scholar]</ref> | |||
La remielinización a menudo se observa como placas de sombra formadas por el reclutamiento de precursores de oligodendrocitos indiferenciados que migran hacia las lesiones y las rodean, lo que permite capas delgadas de remielinización..<ref>Scolding N., Franklin R. Axon loss in multiple sclerosis. Lancet. 1998;352:340–341. doi: 10.1016/S0140-6736(05)60463-1. [PubMed] [CrossRef] [Google Scholar]</ref>Este proceso ocurre principalmente en placas activas agudas, pero también en fases crónicas. Esta observación desencadenó el desarrollo de un nuevo anticuerpo monoclonal dirigido contra LINGO-1 (Anti-LINGO-1). La unión de LINGO-1 a los receptores Nogo previene los procesos de remielinización en el SNC; la inhibición de esta interacción permite una remielinización significativa en animales con encefalomielitis autoinmune experimental.<ref>Mi S., Miller R.H., Lee X., Scott M.L., Shulag-Morskaya S., Shao Z., Chang J., Thill G., Levesque M., Zhang M., et al. LINGO-1 negatively regulates myelination by oligodendrocytes. Nat. Neurosci. 2005;8:745–751. doi: 10.1038/nn1460. [PubMed] [CrossRef] [Google Scholar]</ref> | |||
Durante el proceso de la enfermedad, los linfocitos y macrófagos autorreactivos pueden cruzar la barrera hematoencefálica y acumularse en el cerebro y la médula espinal..<ref>Bittner S., Ruck T., Schuhmann M.K., Herrmann A.M., Maati H.M., Bobak N., Göbel K., Langhauser F., Stegner D., Ehling P., et al. 2013 Endothelial TWIK-related potassium channel-1 (TREK1) regulates immune-cell trafficking into the CNS. Nat. Med. 2013;19:1161–1165. doi: 10.1038/nm.3303. [PubMed] </ref>Los linfocitos reguladores (Treg) no logran suprimir las células efectoras, en su mayoría células CD8+ citotóxicas.<ref>Viglietta V., Baecher-Allan C., Weiner H.L., Hafler D.A. Loss of functional suppression by CD4+CD25+ regulatory T cells in patients with multiple sclerosis. J. Exp. Med. 2004;199:971–999. doi: 10.1084/jem.20031579.[PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> La liberación de citocinas proinflamatorias recluta microglía ingenua, que se pone en contacto con una unidad de oligodendrocitos-mielina mediante interacciones con Fc y receptores del complemento. A continuación, se transmite una señal desencadenante de muerte citotóxica a través del factor de necrosis tumoral α (TNFα) unido a la superficie..<ref>Zajicek J.P., Wing M., Scolding N.J., Compston D.A. Interactions between oligodendrocytes and microglia. A major role for complement and tumour necrosis factor in oligodendrocyte adherence and killing. Brain. 1992;115:1611–1631. [PubMed] [Google Scholar]</ref>Esto ocurre junto con un extenso daño axonal..<ref name=":1" /> | |||
Lucchinetti el al.<ref name=":7" /> propusieron cuatro inmunopatrones distintos de formación de placas que se encuentran en pacientes en diferentes etapas de la enfermedad. Las placas de tipo I y II están dominadas por inflamación de linfocitos T y macrófagos y se cree que imitan los modelos de encefalomielitis autoinmune de células T o de células T más anticuerpos, respectivamente. La pérdida de mielina en las placas de tipo I puede deberse a factores tóxicos liberados por los macrófagos activados, mientras que el depósito de IgG y complemento sugiere un papel de los anticuerpos en las placas de tipo II. Por el contrario, los patrones III y IV muestran distrofia de oligodendrocitos grandes. Se cree que el patrón III está relacionado con lesiones inducidas por hipoxia que son impulsadas por defectos en la función mitocondrial,<ref name=":8">Nikić I., Merkler D., Sorbara C., Brinkoetter M., Kreutzfeldt M., Bareyre F.M., Brück W., Bishop D., Misgeld T., Kerschensteiner M. A reversible form of axon damage in experimental autoimmune encephalomyelitis and multiple sclerosis. Nat. Med. 2011;17:495–499. doi: 10.1038/nm.2324. [PubMed] [CrossRef] [Google Scholar]</ref> mientras que las lesiones de patrón IV se asocian con una muerte profunda no apoptótica de los oligodendrocitos en la sustancia blanca periplaca. | |||
Barnett y Prineas<ref>Barnett M.H., Prineas J.W. Relapsing and remitting multiple sclerosis: Pathology of the newly forming lesion. Ann. Neurol. 2004;55:458–468. doi: 10.1002/ana.20016. [PubMed] [CrossRef] [Google Scholar]</ref> analizó las lesiones de los pacientes directamente después del inicio de una recaída, durante la cual estaba en curso la formación activa de placa. Sus resultados sugieren que la apoptosis de los oligodendrocitos y la activación glial ocurren durante la formación activa temprana de la placa en ausencia de linfocitos inflamatorios o fagocitos de mielina. Propusieron que la vulnerabilidad de los oligodendrocitos, descrita en el patrón de tipo III de Lucchinetti, está presente en las primeras etapas de toda formación de placa y es el desencadenante de la necrosis postapoptótica posterior que inicia la fagocitosis de mielina por parte de los macrófagos en etapas posteriores. Los análisis in vitro de este proceso han implicado cascadas del complemento, factores de necrosis tumoral o segundos mensajeros gaseosos..<ref>Van der Laan L.J., Ruuls S.R., Weber K.S., Lodder I.J., Döpp E.A., Dijkstra C.D. Macrophage phagocytosis of myelin ''in vitro'' determined by flow cytometry: Phagocytosis is mediated by CR3 and induces production of tumor necrosis factor-α and nitric oxide. J. Neuroimmunol. 1996;70:145–152. doi: 10.1016/S0165-5728(96)00110-5. [PubMed] [CrossRef] [Google Scholar]</ref> Aunque la identificación de las placas y el seguimiento de su progreso tienen un valor clínico importante, solo hay una correlación modesta entre la carga de lesiones desmielinizantes determinada por resonancia magnética convencional y la discapacidad clínica de los pacientes con EM (véase antes). | |||
==== Cambios Funcionales ==== | |||
Los mecanismos de deterioro funcional durante la desmielinización a menudo incluyen la interrupción de los iones transmembrana Na+, K+ y Ca2+, la dispersión de sus canales iónicos correspondientes, una disminución en la eficiencia de la conducción de AP y la crisis metabólica resultante (Figura 3). La desmielinización puede explicar fácilmente la falla de conducción dentro del axón afectado. Si la conducción no falla por completo, la velocidad de conducción puede, sin embargo, reducirse y la ralentización diferencial entre diferentes axones puede causar retrasos variables en la conducción que dan como resultado picos desincronizados. | |||
La desmielinización también permite que los axones denudados se yupen estrechamente, preparando así el escenario para las interacciones efápticas y la diafonía..<ref name=":1" /> La reflexión también puede ocurrir debido a un desajuste de impedancia entre las longitudes de axón mielinizado y no mielinizado. Por otra parte, la hiperexcitabilidad no puede atribuirse directamente a la desmielinización; en cambio, se deben invocar cambios secundarios en la excitabilidad intrínseca para explicar fenómenos como la generación de picos ectópicos y la posdescarga (AD). Las alteraciones en la excitabilidad probablemente representen cambios compensatorios destinados a restaurar la función después de la interrupción causada directamente por la desmielinización, de acuerdo con un proceso denominado plasticidad homeostática.,<ref>Wang G., Thompson S.M. Maladaptive homeostatic plasticity in a rodent model of central pain syndrome: Thalamic hyperexcitability after spinothalamic tract lesions. J. Neurosci. 2008;28:11959–11969. doi: 10.1523/JNEUROSCI.3296-08.2008. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref>pero esa compensación evidentemente puede ser desadaptativa. Cada uno de los desenlaces antes mencionados, que no son excluyentes entre sí, contribuyen a producir diferentes síntomas observados en las enfermedades desmielinizantes. | |||
= | Los síntomas paroxísticos caracterizados por el inicio repentino o la intensificación de síntomas como espasmos o dolor punzante probablemente surgen de la EA o de otro tipo de picos inapropiados de tipo ráfaga. Tales patrones de picos sugieren interacciones altamente no lineales entre las corrientes de iones contribuyentes.<ref name=":9">Coggan J.S., Prescott S.A., Bartol T.M., Sejnowski T.J. Imbalance of ionic conductances contributes to diverse symptoms of demyelination. Proc. Natl. Acad. Sci. USA. 2010;107:20602–20609. doi: 10.1073/pnas.1013798107.[PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref name=":10">Coggan J.S., Ocker G.K., Sejnowski T.J., Prescott S.A. Explaining pathological changes in axonal excitability through dynamical analysis of conductance-based models. J. Neural Eng. 2011;8 doi: 10.1088/1741-2560/8/6/065002. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> y podría, al menos en teoría, involucrar interacciones entre diferentes regiones de la neurona.<ref name=":11">Coggan J.S., Prescott S.A., Sejnowski T.J. Cooperativity between remote sites of ectopic spiking allows afterdischarge to be initiated and maintained at different locations. J. Comput. Neurosci. 2015;39:17–28. doi: 10.1007/s10827-015-0562-8. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> A diferencia de las formas más genéricas de hiperexcitabilidad (p. ej., aumento de la tasa de activación o reducción del umbral), estos patrones específicos están limitados en cuanto a los mecanismos precisos a través de los cuales pueden surgir. Por lo tanto, identificar los cambios en los canales iónicos que subyacen a esas formas específicas de hiperexcitabilidad puede ayudar a restringir la búsqueda de cambios en los canales iónicos responsables de formas asociadas, aunque menos distintivas, de hiperexcitabilidad. | ||
La interrupción del equilibrio energético en una neurona también podría tener un impacto profundo en el bienestar de las neuronas (Figura 3). De hecho, los cambios compensatorios pueden lograr restaurar ciertas funciones pero, sin revertir el problema principal, pueden surgir otros problemas. Por ejemplo, incluso si el bloqueo de conducción se evita mediante un cambio compensatorio apropiado en la excitabilidad (es decir, uno que no resulte en hiperexcitabilidad), el sistema puede ser menos eficiente energéticamente. La pérdida de los ahorros de energía que ofrece la conducción saltatoria induce la producción de energía mitocondrial compensatoria que puede provocar daño oxidativo y neurodegeneración.<ref name=":8" /><ref name=":12">Aon M.A., Cortassa S., Akar F.G., Brown D.A., Zhou L., O’Rourke B. From mitochondrial dynamics to arrhythmias. Int. J. Biochem. Cell Biol. 2009;41:1940–1948. doi: 10.1016/j.biocel.2009.02.016. [PMC free article][PubMed] [CrossRef] [Google Scholar]</ref><ref name=":13">Su K., Bourdette D., Forte M. Mitochondrial dysfunction and neurodegeneration in multiple sclerosis. Front. Physiol. 2013;4doi: 10.3389/fphys.2013.00169. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> | |||
Hacer un seguimiento de esta larga lista de cambios neurobiológicos, comprender las interrelaciones entre esos cambios y, en última instancia, vincular esos cambios con las manifestaciones clínicas y aplicar un tratamiento eficaz no es una tarea fácil. Para este fin, el modelado computacional es una herramienta invaluable. Las simulaciones no solo sirven para organizar la información que ya se conoce, sino que también identifican lagunas cruciales en el conocimiento. Por lo tanto, el uso juicioso del modelado computacional puede permitir una comprensión más integral y facilitar la aplicación más efectiva de esa comprensión, como se analiza a continuación. | |||
=== Modelado Computacional === | |||
Especialmente cuando se combina con experimentos tradicionales, el modelado computacional es indispensable para dar sentido a datos inconsistentes y mecanismos complejos. Estos beneficios se ejemplifican con la aplicación de simulaciones en otros campos, como la epilepsia..<ref>Soltesz I., Staley K. Computational Neuroscience in Epilepsy. 1st ed. Elsevier; London, UK: 2008. [Google Scholar]</ref>Aquí analizamos parte de la historia del modelado computacional de axones, conductancias iónicas, la fisiología de la mielina y la desmielinización, el sistema inmunitario, las mitocondrias y otros factores biológicos que son fundamentales para comprender las enfermedades desmielinizantes. Nuestra revisión no es exhaustiva, pero proporcionará una amplia introducción a los esfuerzos pasados, presentes y futuros en esta área. | |||
==== Modelado de axones ==== | |||
El modelado computacional de axones ha evolucionado taxonómicamente, desde tejidos de calamar hasta tejidos de mamíferos con el correspondiente aumento de sofisticación. El modelo de Hodgkin y Huxley (HH), que proporcionó la primera explicación completa de la generación de AP, se derivó de experimentos en axones gigantes no mielinizados de calamar,<ref>Hodgkin A.L., Huxley A.F. The components of membrane conductance in the giant axon of ''Loligo''. J. Physiol. 1952;116:473–496. doi: 10.1113/jphysiol.1952.sp004718. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>Hodgkin A.L., Huxley A.F. Currents carried by sodium and potassium ions through the membrane of the giant axon of ''Loligo''. J. Physiol. 1952;116:449–472. doi: 10.1113/jphysiol.1952.sp004717. [PMC free article] [PubMed] </ref>pero este modelo temprano ha demostrado ser una herramienta invaluable a partir de la cual han evolucionado modelos más sofisticados de axones mielinizados. | |||
La heterogeneidad espacial y biofísica conferida por la adición de mielina, y la consiguiente formación de nódulos y regiones internodales, representa un aumento significativo en la complejidad del axón. El primer modelo computacional de un axón mielinizado fue un modelo unidimensional que colapsó la vaina de mielina en el axolema pasivo subyacente, utilizó un tamaño de paso espacial uniforme para formar la aproximación discreta utilizada en la solución numérica y empleó una caracterización HH de la membrana nodal..<ref>Fitzhugh R. Computation of impulse initiation and saltatory conduction in a myelinated nerve fiber. Biophys. J. 1962;2:11–21. doi: 10.1016/S0006-3495(62)86837-4. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> Goldman & Albus<ref>Goldman L., Albus J.S. Computation of impulse conduction in myelinated fibers; theoretical basis of the velocity-diameter relation. Biophys. J. 1968;8:596–607. doi: 10.1016/S0006-3495(68)86510-5. [PMC free article][PubMed] [CrossRef] [Google Scholar]</ref> modificó este modelo para incluir una descripción de la membrana nodal derivada de datos experimentales sobre fibras nerviosas mielinizadas de Xenopus laevis según lo determinado por Frankenhaeuser y Huxley.<ref>Frankenhaeuser B., Huxley A.F. The action potential in the myelinated nerve fiber of ''Xenopus'' ''laevis'' as computed on the basis of voltage clamp data. J. Physiol. 1964;171:302–315. doi: 10.1113/jphysiol.1964.sp007378.[PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref>Estudios posteriores han utilizado la misma forma básica para el modelo con algunas variaciones para la representación del axolema..<ref name=":2" /><ref>Smith R.S., Koles Z.J. Myelinated nerve fibers: Computed effect of myelin thickness on conduction velocity. Am. J. Physiol. 1970;219:1256–1258.[PubMed] [Google Scholar]</ref><ref>Hutchinson N.A., Koles Z.J., Smith R.S. Conduction velocity in myelinated nerve fibres of ''Xenopus'' ''laevis''. J. Physiol. 1970;208:279–289. doi: 10.1113/jphysiol.1970.sp009119. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>Koles Z.J., Rasminsky M. A computer simulation of conduction in demyelinated nerve fibres. J. Physiol. 1972;227:351–364. doi: 10.1113/jphysiol.1972.sp010036. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>Hardy W.L. Propagation speed in myelinated nerve. II. Theoretical dependence on external Na and on temperature. Biophys. J. 1973;13:1071–1089. doi: 10.1016/S0006-3495(73)86046-1. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>Schauf C.L., Davis F.A. Impulse conduction in multiple sclerosis: A theoretical basis for modification by temperature and pharmacological agents. J. Neurol. Neurosurg. Psychiatry. 1974;37:152–161. doi: 10.1136/jnnp.37.2.152.[PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>Brill M.H., Waxman S.G., Moore J.W., Joyner R.W. Conduction velocity and spike configuration in myelinated fibres: Computed dependence on internode distance. J. Neurol. Neurosurg. Psychiatry. 1977;40:769–774. doi: 10.1136/jnnp.40.8.769. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>Waxman S.G., Brill M.H. Conduction through demyelinated plaques in multiple sclerosis: Computer simulations of facilitation by short internodes. J. Neurol. Neurosurg. Psychiatry. 1978;41:408–416. doi: 10.1136/jnnp.41.5.408.[PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>Wood S.L., Waxman S.G., Kocsis J.D. Conduction of trans of impulses in uniform myelinated fibers: Computed dependence on stimulus frequency. Neuroscience. 1982;7:423–430. doi: 10.1016/0306-4522(82)90276-7. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Goldfinger M.D. Computation of high safety factor impulse propagation at axonal branch points. Neuroreport. 2000;11:449–456. doi: 10.1097/00001756-200002280-00005. [PubMed] [CrossRef] [Google Scholar]</ref> El modelo de cable único, que describe el axón y todas sus propiedades de conductancia y capacitancia en una ecuación de cable, ha dominado el campo hasta el día de hoy a pesar de la introducción de modelos de cable doble por Blight..<ref name=":14">Blight A.R. Computer simulation of action potentials and afterpotentials in mammalian myelinated axons: The case for a lower resistance myelin sheath. Neuroscience. 1985;15:13–31. doi: 10.1016/0306-4522(85)90119-8. [PubMed] [CrossRef] [Google Scholar]</ref>En los modelos de doble cable, el axolema internodal y la vaina de mielina se representan de forma independiente. El modelo de doble cable ha sido ampliado por Halter y Clark<ref name=":15">Halter J.A., Clark J.W., Jr. A distributed-parameter model of the myelinated nerve fiber. J. Theor. Biol. 1991;148:345–382. doi: 10.1016/S0022-5193(05)80242-5. [PubMed] [CrossRef] [Google Scholar]</ref> para explorar los efectos de la geometría compleja de los oligodendrocitos del SNC (o células de Schwann en el caso del SNP). | |||
Los modelos más nuevos también han mejorado las simplificaciones anteriores, incluida la complejidad anatómica del nódulo de Ranvier, la distribución de los canales iónicos en el axón debajo de la vaina de mielina, las diferentes propiedades eléctricas de la vaina de mielina y el axolema, y la acomodación del posible flujo de corriente dentro el espacio periaxonal.<ref name=":15" /><ref>Schwarz J.R., Eikhof G. Na currents and action potentials in rat myelinated nerve fibres at 20 and 37 °C. Pflugers Arch. 1987;409:569–577. doi: 10.1007/BF00584655. [PubMed] [CrossRef] [Google Scholar]</ref><ref name=":16">Stephanova D.I. Myelin as longitudinal conductor: A multi-layered model of the myelinated human motor nerve fibre. Biol. Cybern. 2001;84:301–308. doi: 10.1007/s004220000213. [PubMed] [CrossRef] [Google Scholar]</ref><ref name=":17">McIntyre C.C., Richardson A.G., Grill W.M. Modeling the excitability of mammalian nerve fibers: Influence of afterpotentials on the recovery cycle. J. Neurophysiol. 2002;87:995–1006. [PubMed] [Google Scholar]</ref><ref name=":18">Einziger P.D., Livshitz L.M., Mizrahi J. Generalized cable equation model for myelinated nerve fiber. IEEE Trans. Biomed. Eng. 2005;52:1632–1642. doi: 10.1109/TBME.2005.856031. [PubMed] [CrossRef] [Google Scholar]</ref> Las representaciones anatómicas del área paranodal han permitido una evaluación más detallada de los efectos de la lesión cerebral traumática (TBI) en los axones mielinizados..<ref>Volman V., Ng L. Primary paranode demyelination modulates slowly developing axonal depolarization in a model of axonal injury. J. Neural Comput. 2014;37:439–457. [PubMed] [Google Scholar]</ref> Uno de los modelos anatómicamente más sofisticados incluye la representación de la compleja estructura de la vaina acuosa de las laminillas de mielina como una serie de laminillas paralelas interconectadas en un modelo de nervios motores..<ref name=":6" /><ref name=":16" /> | |||
Los modelos más nuevos también han considerado la distribución no uniforme de los canales iónicos en todo el axón [19,84,85,86,87,88,89,90].<ref name=":4" /><ref>Stephanova D.I., Bostock H. A Distributed-parameter model of the myelinated human motor nerve fibre: Temporal and spatial distributions of action potentials and ionic currents. Biol. Cybern. 1995;73:275–280. doi: 10.1007/BF00201429. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Chiu S.Y., Ritchie J.M. On the physiological role of internodal potassium channels and the security of conduction in myelinated nerve fibres. Proc. R. Soc. Lond. B Biol. Sci. 1984;220:415–422. doi: 10.1098/rspb.1984.0010.[PubMed] [CrossRef] [Google Scholar]</ref><ref>Brismar T., Schwarz J.R. Potassium permeability in rat myelinated nerve fibres. Acta Physiol. Scand. 1985;124:141–148. doi: 10.1111/j.1748-1716.1985.tb07645.x. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Chiu S.Y., Schwarz W. Sodium and potassium currents in acutely demyelinated internodes of rabbit sciatic nerves. J. Physiol. 1987;391:631–649. doi: 10.1113/jphysiol.1987.sp016760. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>Baker M., Bostock H., Grafe P., Martius P. Function and distribution of three types of rectifying channel in rat spinal root myelinated axons. J. Physiol. 1987;383:45–67. [PMC free article] [PubMed] [Google Scholar</ref><ref>Röper J., Schwarz J.R. Heterogeneous distribution of fast and slow potassium channels in myelinated rat nerve fibres. J. Physiol. 1989;416:93–110. doi: 10.1113/jphysiol.1989.sp017751. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>Bittner S., Meuth S.G. Targeting ion channels for the treatment of autoimmune neuroinflammation. Ther. Adv. Neurol. Disord. 2013;6:322–336. doi: 10.1177/1756285613487782. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> Más allá de los canales de iones, las bombas dependientes de energía y otros mecanismos de transporte de iones proporcionan objetivos terapéuticos importantes para una serie de trastornos neurológicos.<ref>Waxman S.G., Ritchie J.M. Molecular dissection of the myelinated axon. Ann. Neurol. 1993;33:121–136. doi: 10.1002/ana.410330202. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Bittner S., Budde T., Wiendl H., Meuth S.G. From the background to the spotlight: TASK channels in pathological conditions. Brain Pathol. 2010;20:999–1009. doi: 10.1111/j.1750-3639.2010.00407.x. [PMC free article][PubMed] [CrossRef] [Google Scholar]</ref><ref>Ehling P., Bittner S., Budde T., Wiendl H., Meuth S.G. Ion channels in autoimmune neurodegeneration. FEBS Lett. 2011;585:3836–3842. doi: 10.1016/j.febslet.2011.03.065. [PubMed] [CrossRef] [Google Scholar]</ref>En ese sentido, la regulación de los gradientes de iones transmembrana cuesta una energía significativa y en sí misma se convierte en una consideración importante (ver más abajo).<ref name=":19">Hübel N., Dahlem M.A. Dynamics from seconds to hours in Hodgkin-Huxley model with time-dependent ion concentrations and buffer reservoirs. PLoS Comput. Biol. 2014;10:e1003941. doi: 10.1371/journal.pcbi.1003941.[PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> Esto es especialmente cierto dado que el pequeño volumen de axones los hace propensos a cambios de concentración de iones que pueden impactar dramáticamente en las fuerzas impulsoras y pueden volverse problemáticos en modelos que asumen concentraciones intracelulares y extracelulares constantes. Pero los modelos recientes también se han ocupado de estos problemas (ver más abajo). | |||
Todos los modelos antes mencionados se centran en simular el cambio en el potencial de membrana del axón, pero uno no necesariamente tiene acceso experimental a esa variable, lo que por supuesto complica los esfuerzos para comparar la simulación y los datos experimentales. De hecho, dado que los registros extracelulares son la principal fuente de datos electrofisiológicos de sujetos humanos, la descripción matemática del potencial de campo extracelular es de gran interés clínico. Las evaluaciones matemáticas basadas en las ecuaciones de Laplace y las transformadas de Fourier se utilizan para calcular estos potenciales (a veces denominados modelos de fuente lineal, por ejemplo,.<ref name=":18" /><ref>Ganapathy L., Clark J.W. Extracellular currents and potentials of the active myelinated nerve fibre. Biophys. J. 1987;52:749–761. doi: 10.1016/S0006-3495(87)83269-1. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> | |||
==== Modelado de mecanismos específicos ==== | |||
Más allá de modelar la función axonal normal, los modelos se pueden usar para explorar mecanismos particulares de disfunción axonal, especialmente cuando se combinan con resultados experimentales que podrían identificar mejor los mecanismos..<ref>Prescott S.A. Pathological changes in peripheral nerve excitability. In: Jaeger D., Jung R., editors. Encyclopedia of Computational Neurosci. 1st ed. Springer-Verlag; New York, NY, USA: 2015. [Google Scholar]</ref> Por ejemplo, Barrett and Barrett<ref>Barrett E.F., Barrett J.N. Intracellular recording from vertebrate myelinated axons: Mechanism of the depolarizing afterpotential. J. Physiol. 1982;323:117–144. doi: 10.1113/jphysiol.1982.sp014064. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref>mostró que el potencial posterior despolarizante (DAP) es sensible a los cambios en las densidades de conductancia y los cambios capacitativos que pueden ocurrir durante la desmielinización. Se diseñó un modelo de Blight para la simulación de sus condiciones de grabación experimental.<ref name=":14" /><ref>Blight A.R., Someya S. Depolarizing afterpotentials in myelinated axons of mammalian spinal cord. Neuroscience. 1985;15:1–12. doi: 10.1016/0306-4522(85)90118-6. [PubMed] [CrossRef] [Google Scholar]</ref> y representa un solo entrenudo con múltiples segmentos discretos y nodos y entrenudos adyacentes en segmentos de parámetros agrupados únicos. Este modelo incluyó canales K+ en el axolema del único entrenudo multisegmentado y trata el resto como puramente pasivo. | |||
Sobre la base de este trabajo, con especial atención a los detalles anatómicos y electrofisiológicos, McIntyre et al.l.<ref name=":17" /> abordó el papel de la DAP y la poshiperpolarización (AHP) en el ciclo de recuperación: el patrón distintivo de fluctuación del umbral después de un potencial de acción único exhibido por los nervios humanos. Las simulaciones sugirieron roles distintos para los canales de Na+ y K+ activos y pasivos en ambos potenciales posteriores y propusieron que las diferencias en la forma de AP, la relación fuerza-duración y el ciclo de recuperación de las fibras nerviosas motoras y sensoriales pueden atribuirse a las diferencias cinéticas en las conductancias nodales de Na+. . Richardson y otrosl.<ref>Richardson A.G., McIntyre C.C., Grill W.M. Modelling the effects of electric fields on nerve fibres: Influence of the myelin sheath. Med. Biol. Eng. Comput. 2000;38:438–446. doi: 10.1007/BF02345014. [PubMed] [CrossRef] [Google Scholar]</ref> también encontró que la alteración del modelo estándar de "aislante perfecto" es necesaria para reproducir DAP durante la estimulación de alta frecuencia. | |||
La sensibilidad a la temperatura de los efectos de desmielinización también se ha investigado computacionalmente. Zlochiver<ref>Zlochiver S. Persistent reflection underlies ectopic activity in multiple sclerosis: A numerical study. Biol. Cybern. 2010;102:181–196. doi: 10.1007/s00422-009-0361-2. [PubMed] [CrossRef] [Google Scholar]</ref> modelaron la reflexión resonante persistente a través de una única placa de desmielinización focal y descubrieron que este efecto era sensible a la temperatura y al diámetro del axón. Todos estos ejemplos demostraron el poder de las simulaciones para examinar mecanismos específicos para explicar los fenómenos observados en la clínica y ofrecer orientación para futuras investigaciones. | |||
Como se mencionó anteriormente, es probable que los distintos cambios en la función del axón manifiesten ciertos síntomas de ganancia o pérdida de función. Si uno pudiera reproducir esos cambios en un modelo computacional, los cambios de parámetros necesarios para convertir el modelo entre operación normal y anormal podrían usarse para predecir la patología subyacente. Idealmente, esto puede conducir a experimentos específicos en los que el canal iónico sospechoso, por ejemplo, se manipula directamente para ver si su alteración aguda es suficiente para reproducir o revertir ciertos cambios patológicos. Estudios recientes del laboratorio de Prescott ilustran este proceso..<ref>Ratté S., Zhu Y., Lee K.Y., Prescott S.A. Criticality and degeneracy in injury-induced changes in primary afferent excitability and the implications for neuropathic pain. Elife. 2014;3:e02370. doi: 10.7554/eLife.02370.[PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>Zhu Y., Feng B., Schwartz E.S., Gebhart G.F., Prescott S.A. Novel method to assess axonal excitability using channelrhodopsin-based photoactivation. J. Neurophysiol. 2015;113:2242–2249. doi: 10.1152/jn.00982.2014.[PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> El éxito de estos estudios dependió de técnicas avanzadas, incluida la técnica de abrazadera dinámica, utilizada para cambiar entre patrones de picos normales y anormales y herramientas optogenéticas. El siguiente paso es vincular los cambios en la función del axón con los síntomas de la enfermedad (o sus correlatos conductuales en modelos animales). | |||
En experimentos con el nervio auditivo, Tagoe y sus colegas<ref>Tagoe T., Barker M., Jones A., Allcock N., Hamann M. Auditory nerve perinodal dysmyelination in noise-induced hearing loss. J. Neurosci. 2014;12:2684–2688. doi: 10.1523/JNEUROSCI.3977-13.2014.</ref> demostraron que la pérdida de audición relacionada con cambios morfológicos en los paranodos y yuxtaparanodos, incluida la elongación del nervio auditivo alrededor de los nodos de Ranvier, puede resultar de la exposición a ruidos fuertes. Ampliando este trabajo, Hamann y sus colegas construyeron un modelo computacional para examinar los posibles mecanismos. Su modelo sugirió que es más probable que una disminución en la densidad de los canales de Na, en lugar de una redistribución de los canales de Na o K en general, sea responsable de la inhibición de la conducción asociada con la sobreexposición acústica..<ref>Brown A.M., Hamann M. Computational modeling of the effects of auditory nerve dysmyelination. Front. Neuroanat. 2014;8doi: 10.3389/fnana.2014.00073. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> Este tándem modelo-experimento demuestra el potencial revelador de emparejar modelos computacionales con experimentos de laboratorio. | |||
Con un modelo multicapa de axón mielinizado, Stephanova y sus colegas han tenido un éxito continuo en la identificación de posibles deficiencias anatómicas y fisiológicas que subyacen a varios síntomas y afecciones relacionadas con la desmielinización al hacer comparaciones con las mediciones de seguimiento del umbral de los pacientes, incluidas las latencias, la refractariedad (el aumento del umbral corriente durante el período refractario relativo), período refractario, supernormalidad y valores de electrotono de umbral, incluidas medidas de estímulo-respuesta, como la relación actual-umbrals.<ref name=":5" />Por ejemplo, encontraron que la desmielinización sistemática internodal leve (ISD) es un indicador específico para CMT1A. La desmielinización sistemática paranodal leve (PSD) y la desmielinización sistemática paranodal (PISD) son indicadores específicos de CIPD y sus subtipos. Las desmielinizaciones focales severas, internodal y paranodal, paranodal-internodal (IFD y PFD, PIFD) son indicadores específicos de neuropatías desmielinizantes adquiridas como GBS y MMN [18] (ver Figura 1). | |||
La desmielinización sistémica leve y la focal severa corresponden a neuropatías hereditarias (CMT1A) y adquiridas (CIDP, GBS y MMN) (tabla 1). También se encontró que el 70% de la desmielinización sistemática es insuficiente para causar síntomas y el 96% es necesario para el bloqueo de conducción en un solo ganglio [18]. Por lo tanto, existe un gran factor de seguridad para la desmielinización focal. Con su versión dependiente de la temperatura del modelo de la fibra nerviosa motora humana mielinizada, Stephanova y Daskalova<ref>Stephanova D.I., Daskalova M. Electrotonic potentials in simulated chronic inflammatory demyelinating polyneuropathy at 20 °C–42 °C. J. Integr. Neurosci. 2015;27:1–18. doi: 10.1142/S0219635215500119. [PubMed] [CrossRef] [Google Scholar]</ref> demostraron que los potenciales electrotónicos en pacientes con CIDP tienen un alto riesgo de bloqueo durante la hipo e incluso hipertermia leve y sugieren mecanismos que involucran una mayor magnitud de los potenciales electrotónicos nodales polarizantes y internodales despolarizantes, el rectificador de entrada de K+ y las corrientes de K+ de fuga aumentan con la temperatura, y la la acomodación a la hiperpolarización de larga duración es mayor que a la despolarización. | |||
<center> | <center> | ||
{| class="wikitable" | {| class="wikitable" | ||
| Line 171: | Line 169: | ||
</center> | </center> | ||
==== | ==== Modelos simples y análisis dinámico no lineal ==== | ||
Dada la disociación temporal entre la manifestación de los síntomas y las tasas de desmielinización y remielinización, indudablemente ocurren procesos homeostáticos dentro de los axones, que incluyen la redistribución de canales iónicos en placas desmielinizadas..<ref>Rasminsky M. Hyperexcitability of pathologically myelinated axons and positive symptoms in multiple sclerosis. Adv. Neurol. 1981;31:289–297.[PubMed] [Google Scholar]</ref><ref>Ulrich J., Groebke-Lorenz W. The optic nerve in multiple sclerosis: A morphological study with retrospective clinicopathological correlation. Neuro-Ophthalmology. 1983;3:149–159. doi: 10.3109/01658108309009732.[CrossRef] [Google Scholar]</ref> Pero dada la diversidad de canales iónicos expresados por diferentes axones y solo un conocimiento irregular de cómo cambian los niveles de expresión, la construcción de modelos detallados para investigar esos procesos homeostáticos es problemática. Especialmente bajo esas condiciones, los modelos altamente simplificados pueden ayudar a identificar los principios fundamentales, como lo ejemplifica el uso conjunto de los modelos HH y Morris-Lecar modificados [57,58]. Los resultados de esos estudios sugirieron una explicación simple para la amplitud de los síntomas encontrados durante la desmielinización al revelar que la proporción de Na+ a la conductancia de fuga de K+, g(Na)/g(L), actuó como un interruptor de cuatro vías que controlaba los patrones de excitabilidad que incluido fallo de propagación AP, propagación AP normal, AD y picos espontáneos. | |||
Otros estudios con este modelo sugirieron el potencial de competencia o cooperación entre diferentes regiones de la misma neurona..<ref name=":11" /> La cooperación entre sitios remotos de picos ectópicos permite que la AD se inicie y se mantenga en diferentes lugares dentro de un solo axón, lo que proporciona una explicación convincente de las discontinuidades temporales y espaciales del dolor y otros síntomas que presentan los pacientes con EM. Sorprendentemente, en un estudio reciente de axones desmielinizados en un modelo de ratón con cuprizona, se observó evidencia experimental de una redistribución de los canales iónicos del nódulo de Ranvier, una mayor excitabilidad ectópica junto con AP propagados antidrómicamente desde la placa desmielinizada, así como un cambio compensatorio en la excitabilidad de las membranas proximales al soma. Todas estas observaciones coinciden o son consistentes con las predicciones del modelo computacional de Coggan y sus colegas e implican el éxito del enfoque computacional para guiar los estudios de laboratorio. | |||
Además, estos modelos simplificados permitieron la aplicación de herramientas matemáticas para examinar los mecanismos no lineales mediante los cuales se inicia y finaliza la AD..<ref name=":9" /><ref name=":10" /><ref name=":11" /> El análisis de bifurcación reveló la biestabilidad subyacente de la excitabilidad del axón en condiciones patológicas, así como los factores que controlan la transición de un estado atractor a otro. AD, por ejemplo, requiere una corriente de entrada lenta que permite dos estados de atracción estables, uno correspondiente a la quiescencia y el otro a picos repetitivos (un ciclo límite). La terminación de AD fue explicada por la destrucción del atractor asociado con el spiking repetitivo. Esto ocurrió cuando la retroalimentación negativa ultralenta en forma de acumulación intracelular de Na+ provocó la destrucción del estado atractor del ciclo límite [58]. Otros estudios que utilizan análisis de bifurcación sugieren que los cambios en la concentración de iones pueden introducir dinámicas lentas que pueden ser importantes para comprender los resultados patológicos [94,109].<ref name=":19" /><ref>Yu N., Morris C.E., Joós B., Longtin A. Spontaneous excitation patterns computed for axons with injury-like impairments of sodium channels and Na/K pumps. PLoS Comput. Biol. 2012;8:e1002664. doi: 10.1371/journal.pcbi.1002664. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> | |||
==== | ==== Modelado a Pequeñas Escalas ==== | ||
Los estudios mencionados anteriormente resaltan la importancia de los cambios en la concentración de iones, pero cada uno de ellos solo consideró esos cambios en una escala de curso relativamente. En comparación, el estudio de Lorpreore et al..<ref>Lopreore C.L., Bartol T.M., Coggan J.S., Keller D.X., Sosinsky G.E., Ellisman M.H., Sejnowski T.J. Computational modeling of three-dimensional electrodiffusion in biological systems: Application to the node of Ranvier. Biophys. J. 2008;95:2624–2635. doi: 10.1529/biophysj.108.132167.</ref>abordó el abrumador problema de modelar la electrodifusión tridimensional de flujos iónicos en micro y nanodominios que rodean los canales iónicos en el nodo de Ranvier. En este modelo único, los flujos de iones se calculan mediante ecuaciones de Poisson-Nernst-Planck con técnicas de volumen finito. Los flujos y potenciales eléctricos se evaluaron dentro de vóxeles formados por una malla Delaunay-Voronoi del interior y exterior del axón cerca de la membrana. Es importante destacar que el algoritmo se validó y los resultados coincidieron con las predicciones del modelo de cable. La divergencia de las predicciones del modelo de cable en tamaños de clúster más pequeños reveló la importancia del propio campo eléctrico de cada canal. | |||
El ejemplo anterior destaca el punto de que los modelos pueden simular más que canales iónicos y potencial de membrana. De hecho, los modelos pueden y deben profundizar en los mecanismos biofísicos como la electrodifusión y en las vías de señalización que, en última instancia, sirven para regular la función y la expresión de los canales iónicos. Un método prometedor llamado Teoría de Sistemas Bioquímicos (BST) puede ser útil en el futuro para preseleccionar los efectos de las drogas a nivel sistémico. Broome y Coleman<ref>Broome T.M., Cole.man R.A. A mathematical model of cell death in multiple sclerosis. J. Neurosci. Methods. 2011;201:420–425. doi: 10.1016/j.jneumeth.2011.08.008. [PubMed] [CrossRef] [Google Scholar]</ref> demostró el poder de esta técnica mediante el modelado de varias vías bioquímicas en las neuronas asociadas con la muerte celular durante la EM, incluida la formación de especies reactivas de oxígeno y nitrógeno, la dinámica del Ca2+, la formación del complejo de muerte, la liberación del factor apoptótico y las respuestas inflamatorias junto con tres estados diferentes: normal, EM enfermedad y tratamiento. A nivel atómico, se llevó a cabo un modelo computacional de la estructura de la proteína básica de mielina (MBP) porque las modificaciones postraduccionales de la MBP pueden contribuir a la desmielinización en la EM.<ref>Ridsdale R.A., Beniac D.R., Tompkins T.A., Moscarello M.A., Harauz G. Three-dimensional structure of myelin basic protein. II. Molecular modeling and considerations of predicted structures in multiple sclerosis. J. Biol. Chem. 1997;272:4269–4275. doi: 10.1074/jbc.272.7.4269. [PubMed] [CrossRef] [Google Scholar]</ref> Es importante comprender su estructura 3D para predecir los sitios de interacción con otras moléculas, pero es posible que nunca se pueda medir directamente una estructura cristalina para esta proteína. Este tipo de modelado puede, por lo tanto, representar una forma efectiva de predecir la estructura al combinar el conocimiento de la secuencia de aminoácidos con información de proteínas similares. El desafío y el verdadero poder del modelado radica en conectar mecanismos que operan a escalas muy diferentes, desde la estructura molecular hasta el sistema nervioso en su conjunto y más allá, para abordar cómo el sistema nervioso interactúa con el sistema inmunológico. | |||
Modelos de Factores Inmunes. Si bien existen numerosos modelos computacionales del sistema inmunitario,<ref>Pigozzo A.B., Macedo G.C., Santos R.W., Lobosco M. On the computational modeling of the innate immune system. BMC Bioinform. 2013;14 doi: 10.1186/1471-2105-14-S6-S7. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref>los relacionados con la EM suelen modelar redes de interacción genética, representadas como conjuntos de ecuaciones diferenciales ordinarias (EDO) o redes booleanas. Un modelo de biología de sistemas de un posible mecanismo celular de RRMS encontró una ruptura en la homeostasis de las células T efectoras (Teff) y reguladoras (Treg).<ref>Doerck S., Göbel K., Weise G., Schneider-Hohendorf T., Reinhardt M., Hauff P., Schwab N., Linker R., Mäurer M., Meuth S.G., et al. Temporal pattern of ICAM-I mediated regulatory T cell recruitment to sites of inflammation in adoptive transfer model of multiple sclerosis. PLoS ONE. 2010;5:e15478. doi: 10.1371/journal.pone.0015478. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>De Mendizábal N.V., Carneiro J., Solé R.V., Goñi J., Bragard J., Martinez-Forero I., Martinez-Pasamar S., Sepulcre J., Torrealdea J., Bagnato F., et al. Modeling the effector-regulatory T cell cross-regulation reveals the intrinsic character of relapses in Multiple Sclerosis. BMC Syst. Biol. 2011;5doi: 10.1186/1752-0509-5-114. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref>Al cambiar los parámetros en el ciclo de retroalimentación Teff-Treg, bajo un estímulo externo estocástico continuo de antígenos, el modelo reprodujo recaídas inmunes espontáneas y aparentemente estocásticas. El daño irreversible de cada episodio se acumula con el tiempo. Las nuevas predicciones incluyen la sugerencia de que el momento de la inmunoterapia Treg en el ciclo de respuesta inmune es fundamental para determinar si la intervención es beneficiosa o perjudicial. | |||
Modelos de disfunción mitocondrial. Como se mencionó anteriormente, la mielina permite una conducción AP más eficiente energéticamente a lo largo del axón. Las mayores demandas de energía que se imponen al axón desmielinizado representan otro desafío para la neurona afectada. Más allá de la pérdida de conducción saltatoria, existe una creciente evidencia de un papel fundamental de los astrocitos y oligodendrocitos en el suministro de energía a las neuronas y este proceso también ha sido objeto de modelado computacional..<ref>Jolivet R., Coggan J.S., Allaman I., Magistretti P.J. Multi-timescale modeling of activity-dependent metabolic coupling in the neuron-glia-vasculature ensemble. PLoS Comput. Biol. 2015;11:e1004036. doi: 10.1371/journal.pcbi.1004036. [PMC free article] [PubMed] [CrossRef]</ref> | |||
Hay muchas formas en que la función mitocondrial puede salir mal y las vías compensatorias son igualmente complicadas..<ref name=":8" /><ref name=":12" /><ref name=":13" />Por ejemplo, la disfunción mitocondrial puede tener sus raíces en la señalización de Ca2+ perturbada dentro de las mitocondrias, los gradientes de protones o la cadena de electrones interrumpidos, el desequilibrio de reducción-oxidación, así como las consecuencias de la disponibilidad reducida de ATP, a nivel local y global. Por ejemplo, se han utilizado modelos multiescala de corazón para relacionar la señalización mitocondrial alterada de Ca2+ con la arritmia [60]. Mediante el uso de modelos de redes mitocondriales, este estudio demostró cómo incluso un exceso de especies reactivas de oxígeno puede desencadenar un colapso del potencial de la membrana mitocondrial en toda la célula. Este es un excelente ejemplo de cómo un modelo computacional puede vincular procesos que ocurren en diferentes niveles, y son precisamente estos vínculos los que deben establecerse en el campo de las enfermedades desmielinizantes. | |||
=== | === Eslabones perdidos y la necesidad de integración === | ||
Dentro del campo de las enfermedades desmielinizantes, los esfuerzos de modelado se han centrado tradicionalmente en modelos de axones destinados a explicar varios aspectos de la excitabilidad. Pero como se describió anteriormente, esos modelos han experimentado una tremenda evolución en complejidad. En el proceso, han comenzado a fusionarse modelos a diferentes escalas biológicas. Por ejemplo, los modelos ahora han comenzado a abordar la regulación de las concentraciones de iones y sus consecuencias para los cambios lentos de excitabilidad, el consumo de energía y la toxicidad. Será necesario un enfoque computacional para integrar etiologías paralelas y multifactoriales asociadas con el deterioro cognitivo, como la señalización del sistema inmunitario, el metabolismo energético, las interacciones de la materia gris y blanca y las redes genéticas .<ref>Zeis T., Allaman I., Gentner M., Schroder K., Tschopp J., Magistretti P.J., Schaeren-Wiemers N. Metabolic gene expression changes in astrocytes in Multiple Sclerosis cerebral cortex are indicative of immune-mediated signaling. Brain Behav. Immun. 2015;48:315–325. doi: 10.1016/j.bbi.2015.04.013.[PubMed] [CrossRef] [Google Scholar]</ref> Estos esfuerzos continuos están comenzando a descubrir los amplios circuitos de retroalimentación interconectados que operan en una amplia gama de escalas espaciales y temporales. Dicho esto, tales esfuerzos aún están en su infancia y quedan grandes lagunas en el modelado de enfermedades desmielinizantes. Es más fácil describir lo que se ha modelado que lo que no. Sigue sin realizarse un modelo verdaderamente integrado que involucre múltiples tipos de células que aborde todos los factores etiológicos hipotéticos. Entre los objetivos inexplorados o poco explorados pero potencialmente útiles para el modelado se encuentran la patología de la materia gris, las capas acuosas de la vaina de mielina, el metabolismo energético y, quizás lo más importante, el modelado multiescala o integrado. Se debe reconocer que las herramientas necesarias existen en otros campos de estudio y, por lo tanto, se pueden aplicar fácilmente al estudio de las enfermedades de desmielinización. | |||
=== | === Conclusiones === | ||
La función fisiológica normal del SNC o SNP se basa en una interacción altamente regulada de neuronas, glía, vasculatura y células inmunitarias. Este proceso abarca e integra numerosos componentes celulares y de señalización que producen un todo dinámico y computacional. Cuando alguna parte sale mal, todo el sistema se ve obligado a compensar. Incluso cuando la compensación logra rescatar las consecuencias más obvias de la desmielinización, es posible que ciertos procesos no vuelvan a un estado completamente normal, lo que puede generar problemas en escalas de tiempo más largas. Los síntomas resultantes son una mezcla confusa de cambios directos y compensatorios que evolucionan continuamente. La complejidad general ha demostrado ser intratable para una disección experimental eficiente. La aplicación de técnicas de modelado computacional representa un enfoque invaluable para ayudar a romper el callejón sin salida y generar una nueva era de comprensión y descubrimiento. | |||
== | == Expresiones de gratitud == | ||
Apoyo proporcionado por el premio al nuevo investigador de los institutos canadienses de investigación en salud y el premio al investigador temprano de Ontario (SAP). Agradecemos a Heiki Blum por su ayuda con la preparación de figuras. | |||
== | == Contribuciones del autor == | ||
Todos los autores contribuyeron a la redacción de este manuscrito. Las cifras fueron proporcionadas por Sven G. Meuth. | |||
== | == Conflictos de interés == | ||
Los autores declaran no tener conflicto de intereses. | |||
== | == Información del artículo == | ||
Int J Mol Sci. 2015 Sep; 16(9): 21215–21236. | Int J Mol Sci. 2015 Sep; 16(9): 21215–21236. | ||
Published online 2015 Sep 7. doi: 10.3390/ijms160921215 | Published online 2015 Sep 7. doi: 10.3390/ijms160921215 | ||
| Line 215: | Line 213: | ||
3Neurosciences and Mental Health, the Hospital for Sick Children, Toronto, ON M5G 1X8, Canada; E-Mail: ac.sdikkcis@ttocserp.evets | 3Neurosciences and Mental Health, the Hospital for Sick Children, Toronto, ON M5G 1X8, Canada; E-Mail: ac.sdikkcis@ttocserp.evets | ||
4Department of Physiology and the Institute of Biomaterials and Biomedical Engineering, University of Toronto, Toronto, ON M5G 1X8, Canada | 4Department of Physiology and the Institute of Biomaterials and Biomedical Engineering, University of Toronto, Toronto, ON M5G 1X8, Canada | ||
* | *Autor a quien debe dirigirse la correspondencia; E-Mail: gro.xniloruen@yaj; Tel.: +1-858-243-6720. | ||
Received 2015 May 26; Accepted 2015 Aug 25. | Received 2015 May 26; Accepted 2015 Aug 25. | ||
Copyright © 2015 by the authors; licensee MDPI, Basel, Switzerland. | Copyright © 2015 by the authors; licensee MDPI, Basel, Switzerland. | ||
Este artículo es un artículo de acceso abierto distribuido bajo los términos y condiciones de la licencia Creative Commons Attribution (http://creativecommons.org/licenses/by/4.0/). | |||
Los artículos de International Journal of Molecular Sciences se proporcionan aquí por cortesía del Instituto Multidisciplinario de Publicaciones Digitales (MDPI) | |||
== Bibliography == | == Bibliography == | ||
Latest revision as of 16:42, 5 May 2023
| Title | Dinámica fisiológica en enfermedades desmielinizantes: desentrañar relaciones complejas a través del modelado por computadora |
| Authors | Jay S. Coggan · Stefan Bittner · Klaus M. Stiefel · Sven G. Meuth · Steven A. Prescott |
| Source | Document |
| Date | 2021 |
| Journal | Int J Mol Sci. |
| DOI | 10.3390/ijms160921215 |
| PUBMED | https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4613250/#!po=53.5714 |
| PDF copy | |
| License | CC BY |
| This resource has been identified as a Free Scientific Resource, this is why Masticationpedia presents it here as a mean of gratitude toward the Authors, with appreciation for their choice of releasing it open to anyone's access | |
This is free scientific content. It has been released with a free license, this is why we can present it here now, for your convenience. Free knowledge, free access to scientific knowledge is a right of yours; it helps Science to grow, it helps you to have access to Science
This content was relased with a 'CC BY' license.
You might perhaps wish to thank the Author/s
Dinámica fisiológica en enfermedades desmielinizantes: desentrañar relaciones complejas a través del modelado por computadora
Free resource by Jay S. Coggan · Stefan Bittner · Klaus M. Stiefel · Sven G. Meuth · Steven A. Prescott
|
Physiological Dynamics in Demyelinating Diseases: Unraveling Complex Relationships through Computer Modeling
Jay S. Coggan, Stefan Bittner, [...], and Steven A. Prescott
Additional article information
Abstracta
A pesar de la intensa investigación, hay pocos tratamientos disponibles para la mayoría de los trastornos neurológicos. Las enfermedades desmielinizantes no son una excepción. Quizás esto no sea sorprendente considerando la naturaleza multifactorial de estas enfermedades, que implican interacciones complejas entre las células del sistema inmunitario, la glía y las neuronas. En el caso de la esclerosis múltiple, por ejemplo, no hay unanimidad entre los investigadores sobre la causa o incluso qué sistema o tipo de célula podría ser la zona cero. Esta situación impide el desarrollo y la aplicación estratégica de terapias basadas en mecanismos. Discutiremos cómo el modelado computacional aplicado a preguntas en diferentes niveles biológicos puede ayudar a vincular observaciones dispares y descifrar mecanismos complejos cuyas soluciones no son susceptibles de reduccionismo simple. Al hacer predicciones comprobables y revelar brechas críticas en el conocimiento existente, estos modelos pueden ayudar a dirigir la investigación y proporcionarán un marco riguroso en el que integrar nuevos datos a medida que se recopilan. Hoy en día, no hay escasez de datos; el desafío es darle sentido a todo. En ese sentido, el modelado computacional es una herramienta invaluable que podría, en última instancia, transformar la forma en que entendemos, diagnosticamos y tratamos las enfermedades desmielinizantes.
Palabras clave: mielina, desmielinización, esclerosis múltiple, enfermedad neurodegenerativa, modelo computacional, descubrimiento de fármacos
Introducción
Los sistemas nerviosos de los vertebrados a menudo se dividen en materia gris y blanca según su apariencia y funciones funcionales correspondientes. Mientras que la materia gris se compone principalmente de cuerpos celulares y dendritas, la materia blanca contiene principalmente axones y recibe su nombre de las láminas de membrana lipídica llamadas mielina que se enrollan estrechamente alrededor de esos axones..[1] La mielina se origina a partir de diferentes clases de células gliales denominadas oligodendrocitos en el sistema nervioso central (SNC) y células de Schwann en el sistema nervioso periférico (SNP).
El aislamiento eléctrico proporcionado por las láminas de mielina mejora la función axonal al aumentar tanto la eficiencia energética como la velocidad de conducción de los potenciales de acción (AP). Estas dos funciones pueden haber cambiado su importancia relativa durante la evolución..[2] La mielina apareció por primera vez en el Ordovícico (485 a 443 ma, o millones de años antes del presente) después de la separación de los ancestros de la lamprea y el mixino del resto de los linajes de vertebrados..[3] Con algunas excepciones interesantes,[4][5] La mielina o estructuras análogas se encuentran en todos los vertebrados y es fundamental para el correcto funcionamiento de sus sistemas nerviosos. El tiempo aproximado de la evolución de la mielina se puede deducir del tiempo conocido de divergencia entre cordados sin (agnatha) y con (todos los demás vertebrados) mielina.
La envoltura de mielina se ve interrumpida por tramos no mielinizados, espaciados regularmente, conocidos como nódulos de Ranvier. La mielina acelera la conducción al restringir el flujo de carga transmembrana a través de los canales iónicos ubicados dentro de los nódulos. Dentro de los llamados entrenudos, la corriente fluye por el axón y muy poca pasa a través de la membrana celular aislada. El AP se regenera en cada nodo donde la densidad de los canales de sodio y potasio dependientes de voltaje es muy alta. Este proceso se denomina “conducción saltatoria” ya que el PA parece saltar de nodo en nodo. Las interrupciones en este sistema de comunicaciones de fuego rápido pueden estar asociadas con una serie de disfunciones del sistema nervioso..[6]
En varios aspectos, los axones parecen operar en límites físicos. Un ejemplo interesante es que el tamaño de los axones parece estar limitado por el ruido térmico intrínseco a las proteínas del canal iónico; cualquier axón de menos de 0,1 μm sería inútil para la transferencia de información debido a sus altos niveles de ruido.[7]Curiosamente, 0,1 μm es también aproximadamente el diámetro de axón más pequeño observado en los sistemas nerviosos [7]. Este y otros hallazgos similares sugieren que los axones y sus subestructuras son dispositivos biológicos finamente sintonizados, pero que la sintonía evidentemente puede verse interrumpida en condiciones patológicas..[8]
La desmielinización pone en marcha cambios funcionales que son importantes para las características clínicas pero que no se explican fácilmente por cambios inmunológicos o radiológicos. La ubicación de una placa predice qué sistema se verá afectado (motor frente a sensorial, visual frente a táctil), pero no cómo se verá afectado. Esto destaca la importancia de evaluar la función (además de la estructura) y cómo cambia después de la desmielinización. Después de presentar las enfermedades desmielinizantes, discutiremos cómo las manifestaciones clínicas de esas enfermedades reflejan diversos cambios patológicos en la función del axón. Argumentaremos que la comprensión de esos cambios y la capitalización total de esa comprensión con fines diagnósticos y terapéuticos pueden beneficiarse enormemente del modelado computacional.
Enfermedades desmielinizantes
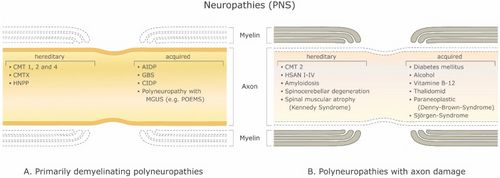
Hay un gran número de enfermedades desmielinizantes que afectan tanto al SNP (Figura 1) como al SNC (Figura 2). Las etiologías son heterogéneas y van desde trastornos genéticos hasta mecanismos metabólicos, infecciosos o autoinmunitarios. La esclerosis múltiple (EM) es el más prevalente de estos trastornos, con un estimado de 3 millones de pacientes en todo el mundo. Su causa subyacente es incierta, pero se cree que implica una predisposición genética a los agentes ambientales.[9][10]y puede involucrar componentes inmunológicos, de respuesta al trauma, biofísicos, genéticos y/o metabólicos.[10]Los síntomas y lesiones deben ser múltiples tanto en el tiempo como en el espacio. Es decir, debe haber múltiples episodios en el tiempo, involucrando partes desconectadas del sistema nervioso central. No está claro si la desmielinización inflamatoria es un evento primario o secundario dentro del proceso de la enfermedad..[9][11][12] La mayoría de los tratamientos tienen como objetivo el sistema inmunitario o la barrera hematoencefálica, pero el control de los síntomas neurológicos a través de la modulación de la excitabilidad axonal también juega un papel importante (ver más abajo).
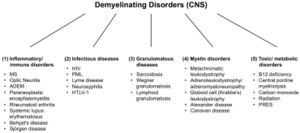
Evaluación clínica de la esclerosis múltiple
Los síntomas son diversos y pueden ocurrir en todas las combinaciones dentro de un paciente individual. El diagnóstico requiere que haya múltiples lesiones y episodios sintomáticos a lo largo del tiempo, involucrando partes desconectadas del SNC. Además, los síntomas tienden a estar mal correlacionados con las medidas radiológicas. En la gran mayoría de los casos, las características clínicas individuales no se correlacionan bien con los hallazgos de la resonancia magnética, especialmente para las lesiones cerebrales..[13][14][15] Esta disociación clínico-radiológica exige una mejor comprensión teórica de los síntomas de desmielinización y los cambios biofísicos subyacentes que los acompañan, lo que por supuesto plantea la pregunta de qué sucede exactamente con los axones afectados.
Los síntomas a menudo son intermitentes y pueden incluir pérdida de función (síntomas negativos como entumecimiento, debilidad muscular, hormigueo, ceguera, incontinencia, pérdida de la función sexual, pérdida del equilibrio, dificultad para hablar, estreñimiento, fatiga incapacitante, depresión, disfunción cognitiva , incapacidad para tragar, alteración de la marcha y pérdida del control de la respiración) y ganancia de función (síntomas positivos como espasmos, espasticidad, calambres, dolor, visión borrosa o doble, urgencia o vacilación urinaria, náuseas, entre otros).[16] Los primeros criterios de diagnóstico diferencial incluyen el signo de Lhermitte (sensaciones relacionadas con la flexión del cuello) y el fenómeno de Uhthoff (empeoramiento de los síntomas dependiente de la temperatura). El diagnóstico diferencial de la EM sigue de cerca los criterios de McDonald.[17]
En los estudios de diagnóstico en humanos de potenciales evocados visuales, sensoriales o motores (VEP, SEP, MEP), solo se puede medir con precisión la latencia o la velocidad de conducción (con variaciones de aproximadamente 30% a 40% entre diferentes laboratorios). Pero estas medidas dan poca pista sobre los mecanismos subyacentes que involucran el enlentecimiento o el bloqueo de la conducción, o factores morfológicos o funcionales tales como ramificación, desmielinización, remielinización, afinamiento axonal (disminución del área transversal), atenuación o rebrote, cambios en la conducción relacionados con la temperatura. , o malpolarización (hiper o hipo). No obstante, el tipo de lesión desmielinizante puede dar pistas sobre la etiología y, por tanto, orientar el tratamiento; por ejemplo, los factores genéticos parecen estar más fuertemente correlacionados con los procesos de enfermedad internodal y las disfunciones inmunológicas causan anomalías paranodales..[18]
Una serie de pruebas se utilizan de forma rutinaria para evaluar la función neural. En la electroneurografía, se aplica un breve estímulo eléctrico a un nervio periférico en una posición predefinida anatómicamente para medir la latencia y la amplitud del potencial de acción compuesto en otra ubicación a lo largo del nervio. Los resultados deben interpretarse en combinación con los hallazgos y las pruebas clínicas (p. ej., electromiografía) pero, lo que es más importante, las diferentes enfermedades exhiben diferentes patrones de cambios electroneurográficos. Esto es importante no solo para fines de diagnóstico, sino que también puede indicar cambios patológicos específicos en la función del axón que, a su vez, podrían ayudar a guiar la elección de la terapia (si se entendiera la patobiología del axón; ver más abajo). Mediante el seguimiento del umbral, se midió la excitabilidad en humanos para varias enfermedades desmielinizantes periféricas, incluida la enfermedad de Charcot-Marie-Tooth tipo 1A (CMT1A), la polineuropatía desmielinizante inflamatoria crónica (CIDP), el síndrome de Guillain-Barré (GBS) y la neuropatía motora multifocal (MMN).[19][20][21][22][23][24][25] El desafío radica en interpretar esas observaciones. Para ello, el grupo de Stephanova ha simulado progresivamente mayores grados de desmielinización sistemática y focal de las fibras motoras para intentar explicar los cambios fisiológicos observados[26][27][28][29][30][31] (ver la sección Modelado a continuación).
Participación de los cuerpos celulares
La progresión de la EM remitente-recurrente (EMRR) a la EM progresiva secundaria (SPMS) se asocia con una mayor afectación de la patología de la materia gris, aunque la afectación axonal/de la materia gris ya se puede observar en las primeras etapas de la enfermedad.[32][33][34][35] El daño a la sustancia gris se considera el mecanismo subyacente de la progresión de la enfermedad y la discapacidad permanente en los pacientes con EM, y se mide por la pérdida de la fracción parenquimatosa cerebral o el volumen cerebral por resonancia magnética o clínicamente por la progresión en la escala expandida del estado de discapacidad (EDSS).[36] La transición de RRMS a SPMS es un presagio por la falta de terapias para combatir el deterioro físico y cognitivo exacerbado que enfrentan la mayoría de los pacientes con SPMS.[9][37]
Tratamiento
Las principales intervenciones para la EM implican la modulación de la respuesta inmunitaria con, por ejemplo, metilprednisolona, interferón beta, acetato de glatiramer o fingolimod, o evitando que las células inflamatorias crucen la BHE (anticuerpos monoclonales, p. ej., Tysabri (anti α4-integrina, Natalizumab )). Muy recientemente, los dos primeros agentes orales (fumarato y teriflunomida), así como el anticuerpo dirigido anti-CD52 Natalizumab, fueron aprobados para el tratamiento de la EMRR, que puede tratarse con éxito con terapias de primera línea como interferones, acetato de glatiramer o fingolimod, o con terapias de segunda línea, pero las formas progresivas (PPMS, SPMS) aún representan una necesidad biomédica no cubierta.[38] Los antineoplásicos se utilizan en casos extremadamente avanzados o difíciles.[39]
Los medicamentos modificadores de la enfermedad son fundamentales para detener o al menos atenuar el proceso de desmielinización, pero también lo es controlar los síntomas que surgen de cualquier desmielinización que ya haya ocurrido. La modulación de canales iónicos es cada vez más prometedora con la llegada de nuevos bloqueadores de canales iónicos como Ampyra (bloqueo de canales K).[40][41] El bloqueo de los canales de potasio está destinado a mejorar la excitabilidad de los axones. El problema es que tales intervenciones, si bien son efectivas para tratar los síntomas negativos y restaurar la función, tienden a exacerbar los síntomas positivos.[42]Por el contrario, el tratamiento de los síntomas positivos, como los espasmos, con antiepilépticos como la carbamazepina, por ejemplo, puede exacerbar los síntomas negativos..[43] De hecho, el bloqueo de los canales de Na+ no solo reduce los síntomas positivos, sino que también puede ser neuroprotector (porque la acumulación de Na+ hace que los mecanismos de intercambio de Na+/Ca2+ carguen las neuronas con Ca2+, que es excitotóxico)[44] (Figura 3), pero estos beneficios se obtienen a expensas de los síntomas negativos. Por lo tanto, y especialmente en un paciente que presenta una mezcla de síntomas positivos y negativos, las opciones de tratamiento son restringidas.
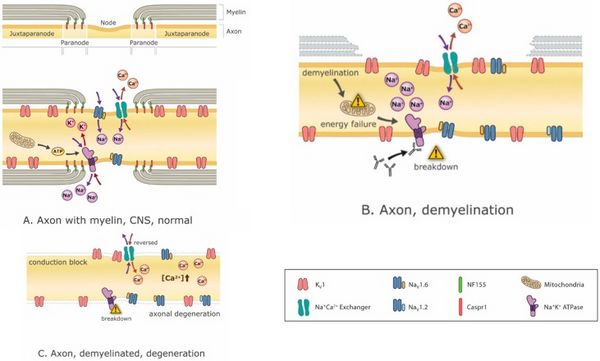
La discusión anterior plantea el punto importante de que, aunque se ha hablado mucho sobre los mecanismos inmunitarios, su conexión con los cambios clínicos es en gran parte correlacional. Se deben considerar los efectos intermedios sobre la función axonal, es decir, los cambios primarios y secundarios (compensatorios) en la excitabilidad del axón, para apreciar cómo se altera la función neurológica. Esos cambios no son consecuencias simples y directas de la desmielinización sino que, en cambio, sugieren que la fisiología axonal misma cambia en respuesta a la desmielinización. Algunos de esos cambios son adaptativos mientras que otros son desadaptativos, o quizás los cambios adaptativos pueden volverse desadaptativos a medida que evoluciona la situación (estado de mielinización). Si los cambios en la fisiología axonal dictan la manifestación de varios síntomas, entonces el manejo de los síntomas recaerá en gran medida en los tratamientos que tienen como objetivo manipular la fisiología del axón. El desarrollo estratégico de tales tratamientos requiere una comprensión profunda y mecánica de la excitabilidad axonal y su regulación.
Patobiología del axón
Cambios Estructurales y Moleculares
Los axones se ven profundamente afectados por la desmielinización. La morfología del axón se vuelve irregular o hinchada, a menudo con una apariencia de cuentas. También se observa acumulación focal de proteínas (por transporte axonal rápido). En las placas activas crónicas, la pérdida axonal del 20% al 80% es evidente dentro de la sustancia blanca periplaca y la sustancia blanca distante normal.[45] En las placas activas tempranas y activas crónicas, se cree que el daño es causado por factores inflamatorios e inmunitarios liberados durante la desmielinización inflamatoria aguda. Los mediadores propuestos incluyen proteasas, citoquinas, excitotoxinas y radicales libres. Los antígenos neuronales son objetivos de la reacción inmunitaria que conduce a la inflamación del SNC. Otros factores que causan disfunción axonal o muerte incluyen la falta de apoyo trófico de la mielina y los oligodendrocitos, el daño de los factores inmunes solubles o celulares que aún están presentes en la placa inactiva y la falla mitocondrial crónica en el contexto de una mayor demanda de energía..[46] También se ha atribuido un papel crítico para los oligodendrocitos y las células de Schwann en la supervivencia del axón a los peroxisomas, el metabolismo de los lípidos y la desintoxicación de especies reactivas de oxígeno (ROS)..[47]
La remielinización a menudo se observa como placas de sombra formadas por el reclutamiento de precursores de oligodendrocitos indiferenciados que migran hacia las lesiones y las rodean, lo que permite capas delgadas de remielinización..[48]Este proceso ocurre principalmente en placas activas agudas, pero también en fases crónicas. Esta observación desencadenó el desarrollo de un nuevo anticuerpo monoclonal dirigido contra LINGO-1 (Anti-LINGO-1). La unión de LINGO-1 a los receptores Nogo previene los procesos de remielinización en el SNC; la inhibición de esta interacción permite una remielinización significativa en animales con encefalomielitis autoinmune experimental.[49]
Durante el proceso de la enfermedad, los linfocitos y macrófagos autorreactivos pueden cruzar la barrera hematoencefálica y acumularse en el cerebro y la médula espinal..[50]Los linfocitos reguladores (Treg) no logran suprimir las células efectoras, en su mayoría células CD8+ citotóxicas.[51] La liberación de citocinas proinflamatorias recluta microglía ingenua, que se pone en contacto con una unidad de oligodendrocitos-mielina mediante interacciones con Fc y receptores del complemento. A continuación, se transmite una señal desencadenante de muerte citotóxica a través del factor de necrosis tumoral α (TNFα) unido a la superficie..[52]Esto ocurre junto con un extenso daño axonal..[10]
Lucchinetti el al.[46] propusieron cuatro inmunopatrones distintos de formación de placas que se encuentran en pacientes en diferentes etapas de la enfermedad. Las placas de tipo I y II están dominadas por inflamación de linfocitos T y macrófagos y se cree que imitan los modelos de encefalomielitis autoinmune de células T o de células T más anticuerpos, respectivamente. La pérdida de mielina en las placas de tipo I puede deberse a factores tóxicos liberados por los macrófagos activados, mientras que el depósito de IgG y complemento sugiere un papel de los anticuerpos en las placas de tipo II. Por el contrario, los patrones III y IV muestran distrofia de oligodendrocitos grandes. Se cree que el patrón III está relacionado con lesiones inducidas por hipoxia que son impulsadas por defectos en la función mitocondrial,[53] mientras que las lesiones de patrón IV se asocian con una muerte profunda no apoptótica de los oligodendrocitos en la sustancia blanca periplaca.
Barnett y Prineas[54] analizó las lesiones de los pacientes directamente después del inicio de una recaída, durante la cual estaba en curso la formación activa de placa. Sus resultados sugieren que la apoptosis de los oligodendrocitos y la activación glial ocurren durante la formación activa temprana de la placa en ausencia de linfocitos inflamatorios o fagocitos de mielina. Propusieron que la vulnerabilidad de los oligodendrocitos, descrita en el patrón de tipo III de Lucchinetti, está presente en las primeras etapas de toda formación de placa y es el desencadenante de la necrosis postapoptótica posterior que inicia la fagocitosis de mielina por parte de los macrófagos en etapas posteriores. Los análisis in vitro de este proceso han implicado cascadas del complemento, factores de necrosis tumoral o segundos mensajeros gaseosos..[55] Aunque la identificación de las placas y el seguimiento de su progreso tienen un valor clínico importante, solo hay una correlación modesta entre la carga de lesiones desmielinizantes determinada por resonancia magnética convencional y la discapacidad clínica de los pacientes con EM (véase antes).
Cambios Funcionales
Los mecanismos de deterioro funcional durante la desmielinización a menudo incluyen la interrupción de los iones transmembrana Na+, K+ y Ca2+, la dispersión de sus canales iónicos correspondientes, una disminución en la eficiencia de la conducción de AP y la crisis metabólica resultante (Figura 3). La desmielinización puede explicar fácilmente la falla de conducción dentro del axón afectado. Si la conducción no falla por completo, la velocidad de conducción puede, sin embargo, reducirse y la ralentización diferencial entre diferentes axones puede causar retrasos variables en la conducción que dan como resultado picos desincronizados.
La desmielinización también permite que los axones denudados se yupen estrechamente, preparando así el escenario para las interacciones efápticas y la diafonía..[10] La reflexión también puede ocurrir debido a un desajuste de impedancia entre las longitudes de axón mielinizado y no mielinizado. Por otra parte, la hiperexcitabilidad no puede atribuirse directamente a la desmielinización; en cambio, se deben invocar cambios secundarios en la excitabilidad intrínseca para explicar fenómenos como la generación de picos ectópicos y la posdescarga (AD). Las alteraciones en la excitabilidad probablemente representen cambios compensatorios destinados a restaurar la función después de la interrupción causada directamente por la desmielinización, de acuerdo con un proceso denominado plasticidad homeostática.,[56]pero esa compensación evidentemente puede ser desadaptativa. Cada uno de los desenlaces antes mencionados, que no son excluyentes entre sí, contribuyen a producir diferentes síntomas observados en las enfermedades desmielinizantes.
Los síntomas paroxísticos caracterizados por el inicio repentino o la intensificación de síntomas como espasmos o dolor punzante probablemente surgen de la EA o de otro tipo de picos inapropiados de tipo ráfaga. Tales patrones de picos sugieren interacciones altamente no lineales entre las corrientes de iones contribuyentes.[57][58] y podría, al menos en teoría, involucrar interacciones entre diferentes regiones de la neurona.[59] A diferencia de las formas más genéricas de hiperexcitabilidad (p. ej., aumento de la tasa de activación o reducción del umbral), estos patrones específicos están limitados en cuanto a los mecanismos precisos a través de los cuales pueden surgir. Por lo tanto, identificar los cambios en los canales iónicos que subyacen a esas formas específicas de hiperexcitabilidad puede ayudar a restringir la búsqueda de cambios en los canales iónicos responsables de formas asociadas, aunque menos distintivas, de hiperexcitabilidad.
La interrupción del equilibrio energético en una neurona también podría tener un impacto profundo en el bienestar de las neuronas (Figura 3). De hecho, los cambios compensatorios pueden lograr restaurar ciertas funciones pero, sin revertir el problema principal, pueden surgir otros problemas. Por ejemplo, incluso si el bloqueo de conducción se evita mediante un cambio compensatorio apropiado en la excitabilidad (es decir, uno que no resulte en hiperexcitabilidad), el sistema puede ser menos eficiente energéticamente. La pérdida de los ahorros de energía que ofrece la conducción saltatoria induce la producción de energía mitocondrial compensatoria que puede provocar daño oxidativo y neurodegeneración.[53][60][61]
Hacer un seguimiento de esta larga lista de cambios neurobiológicos, comprender las interrelaciones entre esos cambios y, en última instancia, vincular esos cambios con las manifestaciones clínicas y aplicar un tratamiento eficaz no es una tarea fácil. Para este fin, el modelado computacional es una herramienta invaluable. Las simulaciones no solo sirven para organizar la información que ya se conoce, sino que también identifican lagunas cruciales en el conocimiento. Por lo tanto, el uso juicioso del modelado computacional puede permitir una comprensión más integral y facilitar la aplicación más efectiva de esa comprensión, como se analiza a continuación.
Modelado Computacional
Especialmente cuando se combina con experimentos tradicionales, el modelado computacional es indispensable para dar sentido a datos inconsistentes y mecanismos complejos. Estos beneficios se ejemplifican con la aplicación de simulaciones en otros campos, como la epilepsia..[62]Aquí analizamos parte de la historia del modelado computacional de axones, conductancias iónicas, la fisiología de la mielina y la desmielinización, el sistema inmunitario, las mitocondrias y otros factores biológicos que son fundamentales para comprender las enfermedades desmielinizantes. Nuestra revisión no es exhaustiva, pero proporcionará una amplia introducción a los esfuerzos pasados, presentes y futuros en esta área.
Modelado de axones
El modelado computacional de axones ha evolucionado taxonómicamente, desde tejidos de calamar hasta tejidos de mamíferos con el correspondiente aumento de sofisticación. El modelo de Hodgkin y Huxley (HH), que proporcionó la primera explicación completa de la generación de AP, se derivó de experimentos en axones gigantes no mielinizados de calamar,[63][64]pero este modelo temprano ha demostrado ser una herramienta invaluable a partir de la cual han evolucionado modelos más sofisticados de axones mielinizados.
La heterogeneidad espacial y biofísica conferida por la adición de mielina, y la consiguiente formación de nódulos y regiones internodales, representa un aumento significativo en la complejidad del axón. El primer modelo computacional de un axón mielinizado fue un modelo unidimensional que colapsó la vaina de mielina en el axolema pasivo subyacente, utilizó un tamaño de paso espacial uniforme para formar la aproximación discreta utilizada en la solución numérica y empleó una caracterización HH de la membrana nodal..[65] Goldman & Albus[66] modificó este modelo para incluir una descripción de la membrana nodal derivada de datos experimentales sobre fibras nerviosas mielinizadas de Xenopus laevis según lo determinado por Frankenhaeuser y Huxley.[67]Estudios posteriores han utilizado la misma forma básica para el modelo con algunas variaciones para la representación del axolema..[15][68][69][70][71][72][73][74][75][76] El modelo de cable único, que describe el axón y todas sus propiedades de conductancia y capacitancia en una ecuación de cable, ha dominado el campo hasta el día de hoy a pesar de la introducción de modelos de cable doble por Blight..[77]En los modelos de doble cable, el axolema internodal y la vaina de mielina se representan de forma independiente. El modelo de doble cable ha sido ampliado por Halter y Clark[78] para explorar los efectos de la geometría compleja de los oligodendrocitos del SNC (o células de Schwann en el caso del SNP).
Los modelos más nuevos también han mejorado las simplificaciones anteriores, incluida la complejidad anatómica del nódulo de Ranvier, la distribución de los canales iónicos en el axón debajo de la vaina de mielina, las diferentes propiedades eléctricas de la vaina de mielina y el axolema, y la acomodación del posible flujo de corriente dentro el espacio periaxonal.[78][79][80][81][82] Las representaciones anatómicas del área paranodal han permitido una evaluación más detallada de los efectos de la lesión cerebral traumática (TBI) en los axones mielinizados..[83] Uno de los modelos anatómicamente más sofisticados incluye la representación de la compleja estructura de la vaina acuosa de las laminillas de mielina como una serie de laminillas paralelas interconectadas en un modelo de nervios motores..[30][80]
Los modelos más nuevos también han considerado la distribución no uniforme de los canales iónicos en todo el axón [19,84,85,86,87,88,89,90].[19][84][85][86][87][88][89][90] Más allá de los canales de iones, las bombas dependientes de energía y otros mecanismos de transporte de iones proporcionan objetivos terapéuticos importantes para una serie de trastornos neurológicos.[91][92][93]En ese sentido, la regulación de los gradientes de iones transmembrana cuesta una energía significativa y en sí misma se convierte en una consideración importante (ver más abajo).[94] Esto es especialmente cierto dado que el pequeño volumen de axones los hace propensos a cambios de concentración de iones que pueden impactar dramáticamente en las fuerzas impulsoras y pueden volverse problemáticos en modelos que asumen concentraciones intracelulares y extracelulares constantes. Pero los modelos recientes también se han ocupado de estos problemas (ver más abajo).
Todos los modelos antes mencionados se centran en simular el cambio en el potencial de membrana del axón, pero uno no necesariamente tiene acceso experimental a esa variable, lo que por supuesto complica los esfuerzos para comparar la simulación y los datos experimentales. De hecho, dado que los registros extracelulares son la principal fuente de datos electrofisiológicos de sujetos humanos, la descripción matemática del potencial de campo extracelular es de gran interés clínico. Las evaluaciones matemáticas basadas en las ecuaciones de Laplace y las transformadas de Fourier se utilizan para calcular estos potenciales (a veces denominados modelos de fuente lineal, por ejemplo,.[82][95]
Modelado de mecanismos específicos
Más allá de modelar la función axonal normal, los modelos se pueden usar para explorar mecanismos particulares de disfunción axonal, especialmente cuando se combinan con resultados experimentales que podrían identificar mejor los mecanismos..[96] Por ejemplo, Barrett and Barrett[97]mostró que el potencial posterior despolarizante (DAP) es sensible a los cambios en las densidades de conductancia y los cambios capacitativos que pueden ocurrir durante la desmielinización. Se diseñó un modelo de Blight para la simulación de sus condiciones de grabación experimental.[77][98] y representa un solo entrenudo con múltiples segmentos discretos y nodos y entrenudos adyacentes en segmentos de parámetros agrupados únicos. Este modelo incluyó canales K+ en el axolema del único entrenudo multisegmentado y trata el resto como puramente pasivo.
Sobre la base de este trabajo, con especial atención a los detalles anatómicos y electrofisiológicos, McIntyre et al.l.[81] abordó el papel de la DAP y la poshiperpolarización (AHP) en el ciclo de recuperación: el patrón distintivo de fluctuación del umbral después de un potencial de acción único exhibido por los nervios humanos. Las simulaciones sugirieron roles distintos para los canales de Na+ y K+ activos y pasivos en ambos potenciales posteriores y propusieron que las diferencias en la forma de AP, la relación fuerza-duración y el ciclo de recuperación de las fibras nerviosas motoras y sensoriales pueden atribuirse a las diferencias cinéticas en las conductancias nodales de Na+. . Richardson y otrosl.[99] también encontró que la alteración del modelo estándar de "aislante perfecto" es necesaria para reproducir DAP durante la estimulación de alta frecuencia.
La sensibilidad a la temperatura de los efectos de desmielinización también se ha investigado computacionalmente. Zlochiver[100] modelaron la reflexión resonante persistente a través de una única placa de desmielinización focal y descubrieron que este efecto era sensible a la temperatura y al diámetro del axón. Todos estos ejemplos demostraron el poder de las simulaciones para examinar mecanismos específicos para explicar los fenómenos observados en la clínica y ofrecer orientación para futuras investigaciones.
Como se mencionó anteriormente, es probable que los distintos cambios en la función del axón manifiesten ciertos síntomas de ganancia o pérdida de función. Si uno pudiera reproducir esos cambios en un modelo computacional, los cambios de parámetros necesarios para convertir el modelo entre operación normal y anormal podrían usarse para predecir la patología subyacente. Idealmente, esto puede conducir a experimentos específicos en los que el canal iónico sospechoso, por ejemplo, se manipula directamente para ver si su alteración aguda es suficiente para reproducir o revertir ciertos cambios patológicos. Estudios recientes del laboratorio de Prescott ilustran este proceso..[101][102] El éxito de estos estudios dependió de técnicas avanzadas, incluida la técnica de abrazadera dinámica, utilizada para cambiar entre patrones de picos normales y anormales y herramientas optogenéticas. El siguiente paso es vincular los cambios en la función del axón con los síntomas de la enfermedad (o sus correlatos conductuales en modelos animales).
En experimentos con el nervio auditivo, Tagoe y sus colegas[103] demostraron que la pérdida de audición relacionada con cambios morfológicos en los paranodos y yuxtaparanodos, incluida la elongación del nervio auditivo alrededor de los nodos de Ranvier, puede resultar de la exposición a ruidos fuertes. Ampliando este trabajo, Hamann y sus colegas construyeron un modelo computacional para examinar los posibles mecanismos. Su modelo sugirió que es más probable que una disminución en la densidad de los canales de Na, en lugar de una redistribución de los canales de Na o K en general, sea responsable de la inhibición de la conducción asociada con la sobreexposición acústica..[104] Este tándem modelo-experimento demuestra el potencial revelador de emparejar modelos computacionales con experimentos de laboratorio.
Con un modelo multicapa de axón mielinizado, Stephanova y sus colegas han tenido un éxito continuo en la identificación de posibles deficiencias anatómicas y fisiológicas que subyacen a varios síntomas y afecciones relacionadas con la desmielinización al hacer comparaciones con las mediciones de seguimiento del umbral de los pacientes, incluidas las latencias, la refractariedad (el aumento del umbral corriente durante el período refractario relativo), período refractario, supernormalidad y valores de electrotono de umbral, incluidas medidas de estímulo-respuesta, como la relación actual-umbrals.[21]Por ejemplo, encontraron que la desmielinización sistemática internodal leve (ISD) es un indicador específico para CMT1A. La desmielinización sistemática paranodal leve (PSD) y la desmielinización sistemática paranodal (PISD) son indicadores específicos de CIPD y sus subtipos. Las desmielinizaciones focales severas, internodal y paranodal, paranodal-internodal (IFD y PFD, PIFD) son indicadores específicos de neuropatías desmielinizantes adquiridas como GBS y MMN [18] (ver Figura 1).
La desmielinización sistémica leve y la focal severa corresponden a neuropatías hereditarias (CMT1A) y adquiridas (CIDP, GBS y MMN) (tabla 1). También se encontró que el 70% de la desmielinización sistemática es insuficiente para causar síntomas y el 96% es necesario para el bloqueo de conducción en un solo ganglio [18]. Por lo tanto, existe un gran factor de seguridad para la desmielinización focal. Con su versión dependiente de la temperatura del modelo de la fibra nerviosa motora humana mielinizada, Stephanova y Daskalova[105] demostraron que los potenciales electrotónicos en pacientes con CIDP tienen un alto riesgo de bloqueo durante la hipo e incluso hipertermia leve y sugieren mecanismos que involucran una mayor magnitud de los potenciales electrotónicos nodales polarizantes y internodales despolarizantes, el rectificador de entrada de K+ y las corrientes de K+ de fuga aumentan con la temperatura, y la la acomodación a la hiperpolarización de larga duración es mayor que a la despolarización.
| Table 1
Correspondence between types of demyelination and diseases according to Stephanova and Dimitrov.[18] | |
|---|---|
| Type of Demyelination | Corresponding Disease (PNS) |
| Internodal systematic demyelination (ISD) | Charcot-Marie-Tooth Disease Type 1A (CMT1A) |
| Paranodal systematic demyelination (PSD) | Chronic inflammatory demyelinating polyneuropathy (CIDP) |
| Paranodal + internodal demyelination (PISD) | Chronic inflammatory demyelinating polyneuropathy (CIPD) subtypes |
| Internodal focal demyelination (IFD) | Guillain-Barré (GBS) |
| Paranodal focal demyelination (PFD) | Multifocal Motor Neuropathy (MMN) |
| Paranodal + focal demyelination (PIFD) | Multifocal Motor Neuropathy (MMN) |
Modelos simples y análisis dinámico no lineal
Dada la disociación temporal entre la manifestación de los síntomas y las tasas de desmielinización y remielinización, indudablemente ocurren procesos homeostáticos dentro de los axones, que incluyen la redistribución de canales iónicos en placas desmielinizadas..[106][107] Pero dada la diversidad de canales iónicos expresados por diferentes axones y solo un conocimiento irregular de cómo cambian los niveles de expresión, la construcción de modelos detallados para investigar esos procesos homeostáticos es problemática. Especialmente bajo esas condiciones, los modelos altamente simplificados pueden ayudar a identificar los principios fundamentales, como lo ejemplifica el uso conjunto de los modelos HH y Morris-Lecar modificados [57,58]. Los resultados de esos estudios sugirieron una explicación simple para la amplitud de los síntomas encontrados durante la desmielinización al revelar que la proporción de Na+ a la conductancia de fuga de K+, g(Na)/g(L), actuó como un interruptor de cuatro vías que controlaba los patrones de excitabilidad que incluido fallo de propagación AP, propagación AP normal, AD y picos espontáneos.
Otros estudios con este modelo sugirieron el potencial de competencia o cooperación entre diferentes regiones de la misma neurona..[59] La cooperación entre sitios remotos de picos ectópicos permite que la AD se inicie y se mantenga en diferentes lugares dentro de un solo axón, lo que proporciona una explicación convincente de las discontinuidades temporales y espaciales del dolor y otros síntomas que presentan los pacientes con EM. Sorprendentemente, en un estudio reciente de axones desmielinizados en un modelo de ratón con cuprizona, se observó evidencia experimental de una redistribución de los canales iónicos del nódulo de Ranvier, una mayor excitabilidad ectópica junto con AP propagados antidrómicamente desde la placa desmielinizada, así como un cambio compensatorio en la excitabilidad de las membranas proximales al soma. Todas estas observaciones coinciden o son consistentes con las predicciones del modelo computacional de Coggan y sus colegas e implican el éxito del enfoque computacional para guiar los estudios de laboratorio.
Además, estos modelos simplificados permitieron la aplicación de herramientas matemáticas para examinar los mecanismos no lineales mediante los cuales se inicia y finaliza la AD..[57][58][59] El análisis de bifurcación reveló la biestabilidad subyacente de la excitabilidad del axón en condiciones patológicas, así como los factores que controlan la transición de un estado atractor a otro. AD, por ejemplo, requiere una corriente de entrada lenta que permite dos estados de atracción estables, uno correspondiente a la quiescencia y el otro a picos repetitivos (un ciclo límite). La terminación de AD fue explicada por la destrucción del atractor asociado con el spiking repetitivo. Esto ocurrió cuando la retroalimentación negativa ultralenta en forma de acumulación intracelular de Na+ provocó la destrucción del estado atractor del ciclo límite [58]. Otros estudios que utilizan análisis de bifurcación sugieren que los cambios en la concentración de iones pueden introducir dinámicas lentas que pueden ser importantes para comprender los resultados patológicos [94,109].[94][108]
Modelado a Pequeñas Escalas
Los estudios mencionados anteriormente resaltan la importancia de los cambios en la concentración de iones, pero cada uno de ellos solo consideró esos cambios en una escala de curso relativamente. En comparación, el estudio de Lorpreore et al..[109]abordó el abrumador problema de modelar la electrodifusión tridimensional de flujos iónicos en micro y nanodominios que rodean los canales iónicos en el nodo de Ranvier. En este modelo único, los flujos de iones se calculan mediante ecuaciones de Poisson-Nernst-Planck con técnicas de volumen finito. Los flujos y potenciales eléctricos se evaluaron dentro de vóxeles formados por una malla Delaunay-Voronoi del interior y exterior del axón cerca de la membrana. Es importante destacar que el algoritmo se validó y los resultados coincidieron con las predicciones del modelo de cable. La divergencia de las predicciones del modelo de cable en tamaños de clúster más pequeños reveló la importancia del propio campo eléctrico de cada canal.
El ejemplo anterior destaca el punto de que los modelos pueden simular más que canales iónicos y potencial de membrana. De hecho, los modelos pueden y deben profundizar en los mecanismos biofísicos como la electrodifusión y en las vías de señalización que, en última instancia, sirven para regular la función y la expresión de los canales iónicos. Un método prometedor llamado Teoría de Sistemas Bioquímicos (BST) puede ser útil en el futuro para preseleccionar los efectos de las drogas a nivel sistémico. Broome y Coleman[110] demostró el poder de esta técnica mediante el modelado de varias vías bioquímicas en las neuronas asociadas con la muerte celular durante la EM, incluida la formación de especies reactivas de oxígeno y nitrógeno, la dinámica del Ca2+, la formación del complejo de muerte, la liberación del factor apoptótico y las respuestas inflamatorias junto con tres estados diferentes: normal, EM enfermedad y tratamiento. A nivel atómico, se llevó a cabo un modelo computacional de la estructura de la proteína básica de mielina (MBP) porque las modificaciones postraduccionales de la MBP pueden contribuir a la desmielinización en la EM.[111] Es importante comprender su estructura 3D para predecir los sitios de interacción con otras moléculas, pero es posible que nunca se pueda medir directamente una estructura cristalina para esta proteína. Este tipo de modelado puede, por lo tanto, representar una forma efectiva de predecir la estructura al combinar el conocimiento de la secuencia de aminoácidos con información de proteínas similares. El desafío y el verdadero poder del modelado radica en conectar mecanismos que operan a escalas muy diferentes, desde la estructura molecular hasta el sistema nervioso en su conjunto y más allá, para abordar cómo el sistema nervioso interactúa con el sistema inmunológico.
Modelos de Factores Inmunes. Si bien existen numerosos modelos computacionales del sistema inmunitario,[112]los relacionados con la EM suelen modelar redes de interacción genética, representadas como conjuntos de ecuaciones diferenciales ordinarias (EDO) o redes booleanas. Un modelo de biología de sistemas de un posible mecanismo celular de RRMS encontró una ruptura en la homeostasis de las células T efectoras (Teff) y reguladoras (Treg).[113][114]Al cambiar los parámetros en el ciclo de retroalimentación Teff-Treg, bajo un estímulo externo estocástico continuo de antígenos, el modelo reprodujo recaídas inmunes espontáneas y aparentemente estocásticas. El daño irreversible de cada episodio se acumula con el tiempo. Las nuevas predicciones incluyen la sugerencia de que el momento de la inmunoterapia Treg en el ciclo de respuesta inmune es fundamental para determinar si la intervención es beneficiosa o perjudicial.
Modelos de disfunción mitocondrial. Como se mencionó anteriormente, la mielina permite una conducción AP más eficiente energéticamente a lo largo del axón. Las mayores demandas de energía que se imponen al axón desmielinizado representan otro desafío para la neurona afectada. Más allá de la pérdida de conducción saltatoria, existe una creciente evidencia de un papel fundamental de los astrocitos y oligodendrocitos en el suministro de energía a las neuronas y este proceso también ha sido objeto de modelado computacional..[115]
Hay muchas formas en que la función mitocondrial puede salir mal y las vías compensatorias son igualmente complicadas..[53][60][61]Por ejemplo, la disfunción mitocondrial puede tener sus raíces en la señalización de Ca2+ perturbada dentro de las mitocondrias, los gradientes de protones o la cadena de electrones interrumpidos, el desequilibrio de reducción-oxidación, así como las consecuencias de la disponibilidad reducida de ATP, a nivel local y global. Por ejemplo, se han utilizado modelos multiescala de corazón para relacionar la señalización mitocondrial alterada de Ca2+ con la arritmia [60]. Mediante el uso de modelos de redes mitocondriales, este estudio demostró cómo incluso un exceso de especies reactivas de oxígeno puede desencadenar un colapso del potencial de la membrana mitocondrial en toda la célula. Este es un excelente ejemplo de cómo un modelo computacional puede vincular procesos que ocurren en diferentes niveles, y son precisamente estos vínculos los que deben establecerse en el campo de las enfermedades desmielinizantes.
Eslabones perdidos y la necesidad de integración
Dentro del campo de las enfermedades desmielinizantes, los esfuerzos de modelado se han centrado tradicionalmente en modelos de axones destinados a explicar varios aspectos de la excitabilidad. Pero como se describió anteriormente, esos modelos han experimentado una tremenda evolución en complejidad. En el proceso, han comenzado a fusionarse modelos a diferentes escalas biológicas. Por ejemplo, los modelos ahora han comenzado a abordar la regulación de las concentraciones de iones y sus consecuencias para los cambios lentos de excitabilidad, el consumo de energía y la toxicidad. Será necesario un enfoque computacional para integrar etiologías paralelas y multifactoriales asociadas con el deterioro cognitivo, como la señalización del sistema inmunitario, el metabolismo energético, las interacciones de la materia gris y blanca y las redes genéticas .[116] Estos esfuerzos continuos están comenzando a descubrir los amplios circuitos de retroalimentación interconectados que operan en una amplia gama de escalas espaciales y temporales. Dicho esto, tales esfuerzos aún están en su infancia y quedan grandes lagunas en el modelado de enfermedades desmielinizantes. Es más fácil describir lo que se ha modelado que lo que no. Sigue sin realizarse un modelo verdaderamente integrado que involucre múltiples tipos de células que aborde todos los factores etiológicos hipotéticos. Entre los objetivos inexplorados o poco explorados pero potencialmente útiles para el modelado se encuentran la patología de la materia gris, las capas acuosas de la vaina de mielina, el metabolismo energético y, quizás lo más importante, el modelado multiescala o integrado. Se debe reconocer que las herramientas necesarias existen en otros campos de estudio y, por lo tanto, se pueden aplicar fácilmente al estudio de las enfermedades de desmielinización.
Conclusiones
La función fisiológica normal del SNC o SNP se basa en una interacción altamente regulada de neuronas, glía, vasculatura y células inmunitarias. Este proceso abarca e integra numerosos componentes celulares y de señalización que producen un todo dinámico y computacional. Cuando alguna parte sale mal, todo el sistema se ve obligado a compensar. Incluso cuando la compensación logra rescatar las consecuencias más obvias de la desmielinización, es posible que ciertos procesos no vuelvan a un estado completamente normal, lo que puede generar problemas en escalas de tiempo más largas. Los síntomas resultantes son una mezcla confusa de cambios directos y compensatorios que evolucionan continuamente. La complejidad general ha demostrado ser intratable para una disección experimental eficiente. La aplicación de técnicas de modelado computacional representa un enfoque invaluable para ayudar a romper el callejón sin salida y generar una nueva era de comprensión y descubrimiento.
Expresiones de gratitud
Apoyo proporcionado por el premio al nuevo investigador de los institutos canadienses de investigación en salud y el premio al investigador temprano de Ontario (SAP). Agradecemos a Heiki Blum por su ayuda con la preparación de figuras.
Contribuciones del autor
Todos los autores contribuyeron a la redacción de este manuscrito. Las cifras fueron proporcionadas por Sven G. Meuth.
Conflictos de interés
Los autores declaran no tener conflicto de intereses.
Información del artículo
Int J Mol Sci. 2015 Sep; 16(9): 21215–21236. Published online 2015 Sep 7. doi: 10.3390/ijms160921215 PMCID: PMC4613250 PMID: 26370960 Jay S. Coggan,1,* Stefan Bittner,2 Klaus M. Stiefel,1 Sven G. Meuth,2 and Steven A. Prescott3,4 Christoph Kleinschnitz, Academic Editor 1NeuroLinx Research Institute, La Jolla, CA 92039, USA; E-Mail: gro.xniloruen@sualk 2Department of Neurology, Institute of Physiology, Universitätsklinikum Münster, 48149 Münster, Germany; E-Mails: moc.kooltuo@renttib-nafets (S.B.); ed.retsneumku@htuem.nevs (S.G.M.) 3Neurosciences and Mental Health, the Hospital for Sick Children, Toronto, ON M5G 1X8, Canada; E-Mail: ac.sdikkcis@ttocserp.evets 4Department of Physiology and the Institute of Biomaterials and Biomedical Engineering, University of Toronto, Toronto, ON M5G 1X8, Canada
- Autor a quien debe dirigirse la correspondencia; E-Mail: gro.xniloruen@yaj; Tel.: +1-858-243-6720.
Received 2015 May 26; Accepted 2015 Aug 25. Copyright © 2015 by the authors; licensee MDPI, Basel, Switzerland. Este artículo es un artículo de acceso abierto distribuido bajo los términos y condiciones de la licencia Creative Commons Attribution (http://creativecommons.org/licenses/by/4.0/). Los artículos de International Journal of Molecular Sciences se proporcionan aquí por cortesía del Instituto Multidisciplinario de Publicaciones Digitales (MDPI)
Bibliography
- ↑ Virchow R. Uber das ausgebreitete Vorkommen einer dem Nervenmark analogen Substanz in den tierischen Geweben. Virchows Arch. Pathol. Anat. 1854;6:562–572. doi: 10.1007/BF02116709. [CrossRef] [Google Scholar]
- ↑ Stiefel K.M., Torben-Nielsen B., Coggan J.S. Proposed evolutionary changes in the role of myelin. Front. Neurosci. 2013;8 doi: 10.3389/fnins.2013.00202.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Bullock T.H., Moore J.K., Fields R.D. Evolution of myelin sheaths: Both lamprey and hagfish lack myelin. Neurosci. Lett. 1984;48:145–148. doi: 10.1016/0304-3940(84)90010-7. [PubMed] [CrossRef] [Google Scholar]
- ↑ Davis A.D., Weatherby T.M., Hartline D.K., Lenz P.H. Myelin-like sheaths in copepod axons. Nature. 1999;398:571–571. doi: 10.1038/19212. [PubMed] [CrossRef] [Google Scholar]
- ↑ Hartline D.K., Colman D.R. Rapid conduction and the evolution of giant axons and myelinated fibers. Curr. Biol. 2007;17:R29–R35. doi: 10.1016/j.cub.2006.11.042. [PubMed] [CrossRef] [Google Scholar]
- ↑ Arancibia-Carcamo I.L., Attwell D. The node of ranvier in CNS pathology. Acta Neuropathol. 2014;128:161–175. doi: 10.1007/s00401-014-1305-z.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Faisal A.A., White J.A., Laughlin S.B. Ion-channel noise places limits on the miniaturization of the brain’s wiring. Curr. Biol. 2005;15:1143–1149. doi: 10.1016/j.cub.2005.05.056. [PubMed] [CrossRef] [Google Scholar]
- ↑ Babbs C.F., Riyi S. Subtle paranodal injury slows impulse conduction in a mathematical model of myelinated axons. PLoS ONE. 2013;8:e67767. doi: 10.1371/journal.pone.0067767. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ 9.0 9.1 9.2 Trapp B.D., Nave K.A. Multiple sclerosis: An immune or neurodegenerative disorder? Annu. Rev. Neurosci. 2008;31:247–69. doi: 10.1146/annurev.neuro.30.051606.094313. [PubMed] [CrossRef] [Google Scholar]
- ↑ 10.0 10.1 10.2 10.3 Compston A., Coles A. Multiple sclerosis. Lancet. 2008;372:1502–1517. doi: 10.1016/S0140-6736(08)61620-7. [PubMed] [CrossRef] [Google Scholar]
- ↑ Ostermann P.O., Westerberg C.E. Paroxysmal attacks in multiple sclerosis. Brain. 1975;98:189–202. doi: 10.1093/brain/98.2.189. [PubMed] [CrossRef] [Google Scholar]
- ↑ Twomey J.A., Espir M.L. Paroxysmal symptoms as the first manifestations of multiple sclerosis. J. Neurol. Neurosurg. Psychiatry. 1980;43:296–304. doi: 10.1136/jnnp.43.4.296. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Seewann A., Vrenken H., van der Valk P., Blezer E.L., Knol D.L., Castelijns J.A., Polman C.H., Pouwels P.J., Barkhof F., Geurts J.J. Diffusely abnormal white matter in chronic multiple sclerosis: Imaging and histopathologic analysis. Arch. Neurol. 2009;66:601–609. doi: 10.1001/archneurol.2009.57. [PubMed] [CrossRef] [Google Scholar]
- ↑ Ceccarelli A., Bakshi R., Neema M. MRI in multiple sclerosis: A review of the current literature. Curr. Opin. Neurol. 2012;25:402–409. doi: 10.1097/WCO.0b013e328354f63f. [PubMed] [CrossRef] [Google Scholar]
- ↑ 15.0 15.1 Moore J.W., Joyner R.W., Brill M.H., Waxman S.D., Najar-Joa M. Simulations of conduction in uniform myelinated fibers. Relative sensitivity to changes in nodal and internodal parameters. Biophys. J. 1978;21:147–160. doi: 10.1016/S0006-3495(78)85515-5. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Waxman S.G., Kocsis J.D., Stys P.K. The Axon: Structure, Function and Pathophysiology. Oxford University Press; New York, NY, USA: 1995. [Google Scholar]
- ↑ Polman C.H., Reingold S.C., Banwell B., Clanet M., Cohen J.A., Filippi M., Fujihara K., Havrdova E., Hutchinson M., Kappos L., et al. Diagnostic criteria for multiple sclerosis: 2010 revisions to the McDonald criteria. Ann. Neurol. 2011;69:292–302. doi: 10.1002/ana.22366. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ 18.0 18.1 Stephanova D.I., Dimitrov B. Computational Neuroscience: Simulated Demyelinating Neuropathies and Neuronopathies. CRC Press; Boca Raton, FL, USA: 2013. [Google Scholar]
- ↑ 19.0 19.1 Bostock H., Baker M., Reid G. Changes in excitability of human motor axons underlying post-ischaemic fasciculations: Evidence for two stable states. J. Physiol. 1991;441:537–557. doi: 10.1113/jphysiol.1991.sp018766.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Mogyoros I., Kiernan M.C., Burke D., Bostock H. Strength-duration properties of sensory and motor axons in amyotrophic lateral sclerosis. Brain. 1998;121:851–859. doi: 10.1093/brain/121.5.851. [PubMed] [CrossRef] [Google Scholar]
- ↑ 21.0 21.1 Kiernan M.C., Burke D., Andersen K.V., Bostock H. Multiple measures of axonal excitability: A new approach in clinical testing. Muscle Nerve. 2000;23:399–409. doi: 10.1002/(SICI)1097-4598(200003)23:3<399::AID-MUS12>3.0.CO;2-G. [PubMed] [CrossRef] [Google Scholar]
- ↑ Cappelen-Smith C., Kuwabara S., Lin C.S., Mogyoros I., Burke D. Membrane properties in chronic inflammatory demyelinating polyneuropathy. Brain. 2001;124:2439–2447. doi: 10.1093/brain/124.12.2439. [PubMed] [CrossRef] [Google Scholar]
- ↑ Kuwabara S., Ogawara K., Sung J.Y., Mori M., Kanai K., Hattori T., Yuki N., MLin C.S., Burke D., Bostock H. Differences in membrane properties of axonal and demyelinating Guillain-Barré syndromes. Ann. Neurol. 2002;52:180–187. doi: 10.1002/ana.10275. [PubMed] [CrossRef] [Google Scholar]
- ↑ Nodera H., Bostock H., Kuwabara S., Sakamoto T., Asanuma K., Jia-Ying S., Ogawara K., Hattori N., Hirayama M., Sobue G., et al. Nerve excitability properties in Charcot-Marie-Tooth disease type 1A. Brain. 2004;127:203–211. doi: 10.1093/brain/awh020. [PubMed] [CrossRef] [Google Scholar]
- ↑ Sung M.H., Simon R. In silico simulation of inhibitor drug effects on nuclear factor-κB pathway dynamics. Mol. Pharmacol. 2004;66:70–75. doi: 10.1124/mol.66.1.70. [PubMed] [CrossRef] [Google Scholar]
- ↑ Stephanova D.I., Daskalova M. Differences in potentials and excitability properties in simulated cases of demyelinating neuropathies. Part III. Paranodal internodal demyelination. Clin. Neurophysiol. 2005;116:2334–2341. doi: 10.1016/j.clinph.2005.07.013. [PubMed] [CrossRef] [Google Scholar]
- ↑ Stephanova D.I., Daskalova M.S. Differences between the channels, currents and mechanisms of conduction slowing/block and accommodative processes in simulated cases of focal demyelinating neuropathies. Eur. Biophys. J. 2008;37:829–842. doi: 10.1007/s00249-008-0284-1. [PubMed] [CrossRef] [Google Scholar]
- ↑ Stephanova D.I., Alexandrov A.S. Simulating mild systematic and focal demyelinating neuropathies: Membrane property abnormalities. J. Integr. Neurosci. 2006;5:595–623. doi: 10.1142/S0219635206001331. [PubMed] [CrossRef] [Google Scholar]
- ↑ Stephanova D.I., Daskalova M., Alexandrov A.S. Channels, currents and mechanisms of accommodative processes in simulated cases of systematic demyelinating neuropathies. Brain Res. 2007;1171:138–151. doi: 10.1016/j.brainres.2007.07.029. [PubMed] [CrossRef] [Google Scholar]
- ↑ 30.0 30.1 Stephanova D.I., Krustev S.M., Negrev N., Daskalova M. The myelin sheath aqueous layers improve the membrane properties of simulated chronic demyelinating neuropathies. J. Integr. Neurosci. 2011;10:105–120. doi: 10.1142/S0219635211002646. [PubMed] [CrossRef] [Google Scholar]
- ↑ Stephanova D.I., Alexandrov A.S., Kossev A., Christova L. Simulating focal demyelinating neuropathies: Membrane property abnormalities. Biol. Cybern. 2007;96:195–208. doi: 10.1007/s00422-006-0113-5. [PubMed] [CrossRef] [Google Scholar]
- ↑ Bø L., Geurts J.J., Mörk S.J., van der Valk P. Grey matter pathology in multiple sclerosis. Acta Neurol. Scand. Suppl. 2006;183:48–50. doi: 10.1111/j.1600-0404.2006.00615.x. [PubMed] [CrossRef] [Google Scholar]
- ↑ Geurts J.J., Barkhof F. Grey matter pathology in multiple sclerosis. Lancet Neurol. 2008;7:841–851. doi: 10.1016/S1474-4422(08)70191-1. [PubMed] [CrossRef] [Google Scholar]
- ↑ Zivadinov R., Pirko I. Advances in understanding gray matter pathology in multiple sclerosis: Are we ready to redefine disease pathogenesis? BMC Neurol. 2012;12 doi: 10.1186/1471-2377-12-9. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Popescu B.F., Lucchinetti C.F. Pathology of demyelinating diseases. Annu. Rev. Pathol. 2012;7:185–217. doi: 10.1146/annurev-pathol-011811-132443.[PubMed] [CrossRef] [Google Scholar]
- ↑ Kurtzke J.F., Beebe G.W., Nagler B., Nefzger M.D., Auth T.L., Kurland L.T. Studies on the natural history of multiple sclerosis: V. Long-term survival in young men. Arch. Neurol. 1970;22:215–225. doi: 10.1001/archneur.1970.00480210025003. [PubMed] [CrossRef] [Google Scholar]
- ↑ Rao S.M., Leo G.J., Bernardin L., Unverzagt F. Cognitive dysfunction in multiple sclerosis. I. Frequency, patterns, and prediction. Neurology. 1991;41:685–691. doi: 10.1212/WNL.41.5.685. [PubMed] [CrossRef] [Google Scholar]
- ↑ Meuth S.G., Bittner S., Ulzheimer J.C., Kleinschnitz C., Kieseier B.C., Wiendl H. Therapeutic approaches to multiple sclerosis: An update on failed, interrupted, or inconclusive trials of neuroprotective and alternative treatment strategies. BioDrugs. 2010;24:317–330. doi: 10.2165/11537190-000000000-00000. [PubMed] [CrossRef] [Google Scholar]
- ↑ Goldenberg M.M. Multiple sclerosis review. Pharm. Ther. 2012;37:137–139.[PMC free article] [PubMed] [Google Scholar]
- ↑ Göbel K., Wedell J.H., Herrmann A.M., Wachsmuth L., Pankratz S., Bittner S., Budde T., Kleinschnitz C., Faber C., Wiendl H., et al. 4-Aminopyridine ameliorates mobility but not disease course in an animal model of multiple sclerosis. Exp. Neurol. 2013;248:62–71. doi: 10.1016/j.expneurol.2013.05.016.[PubMed] [CrossRef] [Google Scholar]
- ↑ Krishnan A.V., Kiernan M.C. Sustained-release fampridine and the role of ion channel dysfunction in multiple sclerosis. Mult. Scler. 2013;19:385–391. doi: 10.1177/1352458512463769. [PubMed] [CrossRef] [Google Scholar]
- ↑ Bowe C.M., Kocsis J.D., Targ E.F., Waxman S.G. Physiological effects of 4-aminopyridine on demyelinated mammalian motor and sensory fibers. Ann. Neurol. 1987;22:264–268. doi: 10.1002/ana.410220212. [PubMed] [CrossRef] [Google Scholar]
- ↑ Sakurai M., Kanazawa I. Positive symptoms in multiple sclerosis: Their treatment with sodium channel blockers, lidocaine and mexiletine. J. Neurol. Sci. 1999;162:162–168. doi: 10.1016/S0022-510X(98)00322-0. [PubMed]
- ↑ Mattson M.P., Guthrie P.B., Kater S.B. A role for Na+-dependent Ca2+extrusion in protection against neuronal excitotoxicity. FASEB J. 1989;3:2519–2526. [PubMed] [Google Scholar]
- ↑ Moll N.M., Rietsch A.M., Thomas S., Ransohoff A.J., Lee J.C., Fox R., Chang A., Ransohoff R.M., Fisher E. Multiple sclerosis normal-appearing white matter: Pathology-imagig correlations. Ann. Neurol. 2011;70:764–773. doi: 10.1002/ana.22521. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ 46.0 46.1 Lucchinetti C., Brück W., Parisi J., Scheithauer B., Rodriguez M., Lassmann H. Heterogeneity of multiple sclerosis lesions: Implications for the pathogenesis of demyelination. Ann. Neurol. 2000;47:707–717. doi: 10.1002/1531-8249(200006)47:6<707::AID-ANA3>3.0.CO;2-Q. [PubMed] [CrossRef] [Google Scholar]
- ↑ Kassmann C.M., Nave K.A. Oligodendroglial impact on axonal function and survival— A hypothesis. Curr. Opin. Neurol. 2008;21:235–241. doi: 10.1097/WCO.0b013e328300c71f. [PubMed] [CrossRef] [Google Scholar]
- ↑ Scolding N., Franklin R. Axon loss in multiple sclerosis. Lancet. 1998;352:340–341. doi: 10.1016/S0140-6736(05)60463-1. [PubMed] [CrossRef] [Google Scholar]
- ↑ Mi S., Miller R.H., Lee X., Scott M.L., Shulag-Morskaya S., Shao Z., Chang J., Thill G., Levesque M., Zhang M., et al. LINGO-1 negatively regulates myelination by oligodendrocytes. Nat. Neurosci. 2005;8:745–751. doi: 10.1038/nn1460. [PubMed] [CrossRef] [Google Scholar]
- ↑ Bittner S., Ruck T., Schuhmann M.K., Herrmann A.M., Maati H.M., Bobak N., Göbel K., Langhauser F., Stegner D., Ehling P., et al. 2013 Endothelial TWIK-related potassium channel-1 (TREK1) regulates immune-cell trafficking into the CNS. Nat. Med. 2013;19:1161–1165. doi: 10.1038/nm.3303. [PubMed]
- ↑ Viglietta V., Baecher-Allan C., Weiner H.L., Hafler D.A. Loss of functional suppression by CD4+CD25+ regulatory T cells in patients with multiple sclerosis. J. Exp. Med. 2004;199:971–999. doi: 10.1084/jem.20031579.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Zajicek J.P., Wing M., Scolding N.J., Compston D.A. Interactions between oligodendrocytes and microglia. A major role for complement and tumour necrosis factor in oligodendrocyte adherence and killing. Brain. 1992;115:1611–1631. [PubMed] [Google Scholar]
- ↑ 53.0 53.1 53.2 Nikić I., Merkler D., Sorbara C., Brinkoetter M., Kreutzfeldt M., Bareyre F.M., Brück W., Bishop D., Misgeld T., Kerschensteiner M. A reversible form of axon damage in experimental autoimmune encephalomyelitis and multiple sclerosis. Nat. Med. 2011;17:495–499. doi: 10.1038/nm.2324. [PubMed] [CrossRef] [Google Scholar]
- ↑ Barnett M.H., Prineas J.W. Relapsing and remitting multiple sclerosis: Pathology of the newly forming lesion. Ann. Neurol. 2004;55:458–468. doi: 10.1002/ana.20016. [PubMed] [CrossRef] [Google Scholar]
- ↑ Van der Laan L.J., Ruuls S.R., Weber K.S., Lodder I.J., Döpp E.A., Dijkstra C.D. Macrophage phagocytosis of myelin in vitro determined by flow cytometry: Phagocytosis is mediated by CR3 and induces production of tumor necrosis factor-α and nitric oxide. J. Neuroimmunol. 1996;70:145–152. doi: 10.1016/S0165-5728(96)00110-5. [PubMed] [CrossRef] [Google Scholar]
- ↑ Wang G., Thompson S.M. Maladaptive homeostatic plasticity in a rodent model of central pain syndrome: Thalamic hyperexcitability after spinothalamic tract lesions. J. Neurosci. 2008;28:11959–11969. doi: 10.1523/JNEUROSCI.3296-08.2008. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ 57.0 57.1 Coggan J.S., Prescott S.A., Bartol T.M., Sejnowski T.J. Imbalance of ionic conductances contributes to diverse symptoms of demyelination. Proc. Natl. Acad. Sci. USA. 2010;107:20602–20609. doi: 10.1073/pnas.1013798107.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ 58.0 58.1 Coggan J.S., Ocker G.K., Sejnowski T.J., Prescott S.A. Explaining pathological changes in axonal excitability through dynamical analysis of conductance-based models. J. Neural Eng. 2011;8 doi: 10.1088/1741-2560/8/6/065002. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ 59.0 59.1 59.2 Coggan J.S., Prescott S.A., Sejnowski T.J. Cooperativity between remote sites of ectopic spiking allows afterdischarge to be initiated and maintained at different locations. J. Comput. Neurosci. 2015;39:17–28. doi: 10.1007/s10827-015-0562-8. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ 60.0 60.1 Aon M.A., Cortassa S., Akar F.G., Brown D.A., Zhou L., O’Rourke B. From mitochondrial dynamics to arrhythmias. Int. J. Biochem. Cell Biol. 2009;41:1940–1948. doi: 10.1016/j.biocel.2009.02.016. [PMC free article][PubMed] [CrossRef] [Google Scholar]
- ↑ 61.0 61.1 Su K., Bourdette D., Forte M. Mitochondrial dysfunction and neurodegeneration in multiple sclerosis. Front. Physiol. 2013;4doi: 10.3389/fphys.2013.00169. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Soltesz I., Staley K. Computational Neuroscience in Epilepsy. 1st ed. Elsevier; London, UK: 2008. [Google Scholar]
- ↑ Hodgkin A.L., Huxley A.F. The components of membrane conductance in the giant axon of Loligo. J. Physiol. 1952;116:473–496. doi: 10.1113/jphysiol.1952.sp004718. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Hodgkin A.L., Huxley A.F. Currents carried by sodium and potassium ions through the membrane of the giant axon of Loligo. J. Physiol. 1952;116:449–472. doi: 10.1113/jphysiol.1952.sp004717. [PMC free article] [PubMed]
- ↑ Fitzhugh R. Computation of impulse initiation and saltatory conduction in a myelinated nerve fiber. Biophys. J. 1962;2:11–21. doi: 10.1016/S0006-3495(62)86837-4. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Goldman L., Albus J.S. Computation of impulse conduction in myelinated fibers; theoretical basis of the velocity-diameter relation. Biophys. J. 1968;8:596–607. doi: 10.1016/S0006-3495(68)86510-5. [PMC free article][PubMed] [CrossRef] [Google Scholar]
- ↑ Frankenhaeuser B., Huxley A.F. The action potential in the myelinated nerve fiber of Xenopus laevis as computed on the basis of voltage clamp data. J. Physiol. 1964;171:302–315. doi: 10.1113/jphysiol.1964.sp007378.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Smith R.S., Koles Z.J. Myelinated nerve fibers: Computed effect of myelin thickness on conduction velocity. Am. J. Physiol. 1970;219:1256–1258.[PubMed] [Google Scholar]
- ↑ Hutchinson N.A., Koles Z.J., Smith R.S. Conduction velocity in myelinated nerve fibres of Xenopus laevis. J. Physiol. 1970;208:279–289. doi: 10.1113/jphysiol.1970.sp009119. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Koles Z.J., Rasminsky M. A computer simulation of conduction in demyelinated nerve fibres. J. Physiol. 1972;227:351–364. doi: 10.1113/jphysiol.1972.sp010036. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Hardy W.L. Propagation speed in myelinated nerve. II. Theoretical dependence on external Na and on temperature. Biophys. J. 1973;13:1071–1089. doi: 10.1016/S0006-3495(73)86046-1. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Schauf C.L., Davis F.A. Impulse conduction in multiple sclerosis: A theoretical basis for modification by temperature and pharmacological agents. J. Neurol. Neurosurg. Psychiatry. 1974;37:152–161. doi: 10.1136/jnnp.37.2.152.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Brill M.H., Waxman S.G., Moore J.W., Joyner R.W. Conduction velocity and spike configuration in myelinated fibres: Computed dependence on internode distance. J. Neurol. Neurosurg. Psychiatry. 1977;40:769–774. doi: 10.1136/jnnp.40.8.769. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Waxman S.G., Brill M.H. Conduction through demyelinated plaques in multiple sclerosis: Computer simulations of facilitation by short internodes. J. Neurol. Neurosurg. Psychiatry. 1978;41:408–416. doi: 10.1136/jnnp.41.5.408.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Wood S.L., Waxman S.G., Kocsis J.D. Conduction of trans of impulses in uniform myelinated fibers: Computed dependence on stimulus frequency. Neuroscience. 1982;7:423–430. doi: 10.1016/0306-4522(82)90276-7. [PubMed] [CrossRef] [Google Scholar]
- ↑ Goldfinger M.D. Computation of high safety factor impulse propagation at axonal branch points. Neuroreport. 2000;11:449–456. doi: 10.1097/00001756-200002280-00005. [PubMed] [CrossRef] [Google Scholar]
- ↑ 77.0 77.1 Blight A.R. Computer simulation of action potentials and afterpotentials in mammalian myelinated axons: The case for a lower resistance myelin sheath. Neuroscience. 1985;15:13–31. doi: 10.1016/0306-4522(85)90119-8. [PubMed] [CrossRef] [Google Scholar]
- ↑ 78.0 78.1 Halter J.A., Clark J.W., Jr. A distributed-parameter model of the myelinated nerve fiber. J. Theor. Biol. 1991;148:345–382. doi: 10.1016/S0022-5193(05)80242-5. [PubMed] [CrossRef] [Google Scholar]
- ↑ Schwarz J.R., Eikhof G. Na currents and action potentials in rat myelinated nerve fibres at 20 and 37 °C. Pflugers Arch. 1987;409:569–577. doi: 10.1007/BF00584655. [PubMed] [CrossRef] [Google Scholar]
- ↑ 80.0 80.1 Stephanova D.I. Myelin as longitudinal conductor: A multi-layered model of the myelinated human motor nerve fibre. Biol. Cybern. 2001;84:301–308. doi: 10.1007/s004220000213. [PubMed] [CrossRef] [Google Scholar]
- ↑ 81.0 81.1 McIntyre C.C., Richardson A.G., Grill W.M. Modeling the excitability of mammalian nerve fibers: Influence of afterpotentials on the recovery cycle. J. Neurophysiol. 2002;87:995–1006. [PubMed] [Google Scholar]
- ↑ 82.0 82.1 Einziger P.D., Livshitz L.M., Mizrahi J. Generalized cable equation model for myelinated nerve fiber. IEEE Trans. Biomed. Eng. 2005;52:1632–1642. doi: 10.1109/TBME.2005.856031. [PubMed] [CrossRef] [Google Scholar]
- ↑ Volman V., Ng L. Primary paranode demyelination modulates slowly developing axonal depolarization in a model of axonal injury. J. Neural Comput. 2014;37:439–457. [PubMed] [Google Scholar]
- ↑ Stephanova D.I., Bostock H. A Distributed-parameter model of the myelinated human motor nerve fibre: Temporal and spatial distributions of action potentials and ionic currents. Biol. Cybern. 1995;73:275–280. doi: 10.1007/BF00201429. [PubMed] [CrossRef] [Google Scholar]
- ↑ Chiu S.Y., Ritchie J.M. On the physiological role of internodal potassium channels and the security of conduction in myelinated nerve fibres. Proc. R. Soc. Lond. B Biol. Sci. 1984;220:415–422. doi: 10.1098/rspb.1984.0010.[PubMed] [CrossRef] [Google Scholar]
- ↑ Brismar T., Schwarz J.R. Potassium permeability in rat myelinated nerve fibres. Acta Physiol. Scand. 1985;124:141–148. doi: 10.1111/j.1748-1716.1985.tb07645.x. [PubMed] [CrossRef] [Google Scholar]
- ↑ Chiu S.Y., Schwarz W. Sodium and potassium currents in acutely demyelinated internodes of rabbit sciatic nerves. J. Physiol. 1987;391:631–649. doi: 10.1113/jphysiol.1987.sp016760. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Baker M., Bostock H., Grafe P., Martius P. Function and distribution of three types of rectifying channel in rat spinal root myelinated axons. J. Physiol. 1987;383:45–67. [PMC free article] [PubMed] [Google Scholar
- ↑ Röper J., Schwarz J.R. Heterogeneous distribution of fast and slow potassium channels in myelinated rat nerve fibres. J. Physiol. 1989;416:93–110. doi: 10.1113/jphysiol.1989.sp017751. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Bittner S., Meuth S.G. Targeting ion channels for the treatment of autoimmune neuroinflammation. Ther. Adv. Neurol. Disord. 2013;6:322–336. doi: 10.1177/1756285613487782. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Waxman S.G., Ritchie J.M. Molecular dissection of the myelinated axon. Ann. Neurol. 1993;33:121–136. doi: 10.1002/ana.410330202. [PubMed] [CrossRef] [Google Scholar]
- ↑ Bittner S., Budde T., Wiendl H., Meuth S.G. From the background to the spotlight: TASK channels in pathological conditions. Brain Pathol. 2010;20:999–1009. doi: 10.1111/j.1750-3639.2010.00407.x. [PMC free article][PubMed] [CrossRef] [Google Scholar]
- ↑ Ehling P., Bittner S., Budde T., Wiendl H., Meuth S.G. Ion channels in autoimmune neurodegeneration. FEBS Lett. 2011;585:3836–3842. doi: 10.1016/j.febslet.2011.03.065. [PubMed] [CrossRef] [Google Scholar]
- ↑ 94.0 94.1 Hübel N., Dahlem M.A. Dynamics from seconds to hours in Hodgkin-Huxley model with time-dependent ion concentrations and buffer reservoirs. PLoS Comput. Biol. 2014;10:e1003941. doi: 10.1371/journal.pcbi.1003941.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Ganapathy L., Clark J.W. Extracellular currents and potentials of the active myelinated nerve fibre. Biophys. J. 1987;52:749–761. doi: 10.1016/S0006-3495(87)83269-1. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Prescott S.A. Pathological changes in peripheral nerve excitability. In: Jaeger D., Jung R., editors. Encyclopedia of Computational Neurosci. 1st ed. Springer-Verlag; New York, NY, USA: 2015. [Google Scholar]
- ↑ Barrett E.F., Barrett J.N. Intracellular recording from vertebrate myelinated axons: Mechanism of the depolarizing afterpotential. J. Physiol. 1982;323:117–144. doi: 10.1113/jphysiol.1982.sp014064. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Blight A.R., Someya S. Depolarizing afterpotentials in myelinated axons of mammalian spinal cord. Neuroscience. 1985;15:1–12. doi: 10.1016/0306-4522(85)90118-6. [PubMed] [CrossRef] [Google Scholar]
- ↑ Richardson A.G., McIntyre C.C., Grill W.M. Modelling the effects of electric fields on nerve fibres: Influence of the myelin sheath. Med. Biol. Eng. Comput. 2000;38:438–446. doi: 10.1007/BF02345014. [PubMed] [CrossRef] [Google Scholar]
- ↑ Zlochiver S. Persistent reflection underlies ectopic activity in multiple sclerosis: A numerical study. Biol. Cybern. 2010;102:181–196. doi: 10.1007/s00422-009-0361-2. [PubMed] [CrossRef] [Google Scholar]
- ↑ Ratté S., Zhu Y., Lee K.Y., Prescott S.A. Criticality and degeneracy in injury-induced changes in primary afferent excitability and the implications for neuropathic pain. Elife. 2014;3:e02370. doi: 10.7554/eLife.02370.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Zhu Y., Feng B., Schwartz E.S., Gebhart G.F., Prescott S.A. Novel method to assess axonal excitability using channelrhodopsin-based photoactivation. J. Neurophysiol. 2015;113:2242–2249. doi: 10.1152/jn.00982.2014.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Tagoe T., Barker M., Jones A., Allcock N., Hamann M. Auditory nerve perinodal dysmyelination in noise-induced hearing loss. J. Neurosci. 2014;12:2684–2688. doi: 10.1523/JNEUROSCI.3977-13.2014.
- ↑ Brown A.M., Hamann M. Computational modeling of the effects of auditory nerve dysmyelination. Front. Neuroanat. 2014;8doi: 10.3389/fnana.2014.00073. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Stephanova D.I., Daskalova M. Electrotonic potentials in simulated chronic inflammatory demyelinating polyneuropathy at 20 °C–42 °C. J. Integr. Neurosci. 2015;27:1–18. doi: 10.1142/S0219635215500119. [PubMed] [CrossRef] [Google Scholar]
- ↑ Rasminsky M. Hyperexcitability of pathologically myelinated axons and positive symptoms in multiple sclerosis. Adv. Neurol. 1981;31:289–297.[PubMed] [Google Scholar]
- ↑ Ulrich J., Groebke-Lorenz W. The optic nerve in multiple sclerosis: A morphological study with retrospective clinicopathological correlation. Neuro-Ophthalmology. 1983;3:149–159. doi: 10.3109/01658108309009732.[CrossRef] [Google Scholar]
- ↑ Yu N., Morris C.E., Joós B., Longtin A. Spontaneous excitation patterns computed for axons with injury-like impairments of sodium channels and Na/K pumps. PLoS Comput. Biol. 2012;8:e1002664. doi: 10.1371/journal.pcbi.1002664. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Lopreore C.L., Bartol T.M., Coggan J.S., Keller D.X., Sosinsky G.E., Ellisman M.H., Sejnowski T.J. Computational modeling of three-dimensional electrodiffusion in biological systems: Application to the node of Ranvier. Biophys. J. 2008;95:2624–2635. doi: 10.1529/biophysj.108.132167.
- ↑ Broome T.M., Cole.man R.A. A mathematical model of cell death in multiple sclerosis. J. Neurosci. Methods. 2011;201:420–425. doi: 10.1016/j.jneumeth.2011.08.008. [PubMed] [CrossRef] [Google Scholar]
- ↑ Ridsdale R.A., Beniac D.R., Tompkins T.A., Moscarello M.A., Harauz G. Three-dimensional structure of myelin basic protein. II. Molecular modeling and considerations of predicted structures in multiple sclerosis. J. Biol. Chem. 1997;272:4269–4275. doi: 10.1074/jbc.272.7.4269. [PubMed] [CrossRef] [Google Scholar]
- ↑ Pigozzo A.B., Macedo G.C., Santos R.W., Lobosco M. On the computational modeling of the innate immune system. BMC Bioinform. 2013;14 doi: 10.1186/1471-2105-14-S6-S7. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Doerck S., Göbel K., Weise G., Schneider-Hohendorf T., Reinhardt M., Hauff P., Schwab N., Linker R., Mäurer M., Meuth S.G., et al. Temporal pattern of ICAM-I mediated regulatory T cell recruitment to sites of inflammation in adoptive transfer model of multiple sclerosis. PLoS ONE. 2010;5:e15478. doi: 10.1371/journal.pone.0015478. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ De Mendizábal N.V., Carneiro J., Solé R.V., Goñi J., Bragard J., Martinez-Forero I., Martinez-Pasamar S., Sepulcre J., Torrealdea J., Bagnato F., et al. Modeling the effector-regulatory T cell cross-regulation reveals the intrinsic character of relapses in Multiple Sclerosis. BMC Syst. Biol. 2011;5doi: 10.1186/1752-0509-5-114. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Jolivet R., Coggan J.S., Allaman I., Magistretti P.J. Multi-timescale modeling of activity-dependent metabolic coupling in the neuron-glia-vasculature ensemble. PLoS Comput. Biol. 2015;11:e1004036. doi: 10.1371/journal.pcbi.1004036. [PMC free article] [PubMed] [CrossRef]
- ↑ Zeis T., Allaman I., Gentner M., Schroder K., Tschopp J., Magistretti P.J., Schaeren-Wiemers N. Metabolic gene expression changes in astrocytes in Multiple Sclerosis cerebral cortex are indicative of immune-mediated signaling. Brain Behav. Immun. 2015;48:315–325. doi: 10.1016/j.bbi.2015.04.013.[PubMed] [CrossRef] [Google Scholar]








