Difference between revisions of "Physiologische Dynamik bei demyelinisierenden Krankheiten: Enträtseln komplexer Zusammenhänge durch Computermodellierung"
Tags: Mobile web edit Mobile edit Visual edit |
Tags: Mobile web edit Mobile edit Visual edit |
||
| (12 intermediate revisions by the same user not shown) | |||
| Line 45: | Line 45: | ||
Additional article information | Additional article information | ||
== | == Abstrakt == | ||
Trotz intensiver Forschung stehen für die meisten neurologischen Erkrankungen nur wenige Behandlungen zur Verfügung. Demyelinisierende Erkrankungen sind keine Ausnahme. Dies ist vielleicht nicht überraschend angesichts der multifaktoriellen Natur dieser Krankheiten, die komplexe Wechselwirkungen zwischen Zellen des Immunsystems, Glia und Neuronen umfassen. Bei Multipler Sklerose zum Beispiel herrscht unter Forschern Uneinigkeit über die Ursache oder gar welches System oder welcher Zelltyp Ground Zero sein könnte. Diese Situation schließt die Entwicklung und strategische Anwendung mechanismusbasierter Therapien aus. Wir werden diskutieren, wie Computermodellierung, die auf Fragen auf verschiedenen biologischen Ebenen angewendet wird, dabei helfen kann, unterschiedliche Beobachtungen miteinander zu verknüpfen und komplexe Mechanismen zu entschlüsseln, deren Lösungen einem einfachen Reduktionismus nicht zugänglich sind. Indem sie überprüfbare Vorhersagen treffen und kritische Lücken im vorhandenen Wissen aufdecken, können solche Modelle die Forschung unterstützen und einen rigorosen Rahmen bieten, in den neue Daten integriert werden können, sobald sie gesammelt werden. Heutzutage gibt es keinen Mangel an Daten; Die Herausforderung besteht darin, dem Ganzen einen Sinn zu geben. In dieser Hinsicht ist die Computermodellierung ein unschätzbares Werkzeug, das letztendlich unser Verständnis, die Diagnose und Behandlung von demyelinisierenden Krankheiten verändern könnte. | |||
Schlüsselwörter: Myelin, Demyelinisierung, Multiple Sklerose, neurodegenerative Erkrankung, Computermodell, Wirkstoffforschung | |||
== Einführung == | |||
Die Nervensysteme von Wirbeltieren werden aufgrund ihres Aussehens und der entsprechenden funktionellen Rollen oft in graue und weiße Substanz unterteilt. Während die graue Substanz größtenteils aus Zellkörpern und Dendriten besteht, enthält die weiße Substanz hauptsächlich Axone und hat ihren Namen von den Lipidmembranschichten namens Myelin, die eng um diese Axone gewickelt sind.<ref>Virchow R. Uber das ausgebreitete Vorkommen einer dem Nervenmark analogen Substanz in den tierischen Geweben. Virchows Arch. Pathol. Anat. 1854;6:562–572. doi: 10.1007/BF02116709. [CrossRef] [Google Scholar]</ref> Myelin stammt aus verschiedenen Klassen von Gliazellen, die als Oligodendrozyten im Zentralnervensystem (ZNS) und Schwann-Zellen im peripheren Nervensystem (PNS) bezeichnet werden. | |||
Die durch die Myelinschichten bereitgestellte elektrische Isolierung verbessert die axonale Funktion, indem sie sowohl die Energieeffizienz als auch die Leitungsgeschwindigkeit von Aktionspotentialen (APs) erhöht. Diese beiden Funktionen haben möglicherweise ihre relative Bedeutung während der Evolution geändert.<ref>Stiefel K.M., Torben-Nielsen B., Coggan J.S. Proposed evolutionary changes in the role of myelin. Front. Neurosci. 2013;8 doi: 10.3389/fnins.2013.00202.[PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> Myelin tauchte erstmals im Ordovizium (485 bis 443 ma oder Millionen Jahre vor der Gegenwart) auf, nachdem sich die Vorfahren der Neunaugen und Schleimaale von den übrigen Wirbeltierlinien abgespalten hatten.<ref>Bullock T.H., Moore J.K., Fields R.D. Evolution of myelin sheaths: Both lamprey and hagfish lack myelin. Neurosci. Lett. 1984;48:145–148. doi: 10.1016/0304-3940(84)90010-7. [PubMed] [CrossRef] [Google Scholar]</ref>Mit einigen interessanten Ausnahmen,<ref>Davis A.D., Weatherby T.M., Hartline D.K., Lenz P.H. Myelin-like sheaths in copepod axons. Nature. 1999;398:571–571. doi: 10.1038/19212. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Hartline D.K., Colman D.R. Rapid conduction and the evolution of giant axons and myelinated fibers. Curr. Biol. 2007;17:R29–R35. doi: 10.1016/j.cub.2006.11.042. [PubMed] [CrossRef] [Google Scholar]</ref> Myelin oder analoge Strukturen kommen in allen Wirbeltieren vor und sind entscheidend für das reibungslose Funktionieren ihres Nervensystems. Der ungefähre Zeitpunkt der Entwicklung von Myelin kann aus der bekannten Zeit der Divergenz zwischen Akkordaten ohne (Agnatha) und mit (alle anderen Wirbeltiere) Myelin abgeleitet werden. | |||
Die Myelinumhüllung wird durch regelmäßig beabstandete, nicht myelinisierte Abschnitte unterbrochen, die als Ranvier-Knoten bekannt sind. Myelin beschleunigt die Leitung, indem es den transmembranen Ladungsfluss durch Ionenkanäle innerhalb der Knoten einschränkt. Innerhalb der sogenannten Internodien fließt Strom das Axon hinunter, wobei nur wenig davon durch die isolierte Zellmembran fließt. Das AP wird an jedem Knoten regeneriert, an dem die Dichte der spannungsgesteuerten Natrium- und Kaliumkanäle sehr hoch ist. Dieser Vorgang wird als „saltatorische Leitung“ bezeichnet, da der AP scheinbar von Knoten zu Knoten springt. Störungen in diesem Schnellfeuer-Kommunikationssystem können mit einer Reihe von Funktionsstörungen des Nervensystems in Verbindung gebracht werden.<ref>Arancibia-Carcamo I.L., Attwell D. The node of ranvier in CNS pathology. Acta Neuropathol. 2014;128:161–175. doi: 10.1007/s00401-014-1305-z.[PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> | |||
Axone scheinen in mehrfacher Hinsicht an physikalischen Grenzen zu operieren. Ein interessantes Beispiel ist, dass die Größe von Axonen durch das thermische Rauschen beschränkt zu sein scheint, das Ionenkanalproteinen innewohnt; Jedes Axon, das dünner als 0,1 μm ist, wäre aufgrund seines hohen Rauschpegels für die Informationsübertragung unbrauchbar.<ref>Faisal A.A., White J.A., Laughlin S.B. Ion-channel noise places limits on the miniaturization of the brain’s wiring. Curr. Biol. 2005;15:1143–1149. doi: 10.1016/j.cub.2005.05.056. [PubMed] [CrossRef] [Google Scholar]</ref> Interessanterweise ist 0,1 μm auch ungefähr der kleinste Axondurchmesser, der in Nervensystemen beobachtet wird [7]. Diese und ähnliche Ergebnisse deuten darauf hin, dass Axone und ihre Unterstrukturen fein abgestimmte biologische Geräte sind, dass die Abstimmung jedoch offensichtlich unter pathologischen Bedingungen gestört werden kann.<ref>Babbs C.F., Riyi S. Subtle paranodal injury slows impulse conduction in a mathematical model of myelinated axons. PLoS ONE. 2013;8:e67767. doi: 10.1371/journal.pone.0067767. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> | |||
Die Demyelinisierung setzt funktionelle Veränderungen in Gang, die für klinische Merkmale wichtig sind, aber nicht ohne weiteres durch immunologische oder radiologische Veränderungen erklärt werden können. Die Lage einer Plaque sagt voraus, welches System betroffen sein wird (motorisch vs. sensorisch, visuell vs. taktil), aber nicht, wie es betroffen sein wird. Dies unterstreicht die Bedeutung der Beurteilung der Funktion (zusätzlich zur Struktur) und wie sie sich nach der Demyelinisierung verändert. Nach der Einführung demyelinisierender Krankheiten werden wir erörtern, wie die klinischen Manifestationen dieser Krankheiten verschiedene pathologische Veränderungen der Axonfunktion widerspiegeln. Wir werden argumentieren, dass das Verständnis dieser Veränderungen und die vollständige Nutzung dieses Verständnisses für diagnostische und therapeutische Zwecke enorm von der Computermodellierung profitieren können. | |||
== | == Demyelinisierende Krankheiten == | ||
[[File:Jay S. Coggan1.jpeg|thumb|Abbildung 1: Demyelinisierende Erkrankungen des peripheren Nervensystems (PNS). ('''A''') Primäre demyelinisierende Polyneuropathien und ('''B''') Polyneuropathien mit Axonschädigung. Abkürzungen: CMT 1, 2 und 4: Charcot-Marie-Tooth-Krankheit; CMTX: X-chromosomale Charcot-Marie-Tooth-Erkrankung; HNPP: erbliche Neuropathie mit Neigung zu Drucklähmungen; AIDP: akute entzündliche demyelinisierende Polyneuropathie; GBS: Guillain-Barré-Syndrom. CIDP: chronisch entzündliche demyelinisierende Polyneuropathie; MGUS: monoklonale Gammopathie unbestimmter Bedeutung; POEMS: Polyneuropathie, Organomegalie, Endokrinopathie oder Ödem M-Protein und Hautanomalien; HSAN I–IV: hereditäre sensorische und autonome Neuropathie.|500x500px]]Es gibt eine große Anzahl demyelinisierender Erkrankungen, die sowohl das PNS (Abbildung 1) als auch das ZNS (Abbildung 2) betreffen. Die Ätiologien sind heterogen und reichen von genetischen Störungen bis hin zu metabolischen, infektiösen oder Autoimmunmechanismen. Multiple Sklerose (MS) ist mit schätzungsweise 3 Millionen Patienten weltweit die am weitesten verbreitete dieser Erkrankungen. Die zugrunde liegende Ursache ist ungewiss, es wird jedoch angenommen, dass sie eine genetische Veranlagung für Umwelteinflüsse beinhaltet<ref name=":0">Trapp B.D., Nave K.A. Multiple sclerosis: An immune or neurodegenerative disorder? Annu. Rev. Neurosci. 2008;31:247–69. doi: 10.1146/annurev.neuro.30.051606.094313. [PubMed] [CrossRef] [Google Scholar]</ref><ref name=":1">Compston A., Coles A. Multiple sclerosis. Lancet. 2008;372:1502–1517. doi: 10.1016/S0140-6736(08)61620-7. [PubMed] [CrossRef] [Google Scholar]</ref>und kann immunologische, Reaktionsfähigkeit auf Traumata, biophysikalische, genetische und/oder metabolische Komponenten umfassen.<ref name=":1" />Die Symptome und Läsionen müssen zeitlich und räumlich vielfältig sein. Das heißt, es müssen zeitlich mehrere Episoden auftreten, an denen getrennte Teile des zentralen Nervensystems beteiligt sind. Es ist nicht klar, ob die entzündliche Demyelinisierung ein primäres oder sekundäres Ereignis innerhalb des Krankheitsprozesses ist.<ref name=":0" /><ref>Ostermann P.O., Westerberg C.E. Paroxysmal attacks in multiple sclerosis. Brain. 1975;98:189–202. doi: 10.1093/brain/98.2.189. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Twomey J.A., Espir M.L. Paroxysmal symptoms as the first manifestations of multiple sclerosis. J. Neurol. Neurosurg. Psychiatry. 1980;43:296–304. doi: 10.1136/jnnp.43.4.296. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> Die meisten Behandlungen zielen auf das Immunsystem oder die Blut-Hirn-Schranke ab, aber auch die Behandlung neurologischer Symptome durch Modulation der axonalen Erregbarkeit spielt eine wichtige Rolle (siehe unten).. | |||
[[File:Jay S. Coggan 2.jpeg|left|thumb|Abbildung 2: Demyelinisierende Erkrankungen des Zentralnervensystems (ZNS). Abkürzungen: MS: Multiple Sklerose; ADEM: akute disseminierte Enzephalomyelitis; HIV: menschliches Immunschwächevirus; PML: progressive multifokale Leukenzephalopathie; HTLV-1: menschliches T-lymphotropes Virus 1; PRES: posteriores reversibles Enzephalopathie-Syndrom.]] | |||
=== Klinische Bewertung von Multipler Sklerose === | |||
Die Symptome sind vielfältig und können bei einem einzelnen Patienten in allen Kombinationen auftreten. Die Diagnose erfordert, dass im Laufe der Zeit mehrere Läsionen und symptomatische Episoden vorliegen müssen, an denen nicht verbundene Teile des ZNS beteiligt sind. Darüber hinaus neigen die Symptome dazu, schlecht mit radiologischen Messungen zu korrelieren. In den allermeisten Fällen korrelieren individuelle klinische Merkmale nicht gut mit MRT-Befunden, insbesondere bei zerebralen Läsionen.<ref>Seewann A., Vrenken H., van der Valk P., Blezer E.L., Knol D.L., Castelijns J.A., Polman C.H., Pouwels P.J., Barkhof F., Geurts J.J. Diffusely abnormal white matter in chronic multiple sclerosis: Imaging and histopathologic analysis. Arch. Neurol. 2009;66:601–609. doi: 10.1001/archneurol.2009.57. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Ceccarelli A., Bakshi R., Neema M. MRI in multiple sclerosis: A review of the current literature. Curr. Opin. Neurol. 2012;25:402–409. doi: 10.1097/WCO.0b013e328354f63f. [PubMed] [CrossRef] [Google Scholar]</ref><ref name=":2">Moore J.W., Joyner R.W., Brill M.H., Waxman S.D., Najar-Joa M. Simulations of conduction in uniform myelinated fibers. Relative sensitivity to changes in nodal and internodal parameters. Biophys. J. 1978;21:147–160. doi: 10.1016/S0006-3495(78)85515-5. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> Diese klinisch-radiologische Dissoziation verlangt nach einem besseren theoretischen Verständnis der Demyelinisierungssymptome und der zugrunde liegenden biophysikalischen Veränderungen, die sie begleiten, was natürlich die Frage aufwirft, was genau mit den betroffenen Axonen passiert. | |||
Die Symptome sind oft intermittierend und können sowohl Funktionsverlust (negative Symptome wie Taubheitsgefühl, Muskelschwäche, Kribbeln, Blindheit, Inkontinenz, Verlust der Sexualfunktion, Gleichgewichtsverlust, undeutliche Sprache, Verstopfung, beeinträchtigende Müdigkeit, Depression, kognitive Dysfunktion) umfassen , Unfähigkeit zu schlucken, Gangstörungen und Verlust der Atemkontrolle) und Funktionsgewinn (unter anderem positive Symptome wie Krämpfe, Spastik, Krämpfe, Schmerzen, verschwommenes oder doppeltes Sehen, Harndrang oder Zögern, Übelkeit)..<ref>Waxman S.G., Kocsis J.D., Stys P.K. The Axon: Structure, Function and Pathophysiology. Oxford University Press; New York, NY, USA: 1995. [Google Scholar]</ref>Frühe differenzialdiagnostische Kriterien sind das Lhermitte-Zeichen (Halsbeugegefühle) und das Uhthoff-Phänomen (temperaturabhängige Verschlechterung der Beschwerden). Die Differenzialdiagnose der MS richtet sich eng nach den McDonald-Kriterien.<ref>Polman C.H., Reingold S.C., Banwell B., Clanet M., Cohen J.A., Filippi M., Fujihara K., Havrdova E., Hutchinson M., Kappos L., et al. Diagnostic criteria for multiple sclerosis: 2010 revisions to the McDonald criteria. Ann. Neurol. 2011;69:292–302. doi: 10.1002/ana.22366. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> | |||
In humandiagnostischen Studien zu visuell, sensorisch oder motorisch evozierten Potentialen (VEP, SEP, MEP) kann nur die Latenz oder Leitungsgeschwindigkeit genau gemessen werden (mit etwa 30–40 % Schwankungen zwischen verschiedenen Labors). Aber diese Messungen geben wenig Aufschluss über zugrunde liegende Mechanismen, die eine Verlangsamung oder Blockierung der Leitung beinhalten, oder morphologische oder funktionelle Faktoren wie Verzweigung, Demyelinisierung, Remyelinisierung, axonale Verjüngung (Abnahme der Querschnittsfläche), Dämpfung oder erneutes Wachstum, temperaturbedingte Änderungen der Leitung , oder Malpolarisation (Hyper oder Hypo). Nichtsdestotrotz kann die Art der demyelinisierenden Läsion Hinweise auf die Ätiologie geben und daher die Behandlung leiten; Beispielsweise scheinen genetische Faktoren stärker mit internodalen Krankheitsprozessen zu korrelieren, und immunologische Dysfunktionen verursachen paranodale Anomalien.<ref name=":3">Stephanova D.I., Dimitrov B. Computational Neuroscience: Simulated Demyelinating Neuropathies and Neuronopathies. CRC Press; Boca Raton, FL, USA: 2013. [Google Scholar]</ref> | |||
Eine Reihe von Tests werden routinemäßig verwendet, um die neurale Funktion zu beurteilen. Bei der Elektroneurographie wird ein kurzer elektrischer Stimulus an einer anatomisch vordefinierten Position an einen peripheren Nerv angelegt, um die Latenz und Amplitude des zusammengesetzten Aktionspotentials an einer anderen Stelle entlang des Nervs zu messen. Die Ergebnisse müssen in Kombination mit klinischen Befunden und Tests (z. B. Elektromyographie) interpretiert werden, aber es ist wichtig, dass verschiedene Krankheiten unterschiedliche Muster elektroneurographischer Veränderungen aufweisen. Dies ist nicht nur für diagnostische Zwecke wichtig, sondern kann auch auf spezifische pathologische Veränderungen der Axonfunktion hinweisen, die wiederum bei der Wahl der Therapie hilfreich sein könnten (wenn die Axonpathobiologie verstanden würde; siehe unten). Unter Verwendung von Threshold-Tracking wurde die Erregbarkeit beim Menschen für verschiedene periphere demyelinisierende Erkrankungen gemessen, darunter die Charcot-Marie-Tooth-Krankheit Typ 1A (CMT1A), die chronisch entzündliche demyelinisierende Polyneuropathie (CIDP), das Guillain-Barré-Syndrom (GBS) und die multifokale motorische Neuropathie (MMN). ).<ref name=":4">Bostock H., Baker M., Reid G. Changes in excitability of human motor axons underlying post-ischaemic fasciculations: Evidence for two stable states. J. Physiol. 1991;441:537–557. doi: 10.1113/jphysiol.1991.sp018766.[PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>Mogyoros I., Kiernan M.C., Burke D., Bostock H. Strength-duration properties of sensory and motor axons in amyotrophic lateral sclerosis. Brain. 1998;121:851–859. doi: 10.1093/brain/121.5.851. [PubMed] [CrossRef] [Google Scholar]</ref><ref name=":5">Kiernan M.C., Burke D., Andersen K.V., Bostock H. Multiple measures of axonal excitability: A new approach in clinical testing. Muscle Nerve. 2000;23:399–409. doi: 10.1002/(SICI)1097-4598(200003)23:3<399::AID-MUS12>3.0.CO;2-G. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Cappelen-Smith C., Kuwabara S., Lin C.S., Mogyoros I., Burke D. Membrane properties in chronic inflammatory demyelinating polyneuropathy. Brain. 2001;124:2439–2447. doi: 10.1093/brain/124.12.2439. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Kuwabara S., Ogawara K., Sung J.Y., Mori M., Kanai K., Hattori T., Yuki N., MLin C.S., Burke D., Bostock H. Differences in membrane properties of axonal and demyelinating Guillain-Barré syndromes. Ann. Neurol. 2002;52:180–187. doi: 10.1002/ana.10275. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Nodera H., Bostock H., Kuwabara S., Sakamoto T., Asanuma K., Jia-Ying S., Ogawara K., Hattori N., Hirayama M., Sobue G., et al. Nerve excitability properties in Charcot-Marie-Tooth disease type 1A. Brain. 2004;127:203–211. doi: 10.1093/brain/awh020. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Sung M.H., Simon R. In silico simulation of inhibitor drug effects on nuclear factor-κB pathway dynamics. Mol. Pharmacol. 2004;66:70–75. doi: 10.1124/mol.66.1.70. [PubMed] [CrossRef] [Google Scholar]</ref>Die Herausforderung liegt in der Interpretation dieser Beobachtungen. Zu diesem Zweck hat die Gruppe von Stephanova zunehmend größere Grade systematischer und fokaler Demyelinisierung von Motorfasern simuliert, um zu versuchen, die beobachteten physiologischen Veränderungen zu erklären<ref>Stephanova D.I., Daskalova M. Differences in potentials and excitability properties in simulated cases of demyelinating neuropathies. Part III. Paranodal internodal demyelination. Clin. Neurophysiol. 2005;116:2334–2341. doi: 10.1016/j.clinph.2005.07.013. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Stephanova D.I., Daskalova M.S. Differences between the channels, currents and mechanisms of conduction slowing/block and accommodative processes in simulated cases of focal demyelinating neuropathies. Eur. Biophys. J. 2008;37:829–842. doi: 10.1007/s00249-008-0284-1. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Stephanova D.I., Alexandrov A.S. Simulating mild systematic and focal demyelinating neuropathies: Membrane property abnormalities. J. Integr. Neurosci. 2006;5:595–623. doi: 10.1142/S0219635206001331. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Stephanova D.I., Daskalova M., Alexandrov A.S. Channels, currents and mechanisms of accommodative processes in simulated cases of systematic demyelinating neuropathies. Brain Res. 2007;1171:138–151. doi: 10.1016/j.brainres.2007.07.029. [PubMed] [CrossRef] [Google Scholar]</ref><ref name=":6">Stephanova D.I., Krustev S.M., Negrev N., Daskalova M. The myelin sheath aqueous layers improve the membrane properties of simulated chronic demyelinating neuropathies. J. Integr. Neurosci. 2011;10:105–120. doi: 10.1142/S0219635211002646. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Stephanova D.I., Alexandrov A.S., Kossev A., Christova L. Simulating focal demyelinating neuropathies: Membrane property abnormalities. Biol. Cybern. 2007;96:195–208. doi: 10.1007/s00422-006-0113-5. [PubMed] [CrossRef] [Google Scholar]</ref> (siehe Abschnitt „Modellierung“ weiter unten). | |||
=== | === Beteiligung von Zellkörpern === | ||
Die Progression von schubförmig remittierender MS (RRMS) zur sekundär progredienten MS (SPMS) ist mit einer stärkeren Beteiligung der Pathologie der grauen Substanz verbunden, obwohl eine Beteiligung der Axone/der grauen Substanz bereits in frühen Krankheitsstadien beobachtet werden kann.<ref>Bø L., Geurts J.J., Mörk S.J., van der Valk P. Grey matter pathology in multiple sclerosis. Acta Neurol. Scand. Suppl. 2006;183:48–50. doi: 10.1111/j.1600-0404.2006.00615.x. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Geurts J.J., Barkhof F. Grey matter pathology in multiple sclerosis. Lancet Neurol. 2008;7:841–851. doi: 10.1016/S1474-4422(08)70191-1. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Zivadinov R., Pirko I. Advances in understanding gray matter pathology in multiple sclerosis: Are we ready to redefine disease pathogenesis? BMC Neurol. 2012;12 doi: 10.1186/1471-2377-12-9. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>Popescu B.F., Lucchinetti C.F. Pathology of demyelinating diseases. Annu. Rev. Pathol. 2012;7:185–217. doi: 10.1146/annurev-pathol-011811-132443.[PubMed] [CrossRef] [Google Scholar]</ref> Die Schädigung der grauen Substanz gilt als zugrunde liegender Mechanismus des Krankheitsverlaufs und der dauerhaften Behinderung bei MS-Patienten und wird durch den Verlust der Hirnparenchymfraktion oder des Gehirnvolumens durch MRT oder klinisch durch Progression auf der erweiterten Behinderungsstatusskala (EDSS) gemessen.<ref>Kurtzke J.F., Beebe G.W., Nagler B., Nefzger M.D., Auth T.L., Kurland L.T. Studies on the natural history of multiple sclerosis: V. Long-term survival in young men. Arch. Neurol. 1970;22:215–225. doi: 10.1001/archneur.1970.00480210025003. [PubMed] [CrossRef] [Google Scholar]</ref>Der Übergang von RRMS zu SPMS ist ein Vorzeichen für den Mangel an Therapeutika zur Bekämpfung der verschlimmerten körperlichen und kognitiven Verschlechterung, mit der die meisten SPMS-Patienten konfrontiert sind.<ref name=":0" /><ref>Rao S.M., Leo G.J., Bernardin L., Unverzagt F. Cognitive dysfunction in multiple sclerosis. I. Frequency, patterns, and prediction. Neurology. 1991;41:685–691. doi: 10.1212/WNL.41.5.685. [PubMed] [CrossRef] [Google Scholar]</ref> | |||
==== Behandlung ==== | |||
Die wichtigsten Eingriffe bei MS umfassen die Modulation der Immunantwort mit beispielsweise Methly-Prednisolon, Interferon betas, Glatirameracetat oder Fingolimod oder die Verhinderung der Überquerung der BHS durch Entzündungszellen (monoklonale Antikörper, z. B. Tysabri (Anti-α4-Integrin, Natalizumab )). Vor kurzem wurden die ersten beiden oralen Wirkstoffe (Fumarat und Teriflunomid) sowie der gegen CD52 gerichtete Antikörper Natalizumab für die Behandlung von RRMS zugelassen, die erfolgreich mit Erstlinientherapien wie Interferonen, Glatirameracetat oder Fingolimod oder durch behandelt werden kann Zweitlinientherapien, aber progressive Formen (PPMS, SPMS) stellen immer noch einen ungedeckten biomedizinischen Bedarf dar.<ref>Meuth S.G., Bittner S., Ulzheimer J.C., Kleinschnitz C., Kieseier B.C., Wiendl H. Therapeutic approaches to multiple sclerosis: An update on failed, interrupted, or inconclusive trials of neuroprotective and alternative treatment strategies. BioDrugs. 2010;24:317–330. doi: 10.2165/11537190-000000000-00000. [PubMed] [CrossRef] [Google Scholar]</ref> Antineoplastika werden in extrem fortgeschrittenen oder schwierigen Fällen eingesetzt.<ref>Goldenberg M.M. Multiple sclerosis review. Pharm. Ther. 2012;37:137–139.[PMC free article] [PubMed] [Google Scholar]</ref> | |||
Krankheitsmodifizierende Medikamente sind entscheidend, um den Demyelinisierungsprozess zu stoppen oder zumindest abzuschwächen, aber ebenso wichtig ist es, die Symptome zu behandeln, die sich aus einer bereits aufgetretenen Demyelinisierung ergeben. Die Ionenkanalmodulation wird mit dem Aufkommen neuer Ionenkanalblocker wie Ampyra (K-Kanal-Blockade) zunehmend vielversprechend.<ref>Göbel K., Wedell J.H., Herrmann A.M., Wachsmuth L., Pankratz S., Bittner S., Budde T., Kleinschnitz C., Faber C., Wiendl H., et al. 4-Aminopyridine ameliorates mobility but not disease course in an animal model of multiple sclerosis. Exp. Neurol. 2013;248:62–71. doi: 10.1016/j.expneurol.2013.05.016.[PubMed] [CrossRef] [Google Scholar]</ref><ref>Krishnan A.V., Kiernan M.C. Sustained-release fampridine and the role of ion channel dysfunction in multiple sclerosis. Mult. Scler. 2013;19:385–391. doi: 10.1177/1352458512463769. [PubMed] [CrossRef] [Google Scholar]</ref> Die Kaliumkanalblockade soll die Erregbarkeit von Axonen verbessern. Das Problem ist, dass solche Eingriffe, obwohl sie bei der Behandlung negativer Symptome und der Wiederherstellung der Funktion wirksam sind, dazu neigen, positive Symptome zu verschlimmern.<ref>Bowe C.M., Kocsis J.D., Targ E.F., Waxman S.G. Physiological effects of 4-aminopyridine on demyelinated mammalian motor and sensory fibers. Ann. Neurol. 1987;22:264–268. doi: 10.1002/ana.410220212. [PubMed] [CrossRef] [Google Scholar]</ref> Umgekehrt kann die Behandlung positiver Symptome wie Spasmen mit Antiepileptika wie beispielsweise Carbamazepin negative Symptome verstärken.<ref>Sakurai M., Kanazawa I. Positive symptoms in multiple sclerosis: Their treatment with sodium channel blockers, lidocaine and mexiletine. J. Neurol. Sci. 1999;162:162–168. doi: 10.1016/S0022-510X(98)00322-0. [PubMed] </ref> Tatsächlich reduziert das Blockieren von Na+-Kanälen nicht nur positive Symptome, es kann auch neuroprotektiv sein (weil die Ansammlung von Na+ dazu führt, dass Na+/Ca2+-Austauschmechanismen Neuronen mit Ca2+ beladen, das exzitotoxisch ist).<ref>Mattson M.P., Guthrie P.B., Kater S.B. A role for Na+-dependent Ca2+extrusion in protection against neuronal excitotoxicity. FASEB J. 1989;3:2519–2526. [PubMed] [Google Scholar]</ref> (Abbildung 3), aber diese Vorteile gehen zu Lasten negativer Symptome. Daher und insbesondere bei einem Patienten, der eine Mischung aus positiven und negativen Symptomen aufweist, sind die Behandlungsmöglichkeiten eingeschränkt. | |||
[[File:Jay S. Coggan 3.jpeg|center|thumb|600x600px|Mechanismen der demyelinisierungsbedingten Neurodegeneration. Demyelinisierung kann fortschreitend zu ionischen Ungleichgewichten, Energiekrise, Leitungsblock und schließlich Neurodegeneration führen. ('''A''') ein normaler Knoten von Ranvier mit intakten juxtaparanodalen, paranodalen und nodalen Regionen, die darstellen <math>Na^+,K^+,Ca^+</math>Ionen fließen durch ihre jeweiligen Kanäle mit Mitochondrien, die das ATP für energieabhängige liefern <math>Na^+,K^+ ATP</math>asen, die die Ionengradienten wiederherstellen, die durch den Ionenfluss durch die Kanäle erschöpft sind. Im Axon sind zahlreiche verschiedene Ionenkanäle vorhanden, aber hier ist nur eine kleine Teilmenge dargestellt; ('''B''') partielle Demyelinisierung führt zur Auflösung von Knotenionenkanälen, Energiemangel und Ungleichgewichten von Ionengradienten; ('''C''') Eine vollständige Demyelinisierung kann zu einem Leitungsblock und einer axonalen Degeneration aufgrund der Akkumulation von intrazellulärem führen <math>Ca^+</math> die aus Energiekrisen und Störungen des Ionengleichgewichts resultieren. Abkürzungen: <math>K_v1</math>: Kaliumkanal Typ 1; <math>Na_{v}1.6</math> und <math>Na_{v}1.2</math>: Natriumkanaltypen 1.6 und 1.2;; <math>Na^+,Ca^+</math>Tauscher:<math>Na^+,Ca^+</math> Austauschpumpe; <math>Na^+,K^+ ATP</math>ase: ATP (Energie)-abhängig <math>Na^+,K^+</math>Austauschpumpe; CASPR1: Contactin-assoziiertes Protein 1 (Wechselwirkungsmolekül zwischen myelinisierender Zelle und Axon);<math>NF55</math>: Neurofascin 155 (vorherrschendes Wechselwirkungsmolekül zwischen Myelin und Axon an der paranodalen Axo-Glia-Verbindung).]] | |||
Die obige Diskussion wirft den wichtigen Punkt auf, dass, obwohl viel Lärm um Immunmechanismen gemacht wurde, ihre Verbindung mit klinischen Veränderungen weitgehend korreliert ist. Man muss die intermediären Wirkungen auf die axonale Funktion berücksichtigen, nämlich die primären und sekundären (kompensatorischen) Änderungen der Axon-Erregbarkeit, um zu verstehen, wie die neurologische Funktion verändert wird. Diese Veränderungen sind keine einfachen und direkten Folgen der Demyelinisierung, sondern legen stattdessen nahe, dass sich die axonale Physiologie selbst als Reaktion auf die Demyelinisierung verändert. Einige dieser Veränderungen sind adaptiv, während andere maladaptiv sind, oder vielleicht können adaptive Veränderungen maladaptiv werden, wenn sich die Situation (Myelinisierungsstatus) weiterentwickelt. Wenn Veränderungen in der Axonphysiologie die Manifestation verschiedener Symptome diktieren, dann wird die Symptombehandlung weitgehend auf Behandlungen fallen, die darauf abzielen, die Axonphysiologie zu manipulieren. Die strategische Entwicklung solcher Behandlungen erfordert ein tiefes, mechanistisches Verständnis der axonalen Erregbarkeit und ihrer Regulation. | |||
==== | === Axonpathobiologie === | ||
==== Strukturelle und molekulare Veränderungen ==== | |||
Axone sind stark von Demyelinisierung betroffen. Die Axonmorphologie wird unregelmäßig oder geschwollen, oft mit einem perligen Aussehen. Eine fokale Akkumulation von Proteinen (durch schnellen axonalen Transport) wird ebenfalls beobachtet. Bei chronisch aktiven Plaques ist ein axonaler Verlust von 20–80 % in der weißen Substanz der Periplaque und in der normalen entfernten weißen Substanz erkennbar.<ref>Moll N.M., Rietsch A.M., Thomas S., Ransohoff A.J., Lee J.C., Fox R., Chang A., Ransohoff R.M., Fisher E. Multiple sclerosis normal-appearing white matter: Pathology-imagig correlations. Ann. Neurol. 2011;70:764–773. doi: 10.1002/ana.22521. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> Bei früh aktiven und chronisch aktiven Plaques wird angenommen, dass die Schädigung durch Entzündungs- und Immunfaktoren verursacht wird, die während der akuten entzündlichen Demyelinisierung freigesetzt werden. Vorgeschlagene Mediatoren umfassen Proteasen, Cytokine, Excitotoxine und freie Radikale. Neuronale Antigene sind Ziele einer Immunreaktion, die zu einer ZNS-Entzündung führt. Andere Faktoren, die eine axonale Dysfunktion oder den Tod verursachen, umfassen einen Mangel an trophischer Unterstützung durch Myelin und Oligodendrozyten, Schäden durch lösliche oder zelluläre Immunfaktoren, die noch in der inaktiven Plaque vorhanden sind, und chronisches Mitochondrienversagen bei erhöhtem Energiebedarf.<ref name=":7">Lucchinetti C., Brück W., Parisi J., Scheithauer B., Rodriguez M., Lassmann H. Heterogeneity of multiple sclerosis lesions: Implications for the pathogenesis of demyelination. Ann. Neurol. 2000;47:707–717. doi: 10.1002/1531-8249(200006)47:6<707::AID-ANA3>3.0.CO;2-Q. [PubMed] [CrossRef] [Google Scholar]</ref> Eine entscheidende Rolle für Oligodendrozyten und Schwann-Zellen beim Überleben von Axonen wurde auch den Peroxisomen, dem Lipidstoffwechsel und der Entgiftung reaktiver Sauerstoffspezies (ROS) zugeschrieben.<ref>Kassmann C.M., Nave K.A. Oligodendroglial impact on axonal function and survival— A hypothesis. Curr. Opin. Neurol. 2008;21:235–241. doi: 10.1097/WCO.0b013e328300c71f. [PubMed] [CrossRef] [Google Scholar]</ref> | |||
Remyelinisierung wird häufig als Schattenplaques beobachtet, die durch die Rekrutierung von undifferenzierten Oligodendrozyten-Vorläufern gebildet werden, die zu den Läsionen wandern und diese umgeben, wodurch dünne Schichten der Remyelinisierung ermöglicht werden.<ref>Scolding N., Franklin R. Axon loss in multiple sclerosis. Lancet. 1998;352:340–341. doi: 10.1016/S0140-6736(05)60463-1. [PubMed] [CrossRef] [Google Scholar]</ref> Dieser Prozess tritt meist in akuten aktiven Plaques auf, aber auch in chronischen Phasen. Diese Beobachtung löste die Entwicklung eines neuen monoklonalen Antikörpers aus, der gegen LINGO-1 gerichtet ist (Anti-LINGO-1). Die Bindung von LINGO-1 an Nogo-Rezeptoren verhindert remyelinisierende Prozesse im ZNS; die Hemmung dieser Wechselwirkung ermöglicht somit eine signifikante Remyelinisierung bei Tieren mit experimenteller autoimmuner Enzephalomyelitis.<ref>Mi S., Miller R.H., Lee X., Scott M.L., Shulag-Morskaya S., Shao Z., Chang J., Thill G., Levesque M., Zhang M., et al. LINGO-1 negatively regulates myelination by oligodendrocytes. Nat. Neurosci. 2005;8:745–751. doi: 10.1038/nn1460. [PubMed] [CrossRef] [Google Scholar]</ref> | |||
Während des Krankheitsprozesses können autoreaktive Lymphozyten und Makrophagen die Blut-Hirn-Schranke überwinden und sich im Gehirn und Rückenmark ansammeln.<ref>Bittner S., Ruck T., Schuhmann M.K., Herrmann A.M., Maati H.M., Bobak N., Göbel K., Langhauser F., Stegner D., Ehling P., et al. 2013 Endothelial TWIK-related potassium channel-1 (TREK1) regulates immune-cell trafficking into the CNS. Nat. Med. 2013;19:1161–1165. doi: 10.1038/nm.3303. [PubMed] </ref> Regulatorische Lymphozyten (Tregs) unterdrücken Effektorzellen nicht – meist zytotoxische CD8+-Zellen.<ref>Viglietta V., Baecher-Allan C., Weiner H.L., Hafler D.A. Loss of functional suppression by CD4+CD25+ regulatory T cells in patients with multiple sclerosis. J. Exp. Med. 2004;199:971–999. doi: 10.1084/jem.20031579.[PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> Die Freisetzung von entzündungsfördernden Zytokinen rekrutiert naive Mikroglia, die durch Wechselwirkungen mit Fc- und Komplementrezeptoren Kontakt mit einer Oligodendrozyten-Myelin-Einheit aufnehmen. Ein zytotoxisches, den Tod auslösendes Signal wird dann durch den oberflächengebundenen Tumornekrosefaktor α (TNFα) übertragen..<ref>Zajicek J.P., Wing M., Scolding N.J., Compston D.A. Interactions between oligodendrocytes and microglia. A major role for complement and tumour necrosis factor in oligodendrocyte adherence and killing. Brain. 1992;115:1611–1631. [PubMed] [Google Scholar]</ref> Dies tritt zusammen mit ausgedehnten axonalen Schäden auf.<ref name=":1" /> | |||
Lucchinetti el al.<ref name=":7" />schlugen vier unterschiedliche Immunmuster der Plaquebildung vor, die bei Patienten in verschiedenen Stadien der Krankheit gefunden wurden. Plaques vom Typ I und II werden von T-Lymphozyten- und Makrophagen-Entzündungen dominiert und es wird angenommen, dass sie T-Zell- bzw. T-Zell-plus-Antikörper-Autoimmun-Enzephalomyelitis-Modelle nachahmen. Myelinverlust in Typ-I-Plaques kann durch toxische Faktoren verursacht werden, die von aktivierten Makrophagen freigesetzt werden, während IgG- und Komplementablagerung auf eine Rolle von Antikörpern in Typ-II-Plaques hindeuten. Im Gegensatz dazu zeigen die Muster III und IV eine große Oligodendrozyten-Dystrophie. Es wird angenommen, dass Muster III mit Hypoxie-induzierten Läsionen zusammenhängt, die durch Defekte in der mitochondrialen Funktion verursacht werden,<ref name=":8">Nikić I., Merkler D., Sorbara C., Brinkoetter M., Kreutzfeldt M., Bareyre F.M., Brück W., Bishop D., Misgeld T., Kerschensteiner M. A reversible form of axon damage in experimental autoimmune encephalomyelitis and multiple sclerosis. Nat. Med. 2011;17:495–499. doi: 10.1038/nm.2324. [PubMed] [CrossRef] [Google Scholar]</ref> wohingegen Muster-IV-Läsionen mit tiefgreifendem nicht-apoptotischem Tod von Oligodendrozyten in der weißen Substanz der Periplaque assoziiert sind. | |||
Barnett and Prineas<ref>Barnett M.H., Prineas J.W. Relapsing and remitting multiple sclerosis: Pathology of the newly forming lesion. Ann. Neurol. 2004;55:458–468. doi: 10.1002/ana.20016. [PubMed] [CrossRef] [Google Scholar]</ref> analysierten Läsionen von Patienten direkt nach dem Einsetzen eines Rezidivs, während dessen eine aktive Plaquebildung andauerte. Ihre Ergebnisse legen nahe, dass Oligodendrozyten-Apoptose und Glia-Aktivierung während der frühen aktiven Plaquebildung in Abwesenheit von entzündlichen Lymphozyten oder Myelin-Phagozyten auftreten. Sie schlugen vor, dass die Anfälligkeit von Oligodendrozyten, die in Lucchinettis Typ-III-Muster beschrieben wird, in den frühen Stadien aller Plaquebildung vorhanden ist und der Auslöser für die nachfolgende postapoptotische Nekrose ist, die in späteren Stadien die Phagozytose von Myelin durch Makrophagen einleitet. In-vitro-Analysen dieses Prozesses haben Komplementkaskaden, Tumornekrosefaktoren oder gasförmige Second Messenger impliziert.<ref>Van der Laan L.J., Ruuls S.R., Weber K.S., Lodder I.J., Döpp E.A., Dijkstra C.D. Macrophage phagocytosis of myelin ''in vitro'' determined by flow cytometry: Phagocytosis is mediated by CR3 and induces production of tumor necrosis factor-α and nitric oxide. J. Neuroimmunol. 1996;70:145–152. doi: 10.1016/S0165-5728(96)00110-5. [PubMed] [CrossRef] [Google Scholar]</ref>Obwohl die Identifizierung von Plaques und die Überwachung ihres Fortschritts einen wichtigen klinischen Wert haben, gibt es nur eine bescheidene Korrelation zwischen der Belastung durch demyelinisierende Läsionen, wie sie durch herkömmliches MRI bestimmt wird, und der klinischen Behinderung von Patienten mit MS (siehe oben). | |||
==== Funktionale Änderungen ==== | |||
Zu den Mechanismen der funktionellen Beeinträchtigung während der Demyelinisierung gehören häufig die Störung der transmembranen Na+-, K+- und Ca2+-Ionen, die Ausbreitung ihrer entsprechenden Ionenkanäle, eine Abnahme der Effizienz der AP-Leitung und eine daraus resultierende Stoffwechselkrise (Abbildung 3). Eine Demyelinisierung kann leicht einen Leitungsausfall innerhalb des betroffenen Axons erklären. Wenn die Leitung nicht vollständig ausfällt, kann die Leitungsgeschwindigkeit dennoch verlangsamt werden, und eine unterschiedliche Verlangsamung über verschiedene Axone kann variable Leitungsverzögerungen verursachen, die zu einem desynchronisierten Spiking führen. | |||
Die Demyelinisierung ermöglicht auch, dass entblößte Axone eng aneinander liegen, wodurch die Voraussetzungen für ephaptische Wechselwirkungen und Übersprechen geschaffen werden.<ref name=":1" /> Eine Reflexion kann auch aufgrund einer Impedanzfehlanpassung zwischen myelinisierten und nicht myelinisierten Axonlängen auftreten. Andererseits kann Übererregbarkeit nicht direkt der Demyelinisierung zugeschrieben werden; Stattdessen müssen sekundäre Veränderungen der intrinsischen Erregbarkeit herangezogen werden, um Phänomene wie die Erzeugung ektopischer Spitzen und Nachentladung (AD) zu erklären. Veränderungen der Erregbarkeit stellen wahrscheinlich kompensatorische Veränderungen dar, die darauf abzielen, die Funktion nach der direkt durch Demyelinisierung verursachten Störung wiederherzustellen, was mit einem Prozess übereinstimmt, der als homöostatische Plastizität bezeichnet wird,<ref>Wang G., Thompson S.M. Maladaptive homeostatic plasticity in a rodent model of central pain syndrome: Thalamic hyperexcitability after spinothalamic tract lesions. J. Neurosci. 2008;28:11959–11969. doi: 10.1523/JNEUROSCI.3296-08.2008. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> aber diese Kompensation kann offensichtlich maladaptiv sein. Jedes der oben genannten Ergebnisse, die sich nicht gegenseitig ausschließen, trägt dazu bei, unterschiedliche Symptome hervorzurufen, die bei demyelinisierenden Erkrankungen beobachtet werden. | |||
Paroxysmale Symptome, die durch das plötzliche Einsetzen oder Verstärken von Symptomen wie Spasmen oder stechenden Schmerzen gekennzeichnet sind, entstehen wahrscheinlich durch AD oder anderweitig unangemessenes Spiking vom Burst-Typ. Solche Spiking-Muster legen hochgradig nichtlineare Wechselwirkungen zwischen dem beitragenden Ionenstrom nahes<ref name=":9">Coggan J.S., Prescott S.A., Bartol T.M., Sejnowski T.J. Imbalance of ionic conductances contributes to diverse symptoms of demyelination. Proc. Natl. Acad. Sci. USA. 2010;107:20602–20609. doi: 10.1073/pnas.1013798107.[PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref name=":10">Coggan J.S., Ocker G.K., Sejnowski T.J., Prescott S.A. Explaining pathological changes in axonal excitability through dynamical analysis of conductance-based models. J. Neural Eng. 2011;8 doi: 10.1088/1741-2560/8/6/065002. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> and could, in theory at least, involve interactions between different regions of the neuron.<ref name=":11">Coggan J.S., Prescott S.A., Sejnowski T.J. Cooperativity between remote sites of ectopic spiking allows afterdischarge to be initiated and maintained at different locations. J. Comput. Neurosci. 2015;39:17–28. doi: 10.1007/s10827-015-0562-8. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> Im Gegensatz zu allgemeineren Formen der Übererregbarkeit (z. B. erhöhte Feuerrate oder reduzierte Schwelle) sind diese spezifischen Muster in Bezug auf die genauen Mechanismen, durch die sie entstehen können, begrenzt. Daher kann die Identifizierung der Ionenkanalveränderungen, die diesen spezifischen Formen der Übererregbarkeit zugrunde liegen, dazu beitragen, die Suche nach Ionenkanalveränderungen einzuschränken, die für assoziierte, jedoch weniger ausgeprägte Formen der Übererregbarkeit verantwortlich sind. | |||
Die Störung des Energiegleichgewichts in einem Neuron könnte sich auch tiefgreifend auf das Wohlbefinden des Neurons auswirken (Abbildung 3). Tatsächlich können kompensierende Änderungen gewisse Funktionen wiederherstellen, aber ohne das Hauptproblem umzukehren, können andere Probleme auftreten. Selbst wenn zum Beispiel ein Leitungsblock durch eine geeignete kompensierende Änderung der Erregbarkeit verhindert wird (d. h. eine, die nicht zu einer Übererregbarkeit führt), kann das System weniger energieeffizient sein. Der Verlust der Energieeinsparungen durch Saltatorische Leitung induziert eine kompensatorische mitochondriale Energieproduktion, die zu oxidativen Schäden und Neurodegeneration führen kann.<ref name=":8" /><ref name=":12">Aon M.A., Cortassa S., Akar F.G., Brown D.A., Zhou L., O’Rourke B. From mitochondrial dynamics to arrhythmias. Int. J. Biochem. Cell Biol. 2009;41:1940–1948. doi: 10.1016/j.biocel.2009.02.016. [PMC free article][PubMed] [CrossRef] [Google Scholar]</ref><ref name=":13">Su K., Bourdette D., Forte M. Mitochondrial dysfunction and neurodegeneration in multiple sclerosis. Front. Physiol. 2013;4doi: 10.3389/fphys.2013.00169. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> | |||
Es ist keine leichte Aufgabe, diese lange Liste neurobiologischer Veränderungen im Auge zu behalten, die Wechselbeziehungen zwischen diesen Veränderungen zu verstehen und diese Veränderungen letztendlich mit klinischen Manifestationen zu verknüpfen und eine wirksame Behandlung anzuwenden. Zu diesem Zweck ist die computergestützte Modellierung ein unschätzbares Werkzeug. Simulationen dienen nicht nur dazu, bereits bekannte Informationen zu organisieren, sondern identifizieren auch entscheidende Wissenslücken. Die vernünftige Verwendung von Computermodellen kann daher ein umfassenderes Verständnis ermöglichen und die effektivere Anwendung dieses Verständnisses erleichtern, wie unten erörtert. | |||
=== | === Computermodellierung === | ||
Insbesondere in Verbindung mit traditionellen Experimenten ist die Computermodellierung unverzichtbar, um inkonsistente Daten und komplexe Mechanismen zu verstehen. Diese Vorteile werden durch die Anwendung von Simulationen in anderen Bereichen, wie z. B. Epilepsie, veranschaulicht.<ref>Soltesz I., Staley K. Computational Neuroscience in Epilepsy. 1st ed. Elsevier; London, UK: 2008. [Google Scholar]</ref> Hier geben wir einen Überblick über die Geschichte der computergestützten Modellierung von Axonen, Ionenleitfähigkeiten, der Physiologie von Myelin und Demyelinisierung, des Immunsystems, der Mitochondrien und anderer biologischer Faktoren, die für das Verständnis demyelinisierender Krankheiten entscheidend sind. Unsere Übersicht erhebt keinen Anspruch auf Vollständigkeit, bietet jedoch eine breite Einführung in vergangene, gegenwärtige und zukünftige Bemühungen auf diesem Gebiet. | |||
==== Modellierung von Axonen ==== | |||
Die computergestützte Modellierung von Axonen hat sich taxonomisch weiterentwickelt, von Tintenfisch- zu Säugetiergeweben mit einer entsprechenden Zunahme an Raffinesse. Das Modell von Hodgkin und Huxley (HH), das die erste gründliche Erklärung der AP-Erzeugung lieferte, wurde aus Experimenten an nicht myelinisierten Riesenaxonen von Tintenfischen abgeleitet,<ref>Hodgkin A.L., Huxley A.F. The components of membrane conductance in the giant axon of ''Loligo''. J. Physiol. 1952;116:473–496. doi: 10.1113/jphysiol.1952.sp004718. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>Hodgkin A.L., Huxley A.F. Currents carried by sodium and potassium ions through the membrane of the giant axon of ''Loligo''. J. Physiol. 1952;116:449–472. doi: 10.1113/jphysiol.1952.sp004717. [PMC free article] [PubMed] </ref> aber dieses frühe Modell hat sich als unschätzbares Werkzeug erwiesen, aus dem sich später anspruchsvollere Modelle myelinisierter Axone entwickelt haben. | |||
Die räumliche und biophysikalische Heterogenität, die durch die Zugabe von Myelin verliehen wird, und die daraus resultierende Bildung von Knoten und internodalen Regionen, repräsentiert eine signifikante Erhöhung der Axonkomplexität. Das erste Computermodell eines myelinisierten Axons war ein eindimensionales Modell, das die Myelinscheide in das darunter liegende passive Axolemm kollabierte, eine einheitliche räumliche Schrittweite verwendete, um die diskrete Näherung zu bilden, die in der numerischen Lösung verwendet wurde, und eine HH-Charakterisierung der Knotenmembran verwendete.<ref>Fitzhugh R. Computation of impulse initiation and saltatory conduction in a myelinated nerve fiber. Biophys. J. 1962;2:11–21. doi: 10.1016/S0006-3495(62)86837-4. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> Goldman & Albus<ref>Goldman L., Albus J.S. Computation of impulse conduction in myelinated fibers; theoretical basis of the velocity-diameter relation. Biophys. J. 1968;8:596–607. doi: 10.1016/S0006-3495(68)86510-5. [PMC free article][PubMed] [CrossRef] [Google Scholar]</ref> modifizierten dieses Modell, um eine Beschreibung der Knotenmembran aufzunehmen, die aus experimentellen Daten von myelinisierten Xenopus laevis-Nervenfasern abgeleitet wurde, wie von Frankenhaeuser & Huxley bestimmt.<ref>Frankenhaeuser B., Huxley A.F. The action potential in the myelinated nerve fiber of ''Xenopus'' ''laevis'' as computed on the basis of voltage clamp data. J. Physiol. 1964;171:302–315. doi: 10.1113/jphysiol.1964.sp007378.[PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> Nachfolgende Studien haben die gleiche Grundform für das Modell mit einigen Variationen für die Darstellung des Axolemma verwendet.<ref name=":2" /><ref>Smith R.S., Koles Z.J. Myelinated nerve fibers: Computed effect of myelin thickness on conduction velocity. Am. J. Physiol. 1970;219:1256–1258.[PubMed] [Google Scholar]</ref><ref>Hutchinson N.A., Koles Z.J., Smith R.S. Conduction velocity in myelinated nerve fibres of ''Xenopus'' ''laevis''. J. Physiol. 1970;208:279–289. doi: 10.1113/jphysiol.1970.sp009119. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>Koles Z.J., Rasminsky M. A computer simulation of conduction in demyelinated nerve fibres. J. Physiol. 1972;227:351–364. doi: 10.1113/jphysiol.1972.sp010036. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>Hardy W.L. Propagation speed in myelinated nerve. II. Theoretical dependence on external Na and on temperature. Biophys. J. 1973;13:1071–1089. doi: 10.1016/S0006-3495(73)86046-1. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>Schauf C.L., Davis F.A. Impulse conduction in multiple sclerosis: A theoretical basis for modification by temperature and pharmacological agents. J. Neurol. Neurosurg. Psychiatry. 1974;37:152–161. doi: 10.1136/jnnp.37.2.152.[PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>Brill M.H., Waxman S.G., Moore J.W., Joyner R.W. Conduction velocity and spike configuration in myelinated fibres: Computed dependence on internode distance. J. Neurol. Neurosurg. Psychiatry. 1977;40:769–774. doi: 10.1136/jnnp.40.8.769. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>Waxman S.G., Brill M.H. Conduction through demyelinated plaques in multiple sclerosis: Computer simulations of facilitation by short internodes. J. Neurol. Neurosurg. Psychiatry. 1978;41:408–416. doi: 10.1136/jnnp.41.5.408.[PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>Wood S.L., Waxman S.G., Kocsis J.D. Conduction of trans of impulses in uniform myelinated fibers: Computed dependence on stimulus frequency. Neuroscience. 1982;7:423–430. doi: 10.1016/0306-4522(82)90276-7. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Goldfinger M.D. Computation of high safety factor impulse propagation at axonal branch points. Neuroreport. 2000;11:449–456. doi: 10.1097/00001756-200002280-00005. [PubMed] [CrossRef] [Google Scholar]</ref> Das Einzelkabelmodell, das das Axon und alle seine Leitfähigkeits- und Kapazitätseigenschaften in einer Kabelgleichung beschreibt, hat das Feld bis heute dominiert, trotz der Einführung von Doppelkabelmodellen durch Blight.<ref name=":14">Blight A.R. Computer simulation of action potentials and afterpotentials in mammalian myelinated axons: The case for a lower resistance myelin sheath. Neuroscience. 1985;15:13–31. doi: 10.1016/0306-4522(85)90119-8. [PubMed] [CrossRef] [Google Scholar]</ref> In Doppelkabelmodellen werden das internodale Axolemm und die Myelinscheide unabhängig voneinander dargestellt. Das Doppelseilmodell wurde von Halter und Clark erweitert<ref name=":15">Halter J.A., Clark J.W., Jr. A distributed-parameter model of the myelinated nerve fiber. J. Theor. Biol. 1991;148:345–382. doi: 10.1016/S0022-5193(05)80242-5. [PubMed] [CrossRef] [Google Scholar]</ref>um die Auswirkungen der komplexen Geometrie von ZNS-Oligodendrozyten (oder Schwann-Zellen im Fall des PNS) zu untersuchen. | |||
Neuere Modelle haben auch frühere Vereinfachungen verbessert, darunter die anatomische Komplexität des Ranvier-Knotens, die Verteilung von Ionenkanälen im Axon unter der Myelinscheide, die unterschiedlichen elektrischen Eigenschaften der Myelinscheide und des Axolemmas und die Anpassung an einen möglichen Stromfluss darin der Periaxonalraum.<ref name=":15" /><ref>Schwarz J.R., Eikhof G. Na currents and action potentials in rat myelinated nerve fibres at 20 and 37 °C. Pflugers Arch. 1987;409:569–577. doi: 10.1007/BF00584655. [PubMed] [CrossRef] [Google Scholar]</ref><ref name=":16">Stephanova D.I. Myelin as longitudinal conductor: A multi-layered model of the myelinated human motor nerve fibre. Biol. Cybern. 2001;84:301–308. doi: 10.1007/s004220000213. [PubMed] [CrossRef] [Google Scholar]</ref><ref name=":17">McIntyre C.C., Richardson A.G., Grill W.M. Modeling the excitability of mammalian nerve fibers: Influence of afterpotentials on the recovery cycle. J. Neurophysiol. 2002;87:995–1006. [PubMed] [Google Scholar]</ref><ref name=":18">Einziger P.D., Livshitz L.M., Mizrahi J. Generalized cable equation model for myelinated nerve fiber. IEEE Trans. Biomed. Eng. 2005;52:1632–1642. doi: 10.1109/TBME.2005.856031. [PubMed] [CrossRef] [Google Scholar]</ref> Anatomische Darstellungen des paranodalen Bereichs haben eine detailliertere Beurteilung der Auswirkungen einer traumatischen Hirnverletzung (TBI) auf myelinisierte Axone ermöglicht.<ref>Volman V., Ng L. Primary paranode demyelination modulates slowly developing axonal depolarization in a model of axonal injury. J. Neural Comput. 2014;37:439–457. [PubMed] [Google Scholar]</ref>Eines der anatomisch ausgefeiltesten Modelle umfasst die Darstellung der komplexen wässrigen Hüllenstruktur von Myelinlamellen als eine Reihe von miteinander verbundenen parallelen Lamellen in einem Modell motorischer Nerven.<ref name=":6" /><ref name=":16" /> | |||
Neuere Modelle haben auch die ungleichmäßige Verteilung von Ionenkanälen im gesamten Axon berücksichtigt [19,84,85,86,87,88,89,90].<ref name=":4" /><ref>Stephanova D.I., Bostock H. A Distributed-parameter model of the myelinated human motor nerve fibre: Temporal and spatial distributions of action potentials and ionic currents. Biol. Cybern. 1995;73:275–280. doi: 10.1007/BF00201429. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Chiu S.Y., Ritchie J.M. On the physiological role of internodal potassium channels and the security of conduction in myelinated nerve fibres. Proc. R. Soc. Lond. B Biol. Sci. 1984;220:415–422. doi: 10.1098/rspb.1984.0010.[PubMed] [CrossRef] [Google Scholar]</ref><ref>Brismar T., Schwarz J.R. Potassium permeability in rat myelinated nerve fibres. Acta Physiol. Scand. 1985;124:141–148. doi: 10.1111/j.1748-1716.1985.tb07645.x. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Chiu S.Y., Schwarz W. Sodium and potassium currents in acutely demyelinated internodes of rabbit sciatic nerves. J. Physiol. 1987;391:631–649. doi: 10.1113/jphysiol.1987.sp016760. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>Baker M., Bostock H., Grafe P., Martius P. Function and distribution of three types of rectifying channel in rat spinal root myelinated axons. J. Physiol. 1987;383:45–67. [PMC free article] [PubMed] [Google Scholar</ref><ref>Röper J., Schwarz J.R. Heterogeneous distribution of fast and slow potassium channels in myelinated rat nerve fibres. J. Physiol. 1989;416:93–110. doi: 10.1113/jphysiol.1989.sp017751. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>Bittner S., Meuth S.G. Targeting ion channels for the treatment of autoimmune neuroinflammation. Ther. Adv. Neurol. Disord. 2013;6:322–336. doi: 10.1177/1756285613487782. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref>Neben Ionenkanälen bieten energieabhängige Pumpen und andere Ionentransportmechanismen wichtige therapeutische Ziele für eine Reihe von neurologischen Störungen.<ref>Waxman S.G., Ritchie J.M. Molecular dissection of the myelinated axon. Ann. Neurol. 1993;33:121–136. doi: 10.1002/ana.410330202. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Bittner S., Budde T., Wiendl H., Meuth S.G. From the background to the spotlight: TASK channels in pathological conditions. Brain Pathol. 2010;20:999–1009. doi: 10.1111/j.1750-3639.2010.00407.x. [PMC free article][PubMed] [CrossRef] [Google Scholar]</ref><ref>Ehling P., Bittner S., Budde T., Wiendl H., Meuth S.G. Ion channels in autoimmune neurodegeneration. FEBS Lett. 2011;585:3836–3842. doi: 10.1016/j.febslet.2011.03.065. [PubMed] [CrossRef] [Google Scholar]</ref> In dieser Hinsicht kostet die Regulierung der Transmembran-Ionengradienten erhebliche Energie und wird selbst zu einer wichtigen Überlegung (siehe unten)..<ref name=":19">Hübel N., Dahlem M.A. Dynamics from seconds to hours in Hodgkin-Huxley model with time-dependent ion concentrations and buffer reservoirs. PLoS Comput. Biol. 2014;10:e1003941. doi: 10.1371/journal.pcbi.1003941.[PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> Dies gilt insbesondere, da das kleine Volumen von Axonen sie anfällig für Ionenkonzentrationsänderungen macht, die sich dramatisch auf die Antriebskräfte auswirken können und in Modellen problematisch werden können, die konstante intrazelluläre und extrazelluläre Konzentrationen annehmen. Aber neuere Modelle haben sich auch mit solchen Problemen befasst (siehe unten). | |||
Alle oben genannten Modelle konzentrieren sich auf die Simulation der Änderung des Axonmembranpotentials, aber man hat nicht unbedingt experimentellen Zugang zu dieser Variablen, was natürlich die Bemühungen erschwert, Simulations- und experimentelle Daten zu vergleichen. Da extrazelluläre Aufzeichnungen die primäre Quelle elektrophysiologischer Daten von menschlichen Probanden sind, ist die mathematische Beschreibung des extrazellulären Feldpotentials klinisch von großem Interesse. Zur Berechnung dieser Potentiale werden mathematische Auswertungen auf der Grundlage von Laplace-Gleichungen und Fourier-Transformationen verwendet (manchmal auch als Line-Source-Modellierung bezeichnet, z.,.<ref name=":18" /><ref>Ganapathy L., Clark J.W. Extracellular currents and potentials of the active myelinated nerve fibre. Biophys. J. 1987;52:749–761. doi: 10.1016/S0006-3495(87)83269-1. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> | |||
==== Modellierung spezifischer Mechanismen ==== | |||
Über die Modellierung der normalen axonalen Funktion hinaus können Modelle verwendet werden, um bestimmte Mechanismen der axonalen Dysfunktion zu untersuchen, insbesondere wenn sie mit experimentellen Ergebnissen kombiniert werden, die die Mechanismen besser lokalisieren könnten.<ref>Prescott S.A. Pathological changes in peripheral nerve excitability. In: Jaeger D., Jung R., editors. Encyclopedia of Computational Neurosci. 1st ed. Springer-Verlag; New York, NY, USA: 2015. [Google Scholar]</ref>Zum Beispiel, Barrett and Barrett<ref>Barrett E.F., Barrett J.N. Intracellular recording from vertebrate myelinated axons: Mechanism of the depolarizing afterpotential. J. Physiol. 1982;323:117–144. doi: 10.1113/jphysiol.1982.sp014064. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> zeigten, dass das depolarisierende Nachpotential (DAP) empfindlich auf Änderungen der Leitfähigkeitsdichten und kapazitiven Änderungen reagiert, die während der Demyelinisierung auftreten können. Ein Modell von Blight wurde zur Simulation seiner experimentellen Aufnahmebedingungen entworfen<ref name=":14" /><ref>Blight A.R., Someya S. Depolarizing afterpotentials in myelinated axons of mammalian spinal cord. Neuroscience. 1985;15:1–12. doi: 10.1016/0306-4522(85)90118-6. [PubMed] [CrossRef] [Google Scholar]</ref>und stellt ein einzelnes Internodium mit mehreren diskreten Segmenten und benachbarten Knoten und Internodien in einzelnen Segmenten mit konzentrierten Parametern dar. Dieses Modell umfasste K+-Kanäle im Axolemma des einzelnen multisegmentierten Internodiums und behandelt den Rest als rein passiv. | |||
Aufbauend auf dieser Arbeit, mit sorgfältiger Beachtung anatomischer und elektrophysiologischer Details,McIntyre et al.<ref name=":17" /> befassten sich mit der Rolle des DAP und der Nachhyperpolarisation (AHP) im Erholungszyklus – dem ausgeprägten Muster der Schwellenfluktuation nach einem einzelnen Aktionspotential, das von menschlichen Nerven gezeigt wird. Die Simulationen legten unterschiedliche Rollen für aktive und passive Na+- und K+-Kanäle in beiden Nachpotentialen nahe und schlugen vor, dass Unterschiede in der AP-Form, Stärke-Dauer-Beziehung und dem Erholungszyklus von motorischen und sensorischen Nervenfasern kinetischen Unterschieden in den Knoten-Na+-Leitfähigkeiten zugeschrieben werden können . Richardsonet al.<ref>Richardson A.G., McIntyre C.C., Grill W.M. Modelling the effects of electric fields on nerve fibres: Influence of the myelin sheath. Med. Biol. Eng. Comput. 2000;38:438–446. doi: 10.1007/BF02345014. [PubMed] [CrossRef] [Google Scholar]</ref> fanden auch heraus, dass eine Änderung des Standardmodells des „perfekten Isolators“ notwendig ist, um DAPs während der Hochfrequenzstimulation zu reproduzieren. | |||
Die Temperaturempfindlichkeit von Demyelinisierungseffekten wurde ebenfalls rechnerisch untersucht. Zlochiver<ref>Zlochiver S. Persistent reflection underlies ectopic activity in multiple sclerosis: A numerical study. Biol. Cybern. 2010;102:181–196. doi: 10.1007/s00422-009-0361-2. [PubMed] [CrossRef] [Google Scholar]</ref> modellierten eine anhaltende Resonanzreflexion über eine einzelne fokale Demyelinisierungsplaque und stellten fest, dass dieser Effekt empfindlich auf Temperatur und Axondurchmesser reagierte. Alle diese Beispiele demonstrierten die Leistungsfähigkeit von Simulationen, um spezifische Mechanismen zu untersuchen, um beobachtete Phänomene aus der Klinik zu erklären und eine Anleitung für zukünftige Forschung zu bieten. | |||
Wie oben erwähnt, manifestieren deutliche Veränderungen in der Axonfunktion wahrscheinlich bestimmte Funktionsgewinn- oder -verlustsymptome. Wenn man diese Änderungen in einem Rechenmodell reproduzieren könnte, könnten die notwendigen Parameteränderungen, die zum Umwandeln des Modells zwischen normalem und abnormalem Betrieb erforderlich sind, verwendet werden, um die zugrunde liegende Pathologie vorherzusagen. Im Idealfall kann dies zu konkreten Experimenten führen, in denen beispielsweise der verdächtige Ionenkanal direkt manipuliert wird, um zu sehen, ob seine akute Veränderung ausreicht, um bestimmte pathologische Veränderungen zu reproduzieren oder rückgängig zu machen. Jüngste Studien aus dem Prescott-Labor veranschaulichen diesen Prozess.<ref>Ratté S., Zhu Y., Lee K.Y., Prescott S.A. Criticality and degeneracy in injury-induced changes in primary afferent excitability and the implications for neuropathic pain. Elife. 2014;3:e02370. doi: 10.7554/eLife.02370.[PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>Zhu Y., Feng B., Schwartz E.S., Gebhart G.F., Prescott S.A. Novel method to assess axonal excitability using channelrhodopsin-based photoactivation. J. Neurophysiol. 2015;113:2242–2249. doi: 10.1152/jn.00982.2014.[PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> Dieser Erfolg dieser Studien hing von fortschrittlichen Techniken ab, einschließlich der dynamischen Klemmtechnik, die verwendet wird, um zwischen normalen und abnormalen Spiking-Mustern und optogenetischen Werkzeugen zu wechseln. Der nächste Schritt besteht darin, Veränderungen in der Axonfunktion mit Krankheitssymptomen (oder ihren Verhaltenskorrelaten in Tiermodellen) zu verknüpfen. | |||
In Hörnervenexperimenten Tagoe und Kollegen<ref>Tagoe T., Barker M., Jones A., Allcock N., Hamann M. Auditory nerve perinodal dysmyelination in noise-induced hearing loss. J. Neurosci. 2014;12:2684–2688. doi: 10.1523/JNEUROSCI.3977-13.2014.</ref> zeigten, dass Hörverlust im Zusammenhang mit morphologischen Veränderungen an Paranoden und Juxtaparanoden, einschließlich der Verlängerung des Hörnervs um Ranvier-Knoten, aus der Exposition gegenüber lautem Lärm resultieren kann. Hamann und Kollegen erweiterten diese Arbeit und bauten ein Computermodell, um mögliche Mechanismen zu untersuchen. Ihr Modell legte nahe, dass es wahrscheinlicher ist, dass eine Abnahme der Dichte von Na-Kanälen als eine Umverteilung von Na- oder K-Kanälen im Allgemeinen für die mit akustischer Überexposition verbundene Leitungshemmung verantwortlich ist.<ref>Brown A.M., Hamann M. Computational modeling of the effects of auditory nerve dysmyelination. Front. Neuroanat. 2014;8doi: 10.3389/fnana.2014.00073. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> Dieses Experiment-Modell-Tandem demonstriert das aufschlussreiche Potenzial der Paarung von Computermodellen mit Laborexperimenten. | |||
Mit einem mehrschichtigen Modell mit myelinisiertem Axon konnten Stephanova und Kollegen fortlaufend erfolgreich wahrscheinliche anatomische und physiologische Mängel identifizieren, die verschiedenen Symptomen und Zuständen im Zusammenhang mit der Demyelinisierung zugrunde liegen, indem sie Vergleiche mit den Schwellenverfolgungsmessungen von Patienten anstellten, einschließlich Latenzen, Refraktärität (die Erhöhung der Schwelle Strom während der relativen Refraktärzeit), Refraktärzeit, Supernormalität und Schwellenelektrotonuswerte, einschließlich Stimulus-Reaktions-Maßnahmen wie Strom-Schwellen-Beziehungen.<ref name=":5" />Beispielsweise fanden sie heraus, dass eine leichte internodale systematische Demyelinisierung (ISD) ein spezifischer Indikator für CMT1A ist. Milde paranodale systematische Demyelinisierung (PSD) und paranodale systematische Demyelinisierung (PISD) sind spezifische Indikatoren für CIPD und ihre Subtypen. Schwere fokale Demyelinisierungen, internodal und paranodal, paranodal-internodal (IFD und PFD, PIFD) sind spezifische Indikatoren für erworbene demyelinisierende Neuropathien wie GBS und MMN [18] (siehe Abbildung 1). | |||
Leichte systematische und schwere fokale Demyelinisierung entsprechen erblichen (CMT1A) und erworbenen (CIDP, GBS und MMN) Neuropathien (Tabelle 1). Es wurde auch festgestellt, dass 70 % der systematischen Demyelinisierung nicht ausreichen, um Symptome zu verursachen, und dass 96 % für einen Leitungsblock an einem einzelnen Knoten erforderlich sind [18]. Somit besteht ein großer Sicherheitsfaktor für die fokale Demyelinisierung. Mit ihrer temperaturabhängigen Version des Modells der myelinisierten menschlichen motorischen Nervenfaser, Stephanova und Daskalova<ref>Stephanova D.I., Daskalova M. Electrotonic potentials in simulated chronic inflammatory demyelinating polyneuropathy at 20 °C–42 °C. J. Integr. Neurosci. 2015;27:1–18. doi: 10.1142/S0219635215500119. [PubMed] [CrossRef] [Google Scholar]</ref> zeigten, dass die elektrotonischen Potentiale bei Patienten mit CIDP während Hypo- und sogar leichter Hyperthermie einem hohen Blockierungsrisiko ausgesetzt sind, und deuten auf Mechanismen hin, die eine erhöhte Größe der polarisierenden elektrotonischen Knoten- und depolarisierenden internodalen elektrotonischen Potentiale, einen Anstieg der nach innen gerichteten Gleichrichter-K+- und Leck-K+-Ströme mit der Temperatur umfassen, und die Akkommodation bei lang anhaltender Hyperpolarisation ist größer als bei Depolarisation. | |||
<center> | <center> | ||
{| class="wikitable" | {| class="wikitable" | ||
| Line 171: | Line 172: | ||
</center> | </center> | ||
==== | ==== Einfache Modelle und nichtlineare dynamische Analyse ==== | ||
Given the temporal dissociation between the manifestation of symptoms and the rates of demyelination and remyelination, homeostatic processes undoubtedly occur within axons, which include the redistribution of ion channels in demyelinated plaques.<ref>Rasminsky M. Hyperexcitability of pathologically myelinated axons and positive symptoms in multiple sclerosis. Adv. Neurol. 1981;31:289–297.[PubMed] [Google Scholar]</ref><ref>Ulrich J., Groebke-Lorenz W. The optic nerve in multiple sclerosis: A morphological study with retrospective clinicopathological correlation. Neuro-Ophthalmology. 1983;3:149–159. doi: 10.3109/01658108309009732.[CrossRef] [Google Scholar]</ref> | Given the temporal dissociation between the manifestation of symptoms and the rates of demyelination and remyelination, homeostatic processes undoubtedly occur within axons, which include the redistribution of ion channels in demyelinated plaques.<ref>Rasminsky M. Hyperexcitability of pathologically myelinated axons and positive symptoms in multiple sclerosis. Adv. Neurol. 1981;31:289–297.[PubMed] [Google Scholar]</ref><ref>Ulrich J., Groebke-Lorenz W. The optic nerve in multiple sclerosis: A morphological study with retrospective clinicopathological correlation. Neuro-Ophthalmology. 1983;3:149–159. doi: 10.3109/01658108309009732.[CrossRef] [Google Scholar]</ref>Angesichts der Vielfalt der Ionenkanäle, die von verschiedenen Axonen exprimiert werden, und des nur lückenhaften Wissens darüber, wie sich die Expressionsniveaus ändern, ist der Aufbau detaillierter Modelle zur Untersuchung dieser homöostatischen Prozesse problematisch. Besonders unter diesen Bedingungen können stark vereinfachte Modelle helfen, grundlegende Prinzipien zu identifizieren, wie die gemeinsame Verwendung von modifizierten HH- und Morris-Lecar-Modellen veranschaulicht [57,58]. Die Ergebnisse dieser Studien legten eine einfache Erklärung für die Breite der Symptome nahe, die während der Demyelinisierung auftreten, indem sie aufzeigten, dass das Verhältnis von Na+ zu Leck-K+-Leitfähigkeit, g(Na)/g(L), als ein Vier-Wege-Schalter fungierte, der die Erregungsmuster steuerte umfassten das Versagen der AP-Ausbreitung, die normale AP-Ausbreitung, AD und spontanes Spiking. | ||
Weitere Studien mit diesem Modell legten das Potenzial für Konkurrenz oder Kooperation zwischen verschiedenen Regionen desselben Neurons nahe.<ref name=":11" /> Die Kooperation zwischen entfernten Orten ektopischer Spikings ermöglicht es, AD an verschiedenen Orten innerhalb eines einzelnen Axons zu initiieren und aufrechtzuerhalten, wodurch eine überzeugende Erklärung für die zeitlichen und räumlichen Diskontinuitäten von Schmerzen und anderen Symptomen bei MS-Patienten bereitgestellt wird. Bemerkenswerterweise wurden in einer kürzlich durchgeführten Studie über demyelinisierte Axone in einem Cuprizon-Mausmodell experimentelle Beweise für eine Umverteilung von Ionenkanälen aus dem Ranvier-Knoten, eine erhöhte ektopische Erregbarkeit zusammen mit antidrom vermehrten APs aus der demyelinisierten Plaque sowie eine kompensatorische Verschiebung gesehen in der Erregbarkeit von Membranen proximal zum Soma.<ref>Hamada M.S., Kole M.H. Myelin loss and axonal ion channel adaptations associated with gray matter neuronal hyperexcitability. J. Neurosci. 2015;35:7272–7786. [PMC free article] [PubMed] [Google Scholar]</ref> Alle diese Beobachtungen stimmen mit den Berechnungsmodellvorhersagen von Coggan und Kollegen überein oder stimmen mit diesen überein und implizieren den Erfolg des Berechnungsansatzes zur Führung von Laborstudien. | |||
Darüber hinaus ermöglichten diese vereinfachten Modelle die Anwendung mathematischer Werkzeuge zur Untersuchung der nichtlinearen Mechanismen, durch die AD initiiert und beendet wird.<ref name=":9" /><ref name=":10" /><ref name=":11" /> Bifurkationsanalysen zeigten die zugrunde liegende Bistabilität der Axonerregbarkeit unter pathologischen Bedingungen sowie die Faktoren, die den Übergang von einem Attraktorzustand zu einem anderen steuern. AD erfordert beispielsweise einen langsamen Einwärtsstrom, der zwei stabile Attraktorzustände ermöglicht, von denen einer der Ruhe und der andere dem wiederholten Spiking (einem Grenzzyklus) entspricht. Die Beendigung von AD wurde dadurch erklärt, dass der Attraktor, der mit wiederholtem Spiking verbunden ist, zerstört wird. Dies geschah, als eine ultralangsame negative Rückkopplung in Form einer intrazellulären Na+-Akkumulation die Zerstörung des Grenzzyklus-Attraktorzustands verursachte [58]. Andere Studien, die Bifurkationsanalysen verwenden, legen nahe, dass Änderungen der Ionenkonzentration eine langsame Dynamik einführen können, die für das Verständnis pathologischer Ergebnisse wichtig sein kann [94,109].<ref name=":19" /><ref>Yu N., Morris C.E., Joós B., Longtin A. Spontaneous excitation patterns computed for axons with injury-like impairments of sodium channels and Na/K pumps. PLoS Comput. Biol. 2012;8:e1002664. doi: 10.1371/journal.pcbi.1002664. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> | |||
==== | ==== Modellierung im kleinen Maßstab ==== | ||
Die oben erwähnten Studien heben die Bedeutung von Änderungen der Ionenkonzentration hervor, aber jede von ihnen berücksichtigte diese Änderungen nur in einem relativ groben Maßstab. Die Studie von Lorpreore et al.<ref>Lopreore C.L., Bartol T.M., Coggan J.S., Keller D.X., Sosinsky G.E., Ellisman M.H., Sejnowski T.J. Computational modeling of three-dimensional electrodiffusion in biological systems: Application to the node of Ranvier. Biophys. J. 2008;95:2624–2635. doi: 10.1529/biophysj.108.132167.</ref>befassten sich mit dem entmutigenden Problem der Modellierung der dreidimensionalen Elektrodiffusion von Ionenflüssen in Mikro- und Nanodomänen, die Ionenkanäle am Knoten von Ranvier umgeben. In diesem einzigartigen Modell werden die Ionenflüsse durch Poisson-Nernst-Planck-Gleichungen mit Finite-Volumen-Techniken berechnet. Die Flüsse und elektrischen Potentiale wurden innerhalb von Voxeln bewertet, die durch ein Delaunay-Voronoi-Netz des Axons innerhalb und außerhalb der Membran gebildet wurden. Wichtig ist, dass der Algorithmus validiert wurde und die Ergebnisse mit den Vorhersagen des Kabelmodells übereinstimmten. Abweichungen von Kabelmodellvorhersagen bei kleineren Clustergrößen zeigten die Bedeutung des eigenen elektrischen Felds jedes Kanals. | |||
Das obige Beispiel unterstreicht den Punkt, dass Modelle mehr als Ionenkanäle und Membranpotential simulieren können. In der Tat können und müssen Modelle tiefer in biophysikalische Mechanismen wie Elektrodiffusion und in Signalwege eintauchen, die letztendlich dazu dienen, die Funktion und Expression von Ionenkanälen zu regulieren. Eine vielversprechende Methode namens Biochemical Systems Theory (BST) könnte in Zukunft nützlich sein, um die Wirkung von Arzneimitteln auf systemischer Ebene vorab zu überprüfen. Broome und Coleman<ref>Broome T.M., Cole.man R.A. A mathematical model of cell death in multiple sclerosis. J. Neurosci. Methods. 2011;201:420–425. doi: 10.1016/j.jneumeth.2011.08.008. [PubMed] [CrossRef] [Google Scholar]</ref> demonstrierten die Leistungsfähigkeit dieser Technik durch die Modellierung mehrerer biochemischer Wege in Neuronen, die mit dem Zelltod während MS in Verbindung stehen, einschließlich der Bildung reaktiver Sauerstoff- und Stickstoffspezies, der Ca2+-Dynamik, der Bildung von Todeskomplexen, der Freisetzung von apoptotischen Faktoren und Entzündungsreaktionen zusammen mit drei verschiedenen Zuständen: normal, MS Krankheit und Behandlung. Auf atomarer Ebene wurde ein Computermodell der Struktur des Myelin-Basisproteins (MBP) durchgeführt, da posttranslationale Modifikationen von MBP zur Demyelinisierung bei MS beitragen können.<ref>Ridsdale R.A., Beniac D.R., Tompkins T.A., Moscarello M.A., Harauz G. Three-dimensional structure of myelin basic protein. II. Molecular modeling and considerations of predicted structures in multiple sclerosis. J. Biol. Chem. 1997;272:4269–4275. doi: 10.1074/jbc.272.7.4269. [PubMed] [CrossRef] [Google Scholar]</ref>Es ist wichtig, seine 3D-Struktur zu verstehen, um Interaktionsstellen mit anderen Molekülen vorherzusagen, aber eine Kristallstruktur für dieses Protein könnte niemals direkt gemessen werden. Diese Art der Modellierung kann daher einen effektiven Weg darstellen, um die Struktur vorherzusagen, indem das Wissen über die Aminosäuresequenz mit Informationen von ähnlichen Proteinen kombiniert wird. Die Herausforderung und die wahre Stärke der Modellierung liegt in der Verbindung von Mechanismen, die auf sehr unterschiedlichen Ebenen ablaufen, von der molekularen Struktur bis zum Nervensystem als Ganzes und darüber hinaus, um zu untersuchen, wie das Nervensystem mit dem Immunsystem interagiert. | |||
Modelle von Immunfaktoren. Zwar gibt es zahlreiche Computermodelle des Immunsystems,<ref>Pigozzo A.B., Macedo G.C., Santos R.W., Lobosco M. On the computational modeling of the innate immune system. BMC Bioinform. 2013;14 doi: 10.1186/1471-2105-14-S6-S7. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> diejenigen, die sich auf MS beziehen, modellieren typischerweise genetische Interaktionsnetzwerke, die entweder als Sätze gewöhnlicher Differentialgleichungen (ODEs) oder als Boolesche Netzwerke dargestellt werden. Ein systembiologisches Modell eines möglichen zellulären Mechanismus von RRMS fand einen Zusammenbruch der Homöostase von Effektor (Teff) und regulatorischen T (Treg) Zellen.<ref>Doerck S., Göbel K., Weise G., Schneider-Hohendorf T., Reinhardt M., Hauff P., Schwab N., Linker R., Mäurer M., Meuth S.G., et al. Temporal pattern of ICAM-I mediated regulatory T cell recruitment to sites of inflammation in adoptive transfer model of multiple sclerosis. PLoS ONE. 2010;5:e15478. doi: 10.1371/journal.pone.0015478. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>De Mendizábal N.V., Carneiro J., Solé R.V., Goñi J., Bragard J., Martinez-Forero I., Martinez-Pasamar S., Sepulcre J., Torrealdea J., Bagnato F., et al. Modeling the effector-regulatory T cell cross-regulation reveals the intrinsic character of relapses in Multiple Sclerosis. BMC Syst. Biol. 2011;5doi: 10.1186/1752-0509-5-114. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> Durch die Änderung von Parametern in der Teff-Treg-Rückkopplungsschleife reproduzierte das Modell unter kontinuierlichem stochastischen externen Stimulus von Antigenen spontane und scheinbar stochastische Immunrückfälle. Der irreversible Schaden aus jeder Episode sammelt sich im Laufe der Zeit an. Zu den neuartigen Vorhersagen gehört der Vorschlag, dass der Zeitpunkt der Treg-Immuntherapie im Immunreaktionszyklus entscheidend dafür ist, ob eine Intervention vorteilhaft oder schädlich ist. | |||
Modelle der mitochondrialen Dysfunktion. Wie oben erwähnt, ermöglicht Myelin eine energieeffizientere AP-Leitung entlang des Axons. Der erhöhte Energiebedarf, der an das demyelinisierte Axon gestellt wird, stellt eine weitere Herausforderung für das betroffene Neuron dar. Über den Verlust der Salzleitung hinaus gibt es zunehmend Hinweise auf eine entscheidende Rolle von Astrozyten und Oligodendrozyten bei der Energieversorgung von Neuronen, und dieser Prozess war auch Gegenstand von Computermodellen.<ref>Jolivet R., Coggan J.S., Allaman I., Magistretti P.J. Multi-timescale modeling of activity-dependent metabolic coupling in the neuron-glia-vasculature ensemble. PLoS Comput. Biol. 2015;11:e1004036. doi: 10.1371/journal.pcbi.1004036. [PMC free article] [PubMed] [CrossRef]</ref> | |||
Es gibt viele Möglichkeiten, wie die mitochondriale Funktion schief gehen kann, und die kompensatorischen Wege sind ebenso kompliziert.<ref name=":8" /><ref name=":12" /><ref name=":13" />Beispielsweise kann eine mitochondriale Dysfunktion in einer gestörten Ca2+-Signalübertragung innerhalb der Mitochondrien, gestörten Protonengradienten oder Elektronenketten, einem Reduktions-Oxidations-Ungleichgewicht sowie den Folgen einer reduzierten ATP-Verfügbarkeit, lokal und global, verwurzelt sein. Beispielsweise wurden Multiskalenmodelle des Herzens verwendet, um eine veränderte mitochondriale Ca2+-Signalübertragung mit Arrhythmie in Verbindung zu bringen [60]. Unter Verwendung von mitochondrialen Netzwerkmodellen zeigte diese Studie, wie sogar etwas zu viele reaktive Sauerstoffspezies einen zellweiten Zusammenbruch des mitochondrialen Membranpotentials auslösen können. Dies ist ein hervorragendes Beispiel dafür, wie ein Computermodell Prozesse auf verschiedenen Ebenen verknüpfen kann, und genau diese Verknüpfungen müssen im Bereich der Demyelinisierungskrankheiten hergestellt werden. | |||
=== | === Fehlende Verbindungen und die Notwendigkeit der Integration === | ||
Auf dem Gebiet der demyelinisierenden Erkrankungen haben sich die Modellierungsbemühungen traditionell auf Axonmodelle konzentriert, die darauf abzielen, verschiedene Aspekte der Erregbarkeit zu erklären. Aber wie oben skizziert, haben diese Modelle eine enorme Entwicklung in ihrer Komplexität durchlaufen. Dabei begannen sich Modelle auf verschiedenen biologischen Skalen zu verschmelzen. Beispielsweise haben jetzt Modelle begonnen, sich mit der Regulation von Ionenkonzentrationen und deren Folgen für langsame Erregbarkeitsänderungen, Energieverbrauch und Toxizität zu befassen. Ein computergestützter Ansatz wird notwendig sein, um parallele und multifaktorielle Ätiologien zu integrieren, die mit kognitivem Verfall verbunden sind, wie z. B. Signalübertragung des Immunsystems, Energiestoffwechsel, Wechselwirkungen zwischen grauer und weißer Substanz und genetische Netzwerke [117]..<ref>Zeis T., Allaman I., Gentner M., Schroder K., Tschopp J., Magistretti P.J., Schaeren-Wiemers N. Metabolic gene expression changes in astrocytes in Multiple Sclerosis cerebral cortex are indicative of immune-mediated signaling. Brain Behav. Immun. 2015;48:315–325. doi: 10.1016/j.bbi.2015.04.013.[PubMed] [CrossRef] [Google Scholar]</ref> Diese fortgesetzten Bemühungen beginnen, die riesigen und miteinander verbundenen Rückkopplungsschleifen aufzudecken, die über eine breite Palette von räumlichen und zeitlichen Skalen hinweg wirken. Allerdings stecken solche Bemühungen noch in den Kinderschuhen und es bestehen noch große Lücken in der Modellierung demyelinisierender Erkrankungen. Es ist einfacher zu beschreiben, was modelliert wurde, als was nicht. Ein wirklich integriertes Modell mit mehreren Zelltypen, das alle hypothetischen ätiologischen Faktoren anspricht, ist noch nicht realisiert. Zu den unerforschten oder wenig erforschten, aber potenziell nützlichen Zielen für die Modellierung gehören die Pathologie der grauen Substanz, die wässrigen Schichten der Myelinscheide, der Energiestoffwechsel und vielleicht am wichtigsten die Multiskalen- oder integrierte Modellierung. Man sollte erkennen, dass die notwendigen Werkzeuge in anderen Studienbereichen vorhanden sind und daher leicht auf die Untersuchung von Demyelinisierungskrankheiten angewendet werden können. | |||
=== | === Schlussfolgerungen === | ||
Die normale physiologische Funktion des ZNS oder PNS beruht auf einem stark regulierten Zusammenspiel von Neuronen, Glia, Gefäßsystem und Immunzellen. Dieser Prozess umfasst und integriert zahlreiche Zell- und Signalkomponenten, die ein dynamisches, rechnerisches Ganzes erzeugen. Wenn ein Teil schief geht, muss das gesamte System kompensieren. Selbst wenn es der Kompensation gelingt, die offensichtlichsten Folgen der Demyelinisierung zu retten, kehren bestimmte Prozesse möglicherweise nicht in einen völlig normalen Zustand zurück, was über längere Zeiträume zu Problemen führen kann. Die daraus resultierenden Symptome sind eine verwirrende Mischung aus direkten und kompensatorischen Veränderungen, die sich kontinuierlich weiterentwickeln. Die Gesamtkomplexität hat sich als unlösbar für eine effiziente experimentelle Dissektion erwiesen. Die Anwendung computergestützter Modellierungstechniken stellt einen unschätzbaren Ansatz dar, um aus der Sackgasse herauszukommen und eine neue Ära des Verständnisses und der Entdeckung einzuleiten. | |||
== | == Danksagungen == | ||
Unterstützung durch den Canadian Institutes of Health Research New Investigator Award und den Ontario Early Researcher Award (SAP). Wir danken Heiki Blum für die Unterstützung bei der Figurenvorbereitung. | |||
== | == Autorenbeiträge == | ||
Alle Autoren haben zum Verfassen dieses Manuskripts beigetragen. Zahlen wurden von Sven G. Meuth zur Verfügung gestellt. | |||
== | == Interessenskonflikte == | ||
Die Autoren geben keinen Interessenkonflikt an. | |||
== | == Artikelinformationen == | ||
Int J Mol Sci. 2015 Sep; 16(9): 21215–21236. | Int J Mol Sci. 2015 Sep; 16(9): 21215–21236. | ||
Published online 2015 Sep 7. doi: 10.3390/ijms160921215 | Published online 2015 Sep 7. doi: 10.3390/ijms160921215 | ||
| Line 215: | Line 216: | ||
3Neurosciences and Mental Health, the Hospital for Sick Children, Toronto, ON M5G 1X8, Canada; E-Mail: ac.sdikkcis@ttocserp.evets | 3Neurosciences and Mental Health, the Hospital for Sick Children, Toronto, ON M5G 1X8, Canada; E-Mail: ac.sdikkcis@ttocserp.evets | ||
4Department of Physiology and the Institute of Biomaterials and Biomedical Engineering, University of Toronto, Toronto, ON M5G 1X8, Canada | 4Department of Physiology and the Institute of Biomaterials and Biomedical Engineering, University of Toronto, Toronto, ON M5G 1X8, Canada | ||
* | *Autor, an den die Korrespondenz gerichtet werden soll; E-Mail: gro.xniloruen@yaj; Tel.: +1-858-243-6720. | ||
Received 2015 May 26; Accepted 2015 Aug 25. | Received 2015 May 26; Accepted 2015 Aug 25. | ||
Copyright © 2015 by the authors; licensee MDPI, Basel, Switzerland. | Copyright © 2015 by the authors; licensee MDPI, Basel, Switzerland. | ||
Dieser Artikel ist ein Open-Access-Artikel, der unter den Bedingungen der Creative Commons Attribution-Lizenz verbreitet wird (http://creativecommons.org/licenses/by/4.0/). | |||
Artikel aus dem International Journal of Molecular Sciences werden hier mit freundlicher Genehmigung des Multidisciplinary Digital Publishing Institute (MDPI) bereitgestellt. | |||
== Bibliography == | == Bibliography == | ||
Latest revision as of 15:32, 4 May 2023
| Title | Physiologische Dynamik bei demyelinisierenden Krankheiten: Enträtseln komplexer Zusammenhänge durch Computermodellierung |
| Authors | Jay S. Coggan · Stefan Bittner · Klaus M. Stiefel · Sven G. Meuth · Steven A. Prescott |
| Source | Document |
| Date | 2021 |
| Journal | Int J Mol Sci. |
| DOI | 10.3390/ijms160921215 |
| PUBMED | https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4613250/#!po=53.5714 |
| PDF copy | |
| License | CC BY |
| This resource has been identified as a Free Scientific Resource, this is why Masticationpedia presents it here as a mean of gratitude toward the Authors, with appreciation for their choice of releasing it open to anyone's access | |
This is free scientific content. It has been released with a free license, this is why we can present it here now, for your convenience. Free knowledge, free access to scientific knowledge is a right of yours; it helps Science to grow, it helps you to have access to Science
This content was relased with a 'CC BY' license.
You might perhaps wish to thank the Author/s
Physiologische Dynamik bei demyelinisierenden Krankheiten: Enträtseln komplexer Zusammenhänge durch Computermodellierung
Free resource by Jay S. Coggan · Stefan Bittner · Klaus M. Stiefel · Sven G. Meuth · Steven A. Prescott
|
Physiological Dynamics in Demyelinating Diseases: Unraveling Complex Relationships through Computer Modeling
Jay S. Coggan, Stefan Bittner, [...], and Steven A. Prescott
Additional article information
Abstrakt
Trotz intensiver Forschung stehen für die meisten neurologischen Erkrankungen nur wenige Behandlungen zur Verfügung. Demyelinisierende Erkrankungen sind keine Ausnahme. Dies ist vielleicht nicht überraschend angesichts der multifaktoriellen Natur dieser Krankheiten, die komplexe Wechselwirkungen zwischen Zellen des Immunsystems, Glia und Neuronen umfassen. Bei Multipler Sklerose zum Beispiel herrscht unter Forschern Uneinigkeit über die Ursache oder gar welches System oder welcher Zelltyp Ground Zero sein könnte. Diese Situation schließt die Entwicklung und strategische Anwendung mechanismusbasierter Therapien aus. Wir werden diskutieren, wie Computermodellierung, die auf Fragen auf verschiedenen biologischen Ebenen angewendet wird, dabei helfen kann, unterschiedliche Beobachtungen miteinander zu verknüpfen und komplexe Mechanismen zu entschlüsseln, deren Lösungen einem einfachen Reduktionismus nicht zugänglich sind. Indem sie überprüfbare Vorhersagen treffen und kritische Lücken im vorhandenen Wissen aufdecken, können solche Modelle die Forschung unterstützen und einen rigorosen Rahmen bieten, in den neue Daten integriert werden können, sobald sie gesammelt werden. Heutzutage gibt es keinen Mangel an Daten; Die Herausforderung besteht darin, dem Ganzen einen Sinn zu geben. In dieser Hinsicht ist die Computermodellierung ein unschätzbares Werkzeug, das letztendlich unser Verständnis, die Diagnose und Behandlung von demyelinisierenden Krankheiten verändern könnte.
Schlüsselwörter: Myelin, Demyelinisierung, Multiple Sklerose, neurodegenerative Erkrankung, Computermodell, Wirkstoffforschung
Einführung
Die Nervensysteme von Wirbeltieren werden aufgrund ihres Aussehens und der entsprechenden funktionellen Rollen oft in graue und weiße Substanz unterteilt. Während die graue Substanz größtenteils aus Zellkörpern und Dendriten besteht, enthält die weiße Substanz hauptsächlich Axone und hat ihren Namen von den Lipidmembranschichten namens Myelin, die eng um diese Axone gewickelt sind.[1] Myelin stammt aus verschiedenen Klassen von Gliazellen, die als Oligodendrozyten im Zentralnervensystem (ZNS) und Schwann-Zellen im peripheren Nervensystem (PNS) bezeichnet werden.
Die durch die Myelinschichten bereitgestellte elektrische Isolierung verbessert die axonale Funktion, indem sie sowohl die Energieeffizienz als auch die Leitungsgeschwindigkeit von Aktionspotentialen (APs) erhöht. Diese beiden Funktionen haben möglicherweise ihre relative Bedeutung während der Evolution geändert.[2] Myelin tauchte erstmals im Ordovizium (485 bis 443 ma oder Millionen Jahre vor der Gegenwart) auf, nachdem sich die Vorfahren der Neunaugen und Schleimaale von den übrigen Wirbeltierlinien abgespalten hatten.[3]Mit einigen interessanten Ausnahmen,[4][5] Myelin oder analoge Strukturen kommen in allen Wirbeltieren vor und sind entscheidend für das reibungslose Funktionieren ihres Nervensystems. Der ungefähre Zeitpunkt der Entwicklung von Myelin kann aus der bekannten Zeit der Divergenz zwischen Akkordaten ohne (Agnatha) und mit (alle anderen Wirbeltiere) Myelin abgeleitet werden.
Die Myelinumhüllung wird durch regelmäßig beabstandete, nicht myelinisierte Abschnitte unterbrochen, die als Ranvier-Knoten bekannt sind. Myelin beschleunigt die Leitung, indem es den transmembranen Ladungsfluss durch Ionenkanäle innerhalb der Knoten einschränkt. Innerhalb der sogenannten Internodien fließt Strom das Axon hinunter, wobei nur wenig davon durch die isolierte Zellmembran fließt. Das AP wird an jedem Knoten regeneriert, an dem die Dichte der spannungsgesteuerten Natrium- und Kaliumkanäle sehr hoch ist. Dieser Vorgang wird als „saltatorische Leitung“ bezeichnet, da der AP scheinbar von Knoten zu Knoten springt. Störungen in diesem Schnellfeuer-Kommunikationssystem können mit einer Reihe von Funktionsstörungen des Nervensystems in Verbindung gebracht werden.[6]
Axone scheinen in mehrfacher Hinsicht an physikalischen Grenzen zu operieren. Ein interessantes Beispiel ist, dass die Größe von Axonen durch das thermische Rauschen beschränkt zu sein scheint, das Ionenkanalproteinen innewohnt; Jedes Axon, das dünner als 0,1 μm ist, wäre aufgrund seines hohen Rauschpegels für die Informationsübertragung unbrauchbar.[7] Interessanterweise ist 0,1 μm auch ungefähr der kleinste Axondurchmesser, der in Nervensystemen beobachtet wird [7]. Diese und ähnliche Ergebnisse deuten darauf hin, dass Axone und ihre Unterstrukturen fein abgestimmte biologische Geräte sind, dass die Abstimmung jedoch offensichtlich unter pathologischen Bedingungen gestört werden kann.[8]
Die Demyelinisierung setzt funktionelle Veränderungen in Gang, die für klinische Merkmale wichtig sind, aber nicht ohne weiteres durch immunologische oder radiologische Veränderungen erklärt werden können. Die Lage einer Plaque sagt voraus, welches System betroffen sein wird (motorisch vs. sensorisch, visuell vs. taktil), aber nicht, wie es betroffen sein wird. Dies unterstreicht die Bedeutung der Beurteilung der Funktion (zusätzlich zur Struktur) und wie sie sich nach der Demyelinisierung verändert. Nach der Einführung demyelinisierender Krankheiten werden wir erörtern, wie die klinischen Manifestationen dieser Krankheiten verschiedene pathologische Veränderungen der Axonfunktion widerspiegeln. Wir werden argumentieren, dass das Verständnis dieser Veränderungen und die vollständige Nutzung dieses Verständnisses für diagnostische und therapeutische Zwecke enorm von der Computermodellierung profitieren können.
Demyelinisierende Krankheiten
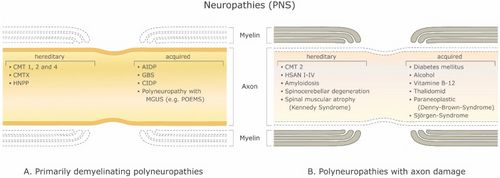
Es gibt eine große Anzahl demyelinisierender Erkrankungen, die sowohl das PNS (Abbildung 1) als auch das ZNS (Abbildung 2) betreffen. Die Ätiologien sind heterogen und reichen von genetischen Störungen bis hin zu metabolischen, infektiösen oder Autoimmunmechanismen. Multiple Sklerose (MS) ist mit schätzungsweise 3 Millionen Patienten weltweit die am weitesten verbreitete dieser Erkrankungen. Die zugrunde liegende Ursache ist ungewiss, es wird jedoch angenommen, dass sie eine genetische Veranlagung für Umwelteinflüsse beinhaltet[9][10]und kann immunologische, Reaktionsfähigkeit auf Traumata, biophysikalische, genetische und/oder metabolische Komponenten umfassen.[10]Die Symptome und Läsionen müssen zeitlich und räumlich vielfältig sein. Das heißt, es müssen zeitlich mehrere Episoden auftreten, an denen getrennte Teile des zentralen Nervensystems beteiligt sind. Es ist nicht klar, ob die entzündliche Demyelinisierung ein primäres oder sekundäres Ereignis innerhalb des Krankheitsprozesses ist.[9][11][12] Die meisten Behandlungen zielen auf das Immunsystem oder die Blut-Hirn-Schranke ab, aber auch die Behandlung neurologischer Symptome durch Modulation der axonalen Erregbarkeit spielt eine wichtige Rolle (siehe unten)..
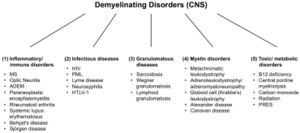
Klinische Bewertung von Multipler Sklerose
Die Symptome sind vielfältig und können bei einem einzelnen Patienten in allen Kombinationen auftreten. Die Diagnose erfordert, dass im Laufe der Zeit mehrere Läsionen und symptomatische Episoden vorliegen müssen, an denen nicht verbundene Teile des ZNS beteiligt sind. Darüber hinaus neigen die Symptome dazu, schlecht mit radiologischen Messungen zu korrelieren. In den allermeisten Fällen korrelieren individuelle klinische Merkmale nicht gut mit MRT-Befunden, insbesondere bei zerebralen Läsionen.[13][14][15] Diese klinisch-radiologische Dissoziation verlangt nach einem besseren theoretischen Verständnis der Demyelinisierungssymptome und der zugrunde liegenden biophysikalischen Veränderungen, die sie begleiten, was natürlich die Frage aufwirft, was genau mit den betroffenen Axonen passiert.
Die Symptome sind oft intermittierend und können sowohl Funktionsverlust (negative Symptome wie Taubheitsgefühl, Muskelschwäche, Kribbeln, Blindheit, Inkontinenz, Verlust der Sexualfunktion, Gleichgewichtsverlust, undeutliche Sprache, Verstopfung, beeinträchtigende Müdigkeit, Depression, kognitive Dysfunktion) umfassen , Unfähigkeit zu schlucken, Gangstörungen und Verlust der Atemkontrolle) und Funktionsgewinn (unter anderem positive Symptome wie Krämpfe, Spastik, Krämpfe, Schmerzen, verschwommenes oder doppeltes Sehen, Harndrang oder Zögern, Übelkeit)..[16]Frühe differenzialdiagnostische Kriterien sind das Lhermitte-Zeichen (Halsbeugegefühle) und das Uhthoff-Phänomen (temperaturabhängige Verschlechterung der Beschwerden). Die Differenzialdiagnose der MS richtet sich eng nach den McDonald-Kriterien.[17]
In humandiagnostischen Studien zu visuell, sensorisch oder motorisch evozierten Potentialen (VEP, SEP, MEP) kann nur die Latenz oder Leitungsgeschwindigkeit genau gemessen werden (mit etwa 30–40 % Schwankungen zwischen verschiedenen Labors). Aber diese Messungen geben wenig Aufschluss über zugrunde liegende Mechanismen, die eine Verlangsamung oder Blockierung der Leitung beinhalten, oder morphologische oder funktionelle Faktoren wie Verzweigung, Demyelinisierung, Remyelinisierung, axonale Verjüngung (Abnahme der Querschnittsfläche), Dämpfung oder erneutes Wachstum, temperaturbedingte Änderungen der Leitung , oder Malpolarisation (Hyper oder Hypo). Nichtsdestotrotz kann die Art der demyelinisierenden Läsion Hinweise auf die Ätiologie geben und daher die Behandlung leiten; Beispielsweise scheinen genetische Faktoren stärker mit internodalen Krankheitsprozessen zu korrelieren, und immunologische Dysfunktionen verursachen paranodale Anomalien.[18]
Eine Reihe von Tests werden routinemäßig verwendet, um die neurale Funktion zu beurteilen. Bei der Elektroneurographie wird ein kurzer elektrischer Stimulus an einer anatomisch vordefinierten Position an einen peripheren Nerv angelegt, um die Latenz und Amplitude des zusammengesetzten Aktionspotentials an einer anderen Stelle entlang des Nervs zu messen. Die Ergebnisse müssen in Kombination mit klinischen Befunden und Tests (z. B. Elektromyographie) interpretiert werden, aber es ist wichtig, dass verschiedene Krankheiten unterschiedliche Muster elektroneurographischer Veränderungen aufweisen. Dies ist nicht nur für diagnostische Zwecke wichtig, sondern kann auch auf spezifische pathologische Veränderungen der Axonfunktion hinweisen, die wiederum bei der Wahl der Therapie hilfreich sein könnten (wenn die Axonpathobiologie verstanden würde; siehe unten). Unter Verwendung von Threshold-Tracking wurde die Erregbarkeit beim Menschen für verschiedene periphere demyelinisierende Erkrankungen gemessen, darunter die Charcot-Marie-Tooth-Krankheit Typ 1A (CMT1A), die chronisch entzündliche demyelinisierende Polyneuropathie (CIDP), das Guillain-Barré-Syndrom (GBS) und die multifokale motorische Neuropathie (MMN). ).[19][20][21][22][23][24][25]Die Herausforderung liegt in der Interpretation dieser Beobachtungen. Zu diesem Zweck hat die Gruppe von Stephanova zunehmend größere Grade systematischer und fokaler Demyelinisierung von Motorfasern simuliert, um zu versuchen, die beobachteten physiologischen Veränderungen zu erklären[26][27][28][29][30][31] (siehe Abschnitt „Modellierung“ weiter unten).
Beteiligung von Zellkörpern
Die Progression von schubförmig remittierender MS (RRMS) zur sekundär progredienten MS (SPMS) ist mit einer stärkeren Beteiligung der Pathologie der grauen Substanz verbunden, obwohl eine Beteiligung der Axone/der grauen Substanz bereits in frühen Krankheitsstadien beobachtet werden kann.[32][33][34][35] Die Schädigung der grauen Substanz gilt als zugrunde liegender Mechanismus des Krankheitsverlaufs und der dauerhaften Behinderung bei MS-Patienten und wird durch den Verlust der Hirnparenchymfraktion oder des Gehirnvolumens durch MRT oder klinisch durch Progression auf der erweiterten Behinderungsstatusskala (EDSS) gemessen.[36]Der Übergang von RRMS zu SPMS ist ein Vorzeichen für den Mangel an Therapeutika zur Bekämpfung der verschlimmerten körperlichen und kognitiven Verschlechterung, mit der die meisten SPMS-Patienten konfrontiert sind.[9][37]
Behandlung
Die wichtigsten Eingriffe bei MS umfassen die Modulation der Immunantwort mit beispielsweise Methly-Prednisolon, Interferon betas, Glatirameracetat oder Fingolimod oder die Verhinderung der Überquerung der BHS durch Entzündungszellen (monoklonale Antikörper, z. B. Tysabri (Anti-α4-Integrin, Natalizumab )). Vor kurzem wurden die ersten beiden oralen Wirkstoffe (Fumarat und Teriflunomid) sowie der gegen CD52 gerichtete Antikörper Natalizumab für die Behandlung von RRMS zugelassen, die erfolgreich mit Erstlinientherapien wie Interferonen, Glatirameracetat oder Fingolimod oder durch behandelt werden kann Zweitlinientherapien, aber progressive Formen (PPMS, SPMS) stellen immer noch einen ungedeckten biomedizinischen Bedarf dar.[38] Antineoplastika werden in extrem fortgeschrittenen oder schwierigen Fällen eingesetzt.[39]
Krankheitsmodifizierende Medikamente sind entscheidend, um den Demyelinisierungsprozess zu stoppen oder zumindest abzuschwächen, aber ebenso wichtig ist es, die Symptome zu behandeln, die sich aus einer bereits aufgetretenen Demyelinisierung ergeben. Die Ionenkanalmodulation wird mit dem Aufkommen neuer Ionenkanalblocker wie Ampyra (K-Kanal-Blockade) zunehmend vielversprechend.[40][41] Die Kaliumkanalblockade soll die Erregbarkeit von Axonen verbessern. Das Problem ist, dass solche Eingriffe, obwohl sie bei der Behandlung negativer Symptome und der Wiederherstellung der Funktion wirksam sind, dazu neigen, positive Symptome zu verschlimmern.[42] Umgekehrt kann die Behandlung positiver Symptome wie Spasmen mit Antiepileptika wie beispielsweise Carbamazepin negative Symptome verstärken.[43] Tatsächlich reduziert das Blockieren von Na+-Kanälen nicht nur positive Symptome, es kann auch neuroprotektiv sein (weil die Ansammlung von Na+ dazu führt, dass Na+/Ca2+-Austauschmechanismen Neuronen mit Ca2+ beladen, das exzitotoxisch ist).[44] (Abbildung 3), aber diese Vorteile gehen zu Lasten negativer Symptome. Daher und insbesondere bei einem Patienten, der eine Mischung aus positiven und negativen Symptomen aufweist, sind die Behandlungsmöglichkeiten eingeschränkt.
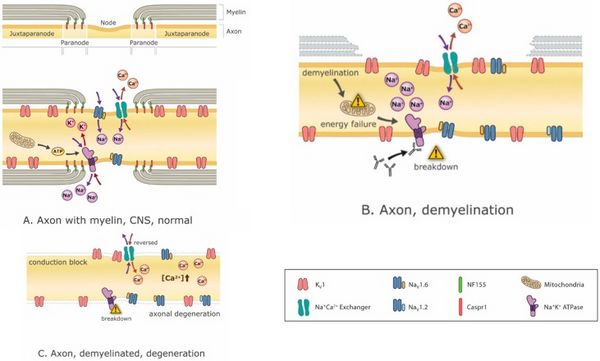
Die obige Diskussion wirft den wichtigen Punkt auf, dass, obwohl viel Lärm um Immunmechanismen gemacht wurde, ihre Verbindung mit klinischen Veränderungen weitgehend korreliert ist. Man muss die intermediären Wirkungen auf die axonale Funktion berücksichtigen, nämlich die primären und sekundären (kompensatorischen) Änderungen der Axon-Erregbarkeit, um zu verstehen, wie die neurologische Funktion verändert wird. Diese Veränderungen sind keine einfachen und direkten Folgen der Demyelinisierung, sondern legen stattdessen nahe, dass sich die axonale Physiologie selbst als Reaktion auf die Demyelinisierung verändert. Einige dieser Veränderungen sind adaptiv, während andere maladaptiv sind, oder vielleicht können adaptive Veränderungen maladaptiv werden, wenn sich die Situation (Myelinisierungsstatus) weiterentwickelt. Wenn Veränderungen in der Axonphysiologie die Manifestation verschiedener Symptome diktieren, dann wird die Symptombehandlung weitgehend auf Behandlungen fallen, die darauf abzielen, die Axonphysiologie zu manipulieren. Die strategische Entwicklung solcher Behandlungen erfordert ein tiefes, mechanistisches Verständnis der axonalen Erregbarkeit und ihrer Regulation.
Axonpathobiologie
Strukturelle und molekulare Veränderungen
Axone sind stark von Demyelinisierung betroffen. Die Axonmorphologie wird unregelmäßig oder geschwollen, oft mit einem perligen Aussehen. Eine fokale Akkumulation von Proteinen (durch schnellen axonalen Transport) wird ebenfalls beobachtet. Bei chronisch aktiven Plaques ist ein axonaler Verlust von 20–80 % in der weißen Substanz der Periplaque und in der normalen entfernten weißen Substanz erkennbar.[45] Bei früh aktiven und chronisch aktiven Plaques wird angenommen, dass die Schädigung durch Entzündungs- und Immunfaktoren verursacht wird, die während der akuten entzündlichen Demyelinisierung freigesetzt werden. Vorgeschlagene Mediatoren umfassen Proteasen, Cytokine, Excitotoxine und freie Radikale. Neuronale Antigene sind Ziele einer Immunreaktion, die zu einer ZNS-Entzündung führt. Andere Faktoren, die eine axonale Dysfunktion oder den Tod verursachen, umfassen einen Mangel an trophischer Unterstützung durch Myelin und Oligodendrozyten, Schäden durch lösliche oder zelluläre Immunfaktoren, die noch in der inaktiven Plaque vorhanden sind, und chronisches Mitochondrienversagen bei erhöhtem Energiebedarf.[46] Eine entscheidende Rolle für Oligodendrozyten und Schwann-Zellen beim Überleben von Axonen wurde auch den Peroxisomen, dem Lipidstoffwechsel und der Entgiftung reaktiver Sauerstoffspezies (ROS) zugeschrieben.[47]
Remyelinisierung wird häufig als Schattenplaques beobachtet, die durch die Rekrutierung von undifferenzierten Oligodendrozyten-Vorläufern gebildet werden, die zu den Läsionen wandern und diese umgeben, wodurch dünne Schichten der Remyelinisierung ermöglicht werden.[48] Dieser Prozess tritt meist in akuten aktiven Plaques auf, aber auch in chronischen Phasen. Diese Beobachtung löste die Entwicklung eines neuen monoklonalen Antikörpers aus, der gegen LINGO-1 gerichtet ist (Anti-LINGO-1). Die Bindung von LINGO-1 an Nogo-Rezeptoren verhindert remyelinisierende Prozesse im ZNS; die Hemmung dieser Wechselwirkung ermöglicht somit eine signifikante Remyelinisierung bei Tieren mit experimenteller autoimmuner Enzephalomyelitis.[49]
Während des Krankheitsprozesses können autoreaktive Lymphozyten und Makrophagen die Blut-Hirn-Schranke überwinden und sich im Gehirn und Rückenmark ansammeln.[50] Regulatorische Lymphozyten (Tregs) unterdrücken Effektorzellen nicht – meist zytotoxische CD8+-Zellen.[51] Die Freisetzung von entzündungsfördernden Zytokinen rekrutiert naive Mikroglia, die durch Wechselwirkungen mit Fc- und Komplementrezeptoren Kontakt mit einer Oligodendrozyten-Myelin-Einheit aufnehmen. Ein zytotoxisches, den Tod auslösendes Signal wird dann durch den oberflächengebundenen Tumornekrosefaktor α (TNFα) übertragen..[52] Dies tritt zusammen mit ausgedehnten axonalen Schäden auf.[10]
Lucchinetti el al.[46]schlugen vier unterschiedliche Immunmuster der Plaquebildung vor, die bei Patienten in verschiedenen Stadien der Krankheit gefunden wurden. Plaques vom Typ I und II werden von T-Lymphozyten- und Makrophagen-Entzündungen dominiert und es wird angenommen, dass sie T-Zell- bzw. T-Zell-plus-Antikörper-Autoimmun-Enzephalomyelitis-Modelle nachahmen. Myelinverlust in Typ-I-Plaques kann durch toxische Faktoren verursacht werden, die von aktivierten Makrophagen freigesetzt werden, während IgG- und Komplementablagerung auf eine Rolle von Antikörpern in Typ-II-Plaques hindeuten. Im Gegensatz dazu zeigen die Muster III und IV eine große Oligodendrozyten-Dystrophie. Es wird angenommen, dass Muster III mit Hypoxie-induzierten Läsionen zusammenhängt, die durch Defekte in der mitochondrialen Funktion verursacht werden,[53] wohingegen Muster-IV-Läsionen mit tiefgreifendem nicht-apoptotischem Tod von Oligodendrozyten in der weißen Substanz der Periplaque assoziiert sind.
Barnett and Prineas[54] analysierten Läsionen von Patienten direkt nach dem Einsetzen eines Rezidivs, während dessen eine aktive Plaquebildung andauerte. Ihre Ergebnisse legen nahe, dass Oligodendrozyten-Apoptose und Glia-Aktivierung während der frühen aktiven Plaquebildung in Abwesenheit von entzündlichen Lymphozyten oder Myelin-Phagozyten auftreten. Sie schlugen vor, dass die Anfälligkeit von Oligodendrozyten, die in Lucchinettis Typ-III-Muster beschrieben wird, in den frühen Stadien aller Plaquebildung vorhanden ist und der Auslöser für die nachfolgende postapoptotische Nekrose ist, die in späteren Stadien die Phagozytose von Myelin durch Makrophagen einleitet. In-vitro-Analysen dieses Prozesses haben Komplementkaskaden, Tumornekrosefaktoren oder gasförmige Second Messenger impliziert.[55]Obwohl die Identifizierung von Plaques und die Überwachung ihres Fortschritts einen wichtigen klinischen Wert haben, gibt es nur eine bescheidene Korrelation zwischen der Belastung durch demyelinisierende Läsionen, wie sie durch herkömmliches MRI bestimmt wird, und der klinischen Behinderung von Patienten mit MS (siehe oben).
Funktionale Änderungen
Zu den Mechanismen der funktionellen Beeinträchtigung während der Demyelinisierung gehören häufig die Störung der transmembranen Na+-, K+- und Ca2+-Ionen, die Ausbreitung ihrer entsprechenden Ionenkanäle, eine Abnahme der Effizienz der AP-Leitung und eine daraus resultierende Stoffwechselkrise (Abbildung 3). Eine Demyelinisierung kann leicht einen Leitungsausfall innerhalb des betroffenen Axons erklären. Wenn die Leitung nicht vollständig ausfällt, kann die Leitungsgeschwindigkeit dennoch verlangsamt werden, und eine unterschiedliche Verlangsamung über verschiedene Axone kann variable Leitungsverzögerungen verursachen, die zu einem desynchronisierten Spiking führen.
Die Demyelinisierung ermöglicht auch, dass entblößte Axone eng aneinander liegen, wodurch die Voraussetzungen für ephaptische Wechselwirkungen und Übersprechen geschaffen werden.[10] Eine Reflexion kann auch aufgrund einer Impedanzfehlanpassung zwischen myelinisierten und nicht myelinisierten Axonlängen auftreten. Andererseits kann Übererregbarkeit nicht direkt der Demyelinisierung zugeschrieben werden; Stattdessen müssen sekundäre Veränderungen der intrinsischen Erregbarkeit herangezogen werden, um Phänomene wie die Erzeugung ektopischer Spitzen und Nachentladung (AD) zu erklären. Veränderungen der Erregbarkeit stellen wahrscheinlich kompensatorische Veränderungen dar, die darauf abzielen, die Funktion nach der direkt durch Demyelinisierung verursachten Störung wiederherzustellen, was mit einem Prozess übereinstimmt, der als homöostatische Plastizität bezeichnet wird,[56] aber diese Kompensation kann offensichtlich maladaptiv sein. Jedes der oben genannten Ergebnisse, die sich nicht gegenseitig ausschließen, trägt dazu bei, unterschiedliche Symptome hervorzurufen, die bei demyelinisierenden Erkrankungen beobachtet werden.
Paroxysmale Symptome, die durch das plötzliche Einsetzen oder Verstärken von Symptomen wie Spasmen oder stechenden Schmerzen gekennzeichnet sind, entstehen wahrscheinlich durch AD oder anderweitig unangemessenes Spiking vom Burst-Typ. Solche Spiking-Muster legen hochgradig nichtlineare Wechselwirkungen zwischen dem beitragenden Ionenstrom nahes[57][58] and could, in theory at least, involve interactions between different regions of the neuron.[59] Im Gegensatz zu allgemeineren Formen der Übererregbarkeit (z. B. erhöhte Feuerrate oder reduzierte Schwelle) sind diese spezifischen Muster in Bezug auf die genauen Mechanismen, durch die sie entstehen können, begrenzt. Daher kann die Identifizierung der Ionenkanalveränderungen, die diesen spezifischen Formen der Übererregbarkeit zugrunde liegen, dazu beitragen, die Suche nach Ionenkanalveränderungen einzuschränken, die für assoziierte, jedoch weniger ausgeprägte Formen der Übererregbarkeit verantwortlich sind.
Die Störung des Energiegleichgewichts in einem Neuron könnte sich auch tiefgreifend auf das Wohlbefinden des Neurons auswirken (Abbildung 3). Tatsächlich können kompensierende Änderungen gewisse Funktionen wiederherstellen, aber ohne das Hauptproblem umzukehren, können andere Probleme auftreten. Selbst wenn zum Beispiel ein Leitungsblock durch eine geeignete kompensierende Änderung der Erregbarkeit verhindert wird (d. h. eine, die nicht zu einer Übererregbarkeit führt), kann das System weniger energieeffizient sein. Der Verlust der Energieeinsparungen durch Saltatorische Leitung induziert eine kompensatorische mitochondriale Energieproduktion, die zu oxidativen Schäden und Neurodegeneration führen kann.[53][60][61]
Es ist keine leichte Aufgabe, diese lange Liste neurobiologischer Veränderungen im Auge zu behalten, die Wechselbeziehungen zwischen diesen Veränderungen zu verstehen und diese Veränderungen letztendlich mit klinischen Manifestationen zu verknüpfen und eine wirksame Behandlung anzuwenden. Zu diesem Zweck ist die computergestützte Modellierung ein unschätzbares Werkzeug. Simulationen dienen nicht nur dazu, bereits bekannte Informationen zu organisieren, sondern identifizieren auch entscheidende Wissenslücken. Die vernünftige Verwendung von Computermodellen kann daher ein umfassenderes Verständnis ermöglichen und die effektivere Anwendung dieses Verständnisses erleichtern, wie unten erörtert.
Computermodellierung
Insbesondere in Verbindung mit traditionellen Experimenten ist die Computermodellierung unverzichtbar, um inkonsistente Daten und komplexe Mechanismen zu verstehen. Diese Vorteile werden durch die Anwendung von Simulationen in anderen Bereichen, wie z. B. Epilepsie, veranschaulicht.[62] Hier geben wir einen Überblick über die Geschichte der computergestützten Modellierung von Axonen, Ionenleitfähigkeiten, der Physiologie von Myelin und Demyelinisierung, des Immunsystems, der Mitochondrien und anderer biologischer Faktoren, die für das Verständnis demyelinisierender Krankheiten entscheidend sind. Unsere Übersicht erhebt keinen Anspruch auf Vollständigkeit, bietet jedoch eine breite Einführung in vergangene, gegenwärtige und zukünftige Bemühungen auf diesem Gebiet.
Modellierung von Axonen
Die computergestützte Modellierung von Axonen hat sich taxonomisch weiterentwickelt, von Tintenfisch- zu Säugetiergeweben mit einer entsprechenden Zunahme an Raffinesse. Das Modell von Hodgkin und Huxley (HH), das die erste gründliche Erklärung der AP-Erzeugung lieferte, wurde aus Experimenten an nicht myelinisierten Riesenaxonen von Tintenfischen abgeleitet,[63][64] aber dieses frühe Modell hat sich als unschätzbares Werkzeug erwiesen, aus dem sich später anspruchsvollere Modelle myelinisierter Axone entwickelt haben.
Die räumliche und biophysikalische Heterogenität, die durch die Zugabe von Myelin verliehen wird, und die daraus resultierende Bildung von Knoten und internodalen Regionen, repräsentiert eine signifikante Erhöhung der Axonkomplexität. Das erste Computermodell eines myelinisierten Axons war ein eindimensionales Modell, das die Myelinscheide in das darunter liegende passive Axolemm kollabierte, eine einheitliche räumliche Schrittweite verwendete, um die diskrete Näherung zu bilden, die in der numerischen Lösung verwendet wurde, und eine HH-Charakterisierung der Knotenmembran verwendete.[65] Goldman & Albus[66] modifizierten dieses Modell, um eine Beschreibung der Knotenmembran aufzunehmen, die aus experimentellen Daten von myelinisierten Xenopus laevis-Nervenfasern abgeleitet wurde, wie von Frankenhaeuser & Huxley bestimmt.[67] Nachfolgende Studien haben die gleiche Grundform für das Modell mit einigen Variationen für die Darstellung des Axolemma verwendet.[15][68][69][70][71][72][73][74][75][76] Das Einzelkabelmodell, das das Axon und alle seine Leitfähigkeits- und Kapazitätseigenschaften in einer Kabelgleichung beschreibt, hat das Feld bis heute dominiert, trotz der Einführung von Doppelkabelmodellen durch Blight.[77] In Doppelkabelmodellen werden das internodale Axolemm und die Myelinscheide unabhängig voneinander dargestellt. Das Doppelseilmodell wurde von Halter und Clark erweitert[78]um die Auswirkungen der komplexen Geometrie von ZNS-Oligodendrozyten (oder Schwann-Zellen im Fall des PNS) zu untersuchen.
Neuere Modelle haben auch frühere Vereinfachungen verbessert, darunter die anatomische Komplexität des Ranvier-Knotens, die Verteilung von Ionenkanälen im Axon unter der Myelinscheide, die unterschiedlichen elektrischen Eigenschaften der Myelinscheide und des Axolemmas und die Anpassung an einen möglichen Stromfluss darin der Periaxonalraum.[78][79][80][81][82] Anatomische Darstellungen des paranodalen Bereichs haben eine detailliertere Beurteilung der Auswirkungen einer traumatischen Hirnverletzung (TBI) auf myelinisierte Axone ermöglicht.[83]Eines der anatomisch ausgefeiltesten Modelle umfasst die Darstellung der komplexen wässrigen Hüllenstruktur von Myelinlamellen als eine Reihe von miteinander verbundenen parallelen Lamellen in einem Modell motorischer Nerven.[30][80]
Neuere Modelle haben auch die ungleichmäßige Verteilung von Ionenkanälen im gesamten Axon berücksichtigt [19,84,85,86,87,88,89,90].[19][84][85][86][87][88][89][90]Neben Ionenkanälen bieten energieabhängige Pumpen und andere Ionentransportmechanismen wichtige therapeutische Ziele für eine Reihe von neurologischen Störungen.[91][92][93] In dieser Hinsicht kostet die Regulierung der Transmembran-Ionengradienten erhebliche Energie und wird selbst zu einer wichtigen Überlegung (siehe unten)..[94] Dies gilt insbesondere, da das kleine Volumen von Axonen sie anfällig für Ionenkonzentrationsänderungen macht, die sich dramatisch auf die Antriebskräfte auswirken können und in Modellen problematisch werden können, die konstante intrazelluläre und extrazelluläre Konzentrationen annehmen. Aber neuere Modelle haben sich auch mit solchen Problemen befasst (siehe unten).
Alle oben genannten Modelle konzentrieren sich auf die Simulation der Änderung des Axonmembranpotentials, aber man hat nicht unbedingt experimentellen Zugang zu dieser Variablen, was natürlich die Bemühungen erschwert, Simulations- und experimentelle Daten zu vergleichen. Da extrazelluläre Aufzeichnungen die primäre Quelle elektrophysiologischer Daten von menschlichen Probanden sind, ist die mathematische Beschreibung des extrazellulären Feldpotentials klinisch von großem Interesse. Zur Berechnung dieser Potentiale werden mathematische Auswertungen auf der Grundlage von Laplace-Gleichungen und Fourier-Transformationen verwendet (manchmal auch als Line-Source-Modellierung bezeichnet, z.,.[82][95]
Modellierung spezifischer Mechanismen
Über die Modellierung der normalen axonalen Funktion hinaus können Modelle verwendet werden, um bestimmte Mechanismen der axonalen Dysfunktion zu untersuchen, insbesondere wenn sie mit experimentellen Ergebnissen kombiniert werden, die die Mechanismen besser lokalisieren könnten.[96]Zum Beispiel, Barrett and Barrett[97] zeigten, dass das depolarisierende Nachpotential (DAP) empfindlich auf Änderungen der Leitfähigkeitsdichten und kapazitiven Änderungen reagiert, die während der Demyelinisierung auftreten können. Ein Modell von Blight wurde zur Simulation seiner experimentellen Aufnahmebedingungen entworfen[77][98]und stellt ein einzelnes Internodium mit mehreren diskreten Segmenten und benachbarten Knoten und Internodien in einzelnen Segmenten mit konzentrierten Parametern dar. Dieses Modell umfasste K+-Kanäle im Axolemma des einzelnen multisegmentierten Internodiums und behandelt den Rest als rein passiv.
Aufbauend auf dieser Arbeit, mit sorgfältiger Beachtung anatomischer und elektrophysiologischer Details,McIntyre et al.[81] befassten sich mit der Rolle des DAP und der Nachhyperpolarisation (AHP) im Erholungszyklus – dem ausgeprägten Muster der Schwellenfluktuation nach einem einzelnen Aktionspotential, das von menschlichen Nerven gezeigt wird. Die Simulationen legten unterschiedliche Rollen für aktive und passive Na+- und K+-Kanäle in beiden Nachpotentialen nahe und schlugen vor, dass Unterschiede in der AP-Form, Stärke-Dauer-Beziehung und dem Erholungszyklus von motorischen und sensorischen Nervenfasern kinetischen Unterschieden in den Knoten-Na+-Leitfähigkeiten zugeschrieben werden können . Richardsonet al.[99] fanden auch heraus, dass eine Änderung des Standardmodells des „perfekten Isolators“ notwendig ist, um DAPs während der Hochfrequenzstimulation zu reproduzieren.
Die Temperaturempfindlichkeit von Demyelinisierungseffekten wurde ebenfalls rechnerisch untersucht. Zlochiver[100] modellierten eine anhaltende Resonanzreflexion über eine einzelne fokale Demyelinisierungsplaque und stellten fest, dass dieser Effekt empfindlich auf Temperatur und Axondurchmesser reagierte. Alle diese Beispiele demonstrierten die Leistungsfähigkeit von Simulationen, um spezifische Mechanismen zu untersuchen, um beobachtete Phänomene aus der Klinik zu erklären und eine Anleitung für zukünftige Forschung zu bieten.
Wie oben erwähnt, manifestieren deutliche Veränderungen in der Axonfunktion wahrscheinlich bestimmte Funktionsgewinn- oder -verlustsymptome. Wenn man diese Änderungen in einem Rechenmodell reproduzieren könnte, könnten die notwendigen Parameteränderungen, die zum Umwandeln des Modells zwischen normalem und abnormalem Betrieb erforderlich sind, verwendet werden, um die zugrunde liegende Pathologie vorherzusagen. Im Idealfall kann dies zu konkreten Experimenten führen, in denen beispielsweise der verdächtige Ionenkanal direkt manipuliert wird, um zu sehen, ob seine akute Veränderung ausreicht, um bestimmte pathologische Veränderungen zu reproduzieren oder rückgängig zu machen. Jüngste Studien aus dem Prescott-Labor veranschaulichen diesen Prozess.[101][102] Dieser Erfolg dieser Studien hing von fortschrittlichen Techniken ab, einschließlich der dynamischen Klemmtechnik, die verwendet wird, um zwischen normalen und abnormalen Spiking-Mustern und optogenetischen Werkzeugen zu wechseln. Der nächste Schritt besteht darin, Veränderungen in der Axonfunktion mit Krankheitssymptomen (oder ihren Verhaltenskorrelaten in Tiermodellen) zu verknüpfen.
In Hörnervenexperimenten Tagoe und Kollegen[103] zeigten, dass Hörverlust im Zusammenhang mit morphologischen Veränderungen an Paranoden und Juxtaparanoden, einschließlich der Verlängerung des Hörnervs um Ranvier-Knoten, aus der Exposition gegenüber lautem Lärm resultieren kann. Hamann und Kollegen erweiterten diese Arbeit und bauten ein Computermodell, um mögliche Mechanismen zu untersuchen. Ihr Modell legte nahe, dass es wahrscheinlicher ist, dass eine Abnahme der Dichte von Na-Kanälen als eine Umverteilung von Na- oder K-Kanälen im Allgemeinen für die mit akustischer Überexposition verbundene Leitungshemmung verantwortlich ist.[104] Dieses Experiment-Modell-Tandem demonstriert das aufschlussreiche Potenzial der Paarung von Computermodellen mit Laborexperimenten.
Mit einem mehrschichtigen Modell mit myelinisiertem Axon konnten Stephanova und Kollegen fortlaufend erfolgreich wahrscheinliche anatomische und physiologische Mängel identifizieren, die verschiedenen Symptomen und Zuständen im Zusammenhang mit der Demyelinisierung zugrunde liegen, indem sie Vergleiche mit den Schwellenverfolgungsmessungen von Patienten anstellten, einschließlich Latenzen, Refraktärität (die Erhöhung der Schwelle Strom während der relativen Refraktärzeit), Refraktärzeit, Supernormalität und Schwellenelektrotonuswerte, einschließlich Stimulus-Reaktions-Maßnahmen wie Strom-Schwellen-Beziehungen.[21]Beispielsweise fanden sie heraus, dass eine leichte internodale systematische Demyelinisierung (ISD) ein spezifischer Indikator für CMT1A ist. Milde paranodale systematische Demyelinisierung (PSD) und paranodale systematische Demyelinisierung (PISD) sind spezifische Indikatoren für CIPD und ihre Subtypen. Schwere fokale Demyelinisierungen, internodal und paranodal, paranodal-internodal (IFD und PFD, PIFD) sind spezifische Indikatoren für erworbene demyelinisierende Neuropathien wie GBS und MMN [18] (siehe Abbildung 1).
Leichte systematische und schwere fokale Demyelinisierung entsprechen erblichen (CMT1A) und erworbenen (CIDP, GBS und MMN) Neuropathien (Tabelle 1). Es wurde auch festgestellt, dass 70 % der systematischen Demyelinisierung nicht ausreichen, um Symptome zu verursachen, und dass 96 % für einen Leitungsblock an einem einzelnen Knoten erforderlich sind [18]. Somit besteht ein großer Sicherheitsfaktor für die fokale Demyelinisierung. Mit ihrer temperaturabhängigen Version des Modells der myelinisierten menschlichen motorischen Nervenfaser, Stephanova und Daskalova[105] zeigten, dass die elektrotonischen Potentiale bei Patienten mit CIDP während Hypo- und sogar leichter Hyperthermie einem hohen Blockierungsrisiko ausgesetzt sind, und deuten auf Mechanismen hin, die eine erhöhte Größe der polarisierenden elektrotonischen Knoten- und depolarisierenden internodalen elektrotonischen Potentiale, einen Anstieg der nach innen gerichteten Gleichrichter-K+- und Leck-K+-Ströme mit der Temperatur umfassen, und die Akkommodation bei lang anhaltender Hyperpolarisation ist größer als bei Depolarisation.
| Table 1
Correspondence between types of demyelination and diseases according to Stephanova and Dimitrov.[18] | |
|---|---|
| Type of Demyelination | Corresponding Disease (PNS) |
| Internodal systematic demyelination (ISD) | Charcot-Marie-Tooth Disease Type 1A (CMT1A) |
| Paranodal systematic demyelination (PSD) | Chronic inflammatory demyelinating polyneuropathy (CIDP) |
| Paranodal + internodal demyelination (PISD) | Chronic inflammatory demyelinating polyneuropathy (CIPD) subtypes |
| Internodal focal demyelination (IFD) | Guillain-Barré (GBS) |
| Paranodal focal demyelination (PFD) | Multifocal Motor Neuropathy (MMN) |
| Paranodal + focal demyelination (PIFD) | Multifocal Motor Neuropathy (MMN) |
Einfache Modelle und nichtlineare dynamische Analyse
Given the temporal dissociation between the manifestation of symptoms and the rates of demyelination and remyelination, homeostatic processes undoubtedly occur within axons, which include the redistribution of ion channels in demyelinated plaques.[106][107]Angesichts der Vielfalt der Ionenkanäle, die von verschiedenen Axonen exprimiert werden, und des nur lückenhaften Wissens darüber, wie sich die Expressionsniveaus ändern, ist der Aufbau detaillierter Modelle zur Untersuchung dieser homöostatischen Prozesse problematisch. Besonders unter diesen Bedingungen können stark vereinfachte Modelle helfen, grundlegende Prinzipien zu identifizieren, wie die gemeinsame Verwendung von modifizierten HH- und Morris-Lecar-Modellen veranschaulicht [57,58]. Die Ergebnisse dieser Studien legten eine einfache Erklärung für die Breite der Symptome nahe, die während der Demyelinisierung auftreten, indem sie aufzeigten, dass das Verhältnis von Na+ zu Leck-K+-Leitfähigkeit, g(Na)/g(L), als ein Vier-Wege-Schalter fungierte, der die Erregungsmuster steuerte umfassten das Versagen der AP-Ausbreitung, die normale AP-Ausbreitung, AD und spontanes Spiking.
Weitere Studien mit diesem Modell legten das Potenzial für Konkurrenz oder Kooperation zwischen verschiedenen Regionen desselben Neurons nahe.[59] Die Kooperation zwischen entfernten Orten ektopischer Spikings ermöglicht es, AD an verschiedenen Orten innerhalb eines einzelnen Axons zu initiieren und aufrechtzuerhalten, wodurch eine überzeugende Erklärung für die zeitlichen und räumlichen Diskontinuitäten von Schmerzen und anderen Symptomen bei MS-Patienten bereitgestellt wird. Bemerkenswerterweise wurden in einer kürzlich durchgeführten Studie über demyelinisierte Axone in einem Cuprizon-Mausmodell experimentelle Beweise für eine Umverteilung von Ionenkanälen aus dem Ranvier-Knoten, eine erhöhte ektopische Erregbarkeit zusammen mit antidrom vermehrten APs aus der demyelinisierten Plaque sowie eine kompensatorische Verschiebung gesehen in der Erregbarkeit von Membranen proximal zum Soma.[108] Alle diese Beobachtungen stimmen mit den Berechnungsmodellvorhersagen von Coggan und Kollegen überein oder stimmen mit diesen überein und implizieren den Erfolg des Berechnungsansatzes zur Führung von Laborstudien.
Darüber hinaus ermöglichten diese vereinfachten Modelle die Anwendung mathematischer Werkzeuge zur Untersuchung der nichtlinearen Mechanismen, durch die AD initiiert und beendet wird.[57][58][59] Bifurkationsanalysen zeigten die zugrunde liegende Bistabilität der Axonerregbarkeit unter pathologischen Bedingungen sowie die Faktoren, die den Übergang von einem Attraktorzustand zu einem anderen steuern. AD erfordert beispielsweise einen langsamen Einwärtsstrom, der zwei stabile Attraktorzustände ermöglicht, von denen einer der Ruhe und der andere dem wiederholten Spiking (einem Grenzzyklus) entspricht. Die Beendigung von AD wurde dadurch erklärt, dass der Attraktor, der mit wiederholtem Spiking verbunden ist, zerstört wird. Dies geschah, als eine ultralangsame negative Rückkopplung in Form einer intrazellulären Na+-Akkumulation die Zerstörung des Grenzzyklus-Attraktorzustands verursachte [58]. Andere Studien, die Bifurkationsanalysen verwenden, legen nahe, dass Änderungen der Ionenkonzentration eine langsame Dynamik einführen können, die für das Verständnis pathologischer Ergebnisse wichtig sein kann [94,109].[94][109]
Modellierung im kleinen Maßstab
Die oben erwähnten Studien heben die Bedeutung von Änderungen der Ionenkonzentration hervor, aber jede von ihnen berücksichtigte diese Änderungen nur in einem relativ groben Maßstab. Die Studie von Lorpreore et al.[110]befassten sich mit dem entmutigenden Problem der Modellierung der dreidimensionalen Elektrodiffusion von Ionenflüssen in Mikro- und Nanodomänen, die Ionenkanäle am Knoten von Ranvier umgeben. In diesem einzigartigen Modell werden die Ionenflüsse durch Poisson-Nernst-Planck-Gleichungen mit Finite-Volumen-Techniken berechnet. Die Flüsse und elektrischen Potentiale wurden innerhalb von Voxeln bewertet, die durch ein Delaunay-Voronoi-Netz des Axons innerhalb und außerhalb der Membran gebildet wurden. Wichtig ist, dass der Algorithmus validiert wurde und die Ergebnisse mit den Vorhersagen des Kabelmodells übereinstimmten. Abweichungen von Kabelmodellvorhersagen bei kleineren Clustergrößen zeigten die Bedeutung des eigenen elektrischen Felds jedes Kanals.
Das obige Beispiel unterstreicht den Punkt, dass Modelle mehr als Ionenkanäle und Membranpotential simulieren können. In der Tat können und müssen Modelle tiefer in biophysikalische Mechanismen wie Elektrodiffusion und in Signalwege eintauchen, die letztendlich dazu dienen, die Funktion und Expression von Ionenkanälen zu regulieren. Eine vielversprechende Methode namens Biochemical Systems Theory (BST) könnte in Zukunft nützlich sein, um die Wirkung von Arzneimitteln auf systemischer Ebene vorab zu überprüfen. Broome und Coleman[111] demonstrierten die Leistungsfähigkeit dieser Technik durch die Modellierung mehrerer biochemischer Wege in Neuronen, die mit dem Zelltod während MS in Verbindung stehen, einschließlich der Bildung reaktiver Sauerstoff- und Stickstoffspezies, der Ca2+-Dynamik, der Bildung von Todeskomplexen, der Freisetzung von apoptotischen Faktoren und Entzündungsreaktionen zusammen mit drei verschiedenen Zuständen: normal, MS Krankheit und Behandlung. Auf atomarer Ebene wurde ein Computermodell der Struktur des Myelin-Basisproteins (MBP) durchgeführt, da posttranslationale Modifikationen von MBP zur Demyelinisierung bei MS beitragen können.[112]Es ist wichtig, seine 3D-Struktur zu verstehen, um Interaktionsstellen mit anderen Molekülen vorherzusagen, aber eine Kristallstruktur für dieses Protein könnte niemals direkt gemessen werden. Diese Art der Modellierung kann daher einen effektiven Weg darstellen, um die Struktur vorherzusagen, indem das Wissen über die Aminosäuresequenz mit Informationen von ähnlichen Proteinen kombiniert wird. Die Herausforderung und die wahre Stärke der Modellierung liegt in der Verbindung von Mechanismen, die auf sehr unterschiedlichen Ebenen ablaufen, von der molekularen Struktur bis zum Nervensystem als Ganzes und darüber hinaus, um zu untersuchen, wie das Nervensystem mit dem Immunsystem interagiert.
Modelle von Immunfaktoren. Zwar gibt es zahlreiche Computermodelle des Immunsystems,[113] diejenigen, die sich auf MS beziehen, modellieren typischerweise genetische Interaktionsnetzwerke, die entweder als Sätze gewöhnlicher Differentialgleichungen (ODEs) oder als Boolesche Netzwerke dargestellt werden. Ein systembiologisches Modell eines möglichen zellulären Mechanismus von RRMS fand einen Zusammenbruch der Homöostase von Effektor (Teff) und regulatorischen T (Treg) Zellen.[114][115] Durch die Änderung von Parametern in der Teff-Treg-Rückkopplungsschleife reproduzierte das Modell unter kontinuierlichem stochastischen externen Stimulus von Antigenen spontane und scheinbar stochastische Immunrückfälle. Der irreversible Schaden aus jeder Episode sammelt sich im Laufe der Zeit an. Zu den neuartigen Vorhersagen gehört der Vorschlag, dass der Zeitpunkt der Treg-Immuntherapie im Immunreaktionszyklus entscheidend dafür ist, ob eine Intervention vorteilhaft oder schädlich ist.
Modelle der mitochondrialen Dysfunktion. Wie oben erwähnt, ermöglicht Myelin eine energieeffizientere AP-Leitung entlang des Axons. Der erhöhte Energiebedarf, der an das demyelinisierte Axon gestellt wird, stellt eine weitere Herausforderung für das betroffene Neuron dar. Über den Verlust der Salzleitung hinaus gibt es zunehmend Hinweise auf eine entscheidende Rolle von Astrozyten und Oligodendrozyten bei der Energieversorgung von Neuronen, und dieser Prozess war auch Gegenstand von Computermodellen.[116]
Es gibt viele Möglichkeiten, wie die mitochondriale Funktion schief gehen kann, und die kompensatorischen Wege sind ebenso kompliziert.[53][60][61]Beispielsweise kann eine mitochondriale Dysfunktion in einer gestörten Ca2+-Signalübertragung innerhalb der Mitochondrien, gestörten Protonengradienten oder Elektronenketten, einem Reduktions-Oxidations-Ungleichgewicht sowie den Folgen einer reduzierten ATP-Verfügbarkeit, lokal und global, verwurzelt sein. Beispielsweise wurden Multiskalenmodelle des Herzens verwendet, um eine veränderte mitochondriale Ca2+-Signalübertragung mit Arrhythmie in Verbindung zu bringen [60]. Unter Verwendung von mitochondrialen Netzwerkmodellen zeigte diese Studie, wie sogar etwas zu viele reaktive Sauerstoffspezies einen zellweiten Zusammenbruch des mitochondrialen Membranpotentials auslösen können. Dies ist ein hervorragendes Beispiel dafür, wie ein Computermodell Prozesse auf verschiedenen Ebenen verknüpfen kann, und genau diese Verknüpfungen müssen im Bereich der Demyelinisierungskrankheiten hergestellt werden.
Fehlende Verbindungen und die Notwendigkeit der Integration
Auf dem Gebiet der demyelinisierenden Erkrankungen haben sich die Modellierungsbemühungen traditionell auf Axonmodelle konzentriert, die darauf abzielen, verschiedene Aspekte der Erregbarkeit zu erklären. Aber wie oben skizziert, haben diese Modelle eine enorme Entwicklung in ihrer Komplexität durchlaufen. Dabei begannen sich Modelle auf verschiedenen biologischen Skalen zu verschmelzen. Beispielsweise haben jetzt Modelle begonnen, sich mit der Regulation von Ionenkonzentrationen und deren Folgen für langsame Erregbarkeitsänderungen, Energieverbrauch und Toxizität zu befassen. Ein computergestützter Ansatz wird notwendig sein, um parallele und multifaktorielle Ätiologien zu integrieren, die mit kognitivem Verfall verbunden sind, wie z. B. Signalübertragung des Immunsystems, Energiestoffwechsel, Wechselwirkungen zwischen grauer und weißer Substanz und genetische Netzwerke [117]..[117] Diese fortgesetzten Bemühungen beginnen, die riesigen und miteinander verbundenen Rückkopplungsschleifen aufzudecken, die über eine breite Palette von räumlichen und zeitlichen Skalen hinweg wirken. Allerdings stecken solche Bemühungen noch in den Kinderschuhen und es bestehen noch große Lücken in der Modellierung demyelinisierender Erkrankungen. Es ist einfacher zu beschreiben, was modelliert wurde, als was nicht. Ein wirklich integriertes Modell mit mehreren Zelltypen, das alle hypothetischen ätiologischen Faktoren anspricht, ist noch nicht realisiert. Zu den unerforschten oder wenig erforschten, aber potenziell nützlichen Zielen für die Modellierung gehören die Pathologie der grauen Substanz, die wässrigen Schichten der Myelinscheide, der Energiestoffwechsel und vielleicht am wichtigsten die Multiskalen- oder integrierte Modellierung. Man sollte erkennen, dass die notwendigen Werkzeuge in anderen Studienbereichen vorhanden sind und daher leicht auf die Untersuchung von Demyelinisierungskrankheiten angewendet werden können.
Schlussfolgerungen
Die normale physiologische Funktion des ZNS oder PNS beruht auf einem stark regulierten Zusammenspiel von Neuronen, Glia, Gefäßsystem und Immunzellen. Dieser Prozess umfasst und integriert zahlreiche Zell- und Signalkomponenten, die ein dynamisches, rechnerisches Ganzes erzeugen. Wenn ein Teil schief geht, muss das gesamte System kompensieren. Selbst wenn es der Kompensation gelingt, die offensichtlichsten Folgen der Demyelinisierung zu retten, kehren bestimmte Prozesse möglicherweise nicht in einen völlig normalen Zustand zurück, was über längere Zeiträume zu Problemen führen kann. Die daraus resultierenden Symptome sind eine verwirrende Mischung aus direkten und kompensatorischen Veränderungen, die sich kontinuierlich weiterentwickeln. Die Gesamtkomplexität hat sich als unlösbar für eine effiziente experimentelle Dissektion erwiesen. Die Anwendung computergestützter Modellierungstechniken stellt einen unschätzbaren Ansatz dar, um aus der Sackgasse herauszukommen und eine neue Ära des Verständnisses und der Entdeckung einzuleiten.
Danksagungen
Unterstützung durch den Canadian Institutes of Health Research New Investigator Award und den Ontario Early Researcher Award (SAP). Wir danken Heiki Blum für die Unterstützung bei der Figurenvorbereitung.
Autorenbeiträge
Alle Autoren haben zum Verfassen dieses Manuskripts beigetragen. Zahlen wurden von Sven G. Meuth zur Verfügung gestellt.
Interessenskonflikte
Die Autoren geben keinen Interessenkonflikt an.
Artikelinformationen
Int J Mol Sci. 2015 Sep; 16(9): 21215–21236. Published online 2015 Sep 7. doi: 10.3390/ijms160921215 PMCID: PMC4613250 PMID: 26370960 Jay S. Coggan,1,* Stefan Bittner,2 Klaus M. Stiefel,1 Sven G. Meuth,2 and Steven A. Prescott3,4 Christoph Kleinschnitz, Academic Editor 1NeuroLinx Research Institute, La Jolla, CA 92039, USA; E-Mail: gro.xniloruen@sualk 2Department of Neurology, Institute of Physiology, Universitätsklinikum Münster, 48149 Münster, Germany; E-Mails: moc.kooltuo@renttib-nafets (S.B.); ed.retsneumku@htuem.nevs (S.G.M.) 3Neurosciences and Mental Health, the Hospital for Sick Children, Toronto, ON M5G 1X8, Canada; E-Mail: ac.sdikkcis@ttocserp.evets 4Department of Physiology and the Institute of Biomaterials and Biomedical Engineering, University of Toronto, Toronto, ON M5G 1X8, Canada
- Autor, an den die Korrespondenz gerichtet werden soll; E-Mail: gro.xniloruen@yaj; Tel.: +1-858-243-6720.
Received 2015 May 26; Accepted 2015 Aug 25. Copyright © 2015 by the authors; licensee MDPI, Basel, Switzerland. Dieser Artikel ist ein Open-Access-Artikel, der unter den Bedingungen der Creative Commons Attribution-Lizenz verbreitet wird (http://creativecommons.org/licenses/by/4.0/). Artikel aus dem International Journal of Molecular Sciences werden hier mit freundlicher Genehmigung des Multidisciplinary Digital Publishing Institute (MDPI) bereitgestellt.
Bibliography
- ↑ Virchow R. Uber das ausgebreitete Vorkommen einer dem Nervenmark analogen Substanz in den tierischen Geweben. Virchows Arch. Pathol. Anat. 1854;6:562–572. doi: 10.1007/BF02116709. [CrossRef] [Google Scholar]
- ↑ Stiefel K.M., Torben-Nielsen B., Coggan J.S. Proposed evolutionary changes in the role of myelin. Front. Neurosci. 2013;8 doi: 10.3389/fnins.2013.00202.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Bullock T.H., Moore J.K., Fields R.D. Evolution of myelin sheaths: Both lamprey and hagfish lack myelin. Neurosci. Lett. 1984;48:145–148. doi: 10.1016/0304-3940(84)90010-7. [PubMed] [CrossRef] [Google Scholar]
- ↑ Davis A.D., Weatherby T.M., Hartline D.K., Lenz P.H. Myelin-like sheaths in copepod axons. Nature. 1999;398:571–571. doi: 10.1038/19212. [PubMed] [CrossRef] [Google Scholar]
- ↑ Hartline D.K., Colman D.R. Rapid conduction and the evolution of giant axons and myelinated fibers. Curr. Biol. 2007;17:R29–R35. doi: 10.1016/j.cub.2006.11.042. [PubMed] [CrossRef] [Google Scholar]
- ↑ Arancibia-Carcamo I.L., Attwell D. The node of ranvier in CNS pathology. Acta Neuropathol. 2014;128:161–175. doi: 10.1007/s00401-014-1305-z.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Faisal A.A., White J.A., Laughlin S.B. Ion-channel noise places limits on the miniaturization of the brain’s wiring. Curr. Biol. 2005;15:1143–1149. doi: 10.1016/j.cub.2005.05.056. [PubMed] [CrossRef] [Google Scholar]
- ↑ Babbs C.F., Riyi S. Subtle paranodal injury slows impulse conduction in a mathematical model of myelinated axons. PLoS ONE. 2013;8:e67767. doi: 10.1371/journal.pone.0067767. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ 9.0 9.1 9.2 Trapp B.D., Nave K.A. Multiple sclerosis: An immune or neurodegenerative disorder? Annu. Rev. Neurosci. 2008;31:247–69. doi: 10.1146/annurev.neuro.30.051606.094313. [PubMed] [CrossRef] [Google Scholar]
- ↑ 10.0 10.1 10.2 10.3 Compston A., Coles A. Multiple sclerosis. Lancet. 2008;372:1502–1517. doi: 10.1016/S0140-6736(08)61620-7. [PubMed] [CrossRef] [Google Scholar]
- ↑ Ostermann P.O., Westerberg C.E. Paroxysmal attacks in multiple sclerosis. Brain. 1975;98:189–202. doi: 10.1093/brain/98.2.189. [PubMed] [CrossRef] [Google Scholar]
- ↑ Twomey J.A., Espir M.L. Paroxysmal symptoms as the first manifestations of multiple sclerosis. J. Neurol. Neurosurg. Psychiatry. 1980;43:296–304. doi: 10.1136/jnnp.43.4.296. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Seewann A., Vrenken H., van der Valk P., Blezer E.L., Knol D.L., Castelijns J.A., Polman C.H., Pouwels P.J., Barkhof F., Geurts J.J. Diffusely abnormal white matter in chronic multiple sclerosis: Imaging and histopathologic analysis. Arch. Neurol. 2009;66:601–609. doi: 10.1001/archneurol.2009.57. [PubMed] [CrossRef] [Google Scholar]
- ↑ Ceccarelli A., Bakshi R., Neema M. MRI in multiple sclerosis: A review of the current literature. Curr. Opin. Neurol. 2012;25:402–409. doi: 10.1097/WCO.0b013e328354f63f. [PubMed] [CrossRef] [Google Scholar]
- ↑ 15.0 15.1 Moore J.W., Joyner R.W., Brill M.H., Waxman S.D., Najar-Joa M. Simulations of conduction in uniform myelinated fibers. Relative sensitivity to changes in nodal and internodal parameters. Biophys. J. 1978;21:147–160. doi: 10.1016/S0006-3495(78)85515-5. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Waxman S.G., Kocsis J.D., Stys P.K. The Axon: Structure, Function and Pathophysiology. Oxford University Press; New York, NY, USA: 1995. [Google Scholar]
- ↑ Polman C.H., Reingold S.C., Banwell B., Clanet M., Cohen J.A., Filippi M., Fujihara K., Havrdova E., Hutchinson M., Kappos L., et al. Diagnostic criteria for multiple sclerosis: 2010 revisions to the McDonald criteria. Ann. Neurol. 2011;69:292–302. doi: 10.1002/ana.22366. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ 18.0 18.1 Stephanova D.I., Dimitrov B. Computational Neuroscience: Simulated Demyelinating Neuropathies and Neuronopathies. CRC Press; Boca Raton, FL, USA: 2013. [Google Scholar]
- ↑ 19.0 19.1 Bostock H., Baker M., Reid G. Changes in excitability of human motor axons underlying post-ischaemic fasciculations: Evidence for two stable states. J. Physiol. 1991;441:537–557. doi: 10.1113/jphysiol.1991.sp018766.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Mogyoros I., Kiernan M.C., Burke D., Bostock H. Strength-duration properties of sensory and motor axons in amyotrophic lateral sclerosis. Brain. 1998;121:851–859. doi: 10.1093/brain/121.5.851. [PubMed] [CrossRef] [Google Scholar]
- ↑ 21.0 21.1 Kiernan M.C., Burke D., Andersen K.V., Bostock H. Multiple measures of axonal excitability: A new approach in clinical testing. Muscle Nerve. 2000;23:399–409. doi: 10.1002/(SICI)1097-4598(200003)23:3<399::AID-MUS12>3.0.CO;2-G. [PubMed] [CrossRef] [Google Scholar]
- ↑ Cappelen-Smith C., Kuwabara S., Lin C.S., Mogyoros I., Burke D. Membrane properties in chronic inflammatory demyelinating polyneuropathy. Brain. 2001;124:2439–2447. doi: 10.1093/brain/124.12.2439. [PubMed] [CrossRef] [Google Scholar]
- ↑ Kuwabara S., Ogawara K., Sung J.Y., Mori M., Kanai K., Hattori T., Yuki N., MLin C.S., Burke D., Bostock H. Differences in membrane properties of axonal and demyelinating Guillain-Barré syndromes. Ann. Neurol. 2002;52:180–187. doi: 10.1002/ana.10275. [PubMed] [CrossRef] [Google Scholar]
- ↑ Nodera H., Bostock H., Kuwabara S., Sakamoto T., Asanuma K., Jia-Ying S., Ogawara K., Hattori N., Hirayama M., Sobue G., et al. Nerve excitability properties in Charcot-Marie-Tooth disease type 1A. Brain. 2004;127:203–211. doi: 10.1093/brain/awh020. [PubMed] [CrossRef] [Google Scholar]
- ↑ Sung M.H., Simon R. In silico simulation of inhibitor drug effects on nuclear factor-κB pathway dynamics. Mol. Pharmacol. 2004;66:70–75. doi: 10.1124/mol.66.1.70. [PubMed] [CrossRef] [Google Scholar]
- ↑ Stephanova D.I., Daskalova M. Differences in potentials and excitability properties in simulated cases of demyelinating neuropathies. Part III. Paranodal internodal demyelination. Clin. Neurophysiol. 2005;116:2334–2341. doi: 10.1016/j.clinph.2005.07.013. [PubMed] [CrossRef] [Google Scholar]
- ↑ Stephanova D.I., Daskalova M.S. Differences between the channels, currents and mechanisms of conduction slowing/block and accommodative processes in simulated cases of focal demyelinating neuropathies. Eur. Biophys. J. 2008;37:829–842. doi: 10.1007/s00249-008-0284-1. [PubMed] [CrossRef] [Google Scholar]
- ↑ Stephanova D.I., Alexandrov A.S. Simulating mild systematic and focal demyelinating neuropathies: Membrane property abnormalities. J. Integr. Neurosci. 2006;5:595–623. doi: 10.1142/S0219635206001331. [PubMed] [CrossRef] [Google Scholar]
- ↑ Stephanova D.I., Daskalova M., Alexandrov A.S. Channels, currents and mechanisms of accommodative processes in simulated cases of systematic demyelinating neuropathies. Brain Res. 2007;1171:138–151. doi: 10.1016/j.brainres.2007.07.029. [PubMed] [CrossRef] [Google Scholar]
- ↑ 30.0 30.1 Stephanova D.I., Krustev S.M., Negrev N., Daskalova M. The myelin sheath aqueous layers improve the membrane properties of simulated chronic demyelinating neuropathies. J. Integr. Neurosci. 2011;10:105–120. doi: 10.1142/S0219635211002646. [PubMed] [CrossRef] [Google Scholar]
- ↑ Stephanova D.I., Alexandrov A.S., Kossev A., Christova L. Simulating focal demyelinating neuropathies: Membrane property abnormalities. Biol. Cybern. 2007;96:195–208. doi: 10.1007/s00422-006-0113-5. [PubMed] [CrossRef] [Google Scholar]
- ↑ Bø L., Geurts J.J., Mörk S.J., van der Valk P. Grey matter pathology in multiple sclerosis. Acta Neurol. Scand. Suppl. 2006;183:48–50. doi: 10.1111/j.1600-0404.2006.00615.x. [PubMed] [CrossRef] [Google Scholar]
- ↑ Geurts J.J., Barkhof F. Grey matter pathology in multiple sclerosis. Lancet Neurol. 2008;7:841–851. doi: 10.1016/S1474-4422(08)70191-1. [PubMed] [CrossRef] [Google Scholar]
- ↑ Zivadinov R., Pirko I. Advances in understanding gray matter pathology in multiple sclerosis: Are we ready to redefine disease pathogenesis? BMC Neurol. 2012;12 doi: 10.1186/1471-2377-12-9. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Popescu B.F., Lucchinetti C.F. Pathology of demyelinating diseases. Annu. Rev. Pathol. 2012;7:185–217. doi: 10.1146/annurev-pathol-011811-132443.[PubMed] [CrossRef] [Google Scholar]
- ↑ Kurtzke J.F., Beebe G.W., Nagler B., Nefzger M.D., Auth T.L., Kurland L.T. Studies on the natural history of multiple sclerosis: V. Long-term survival in young men. Arch. Neurol. 1970;22:215–225. doi: 10.1001/archneur.1970.00480210025003. [PubMed] [CrossRef] [Google Scholar]
- ↑ Rao S.M., Leo G.J., Bernardin L., Unverzagt F. Cognitive dysfunction in multiple sclerosis. I. Frequency, patterns, and prediction. Neurology. 1991;41:685–691. doi: 10.1212/WNL.41.5.685. [PubMed] [CrossRef] [Google Scholar]
- ↑ Meuth S.G., Bittner S., Ulzheimer J.C., Kleinschnitz C., Kieseier B.C., Wiendl H. Therapeutic approaches to multiple sclerosis: An update on failed, interrupted, or inconclusive trials of neuroprotective and alternative treatment strategies. BioDrugs. 2010;24:317–330. doi: 10.2165/11537190-000000000-00000. [PubMed] [CrossRef] [Google Scholar]
- ↑ Goldenberg M.M. Multiple sclerosis review. Pharm. Ther. 2012;37:137–139.[PMC free article] [PubMed] [Google Scholar]
- ↑ Göbel K., Wedell J.H., Herrmann A.M., Wachsmuth L., Pankratz S., Bittner S., Budde T., Kleinschnitz C., Faber C., Wiendl H., et al. 4-Aminopyridine ameliorates mobility but not disease course in an animal model of multiple sclerosis. Exp. Neurol. 2013;248:62–71. doi: 10.1016/j.expneurol.2013.05.016.[PubMed] [CrossRef] [Google Scholar]
- ↑ Krishnan A.V., Kiernan M.C. Sustained-release fampridine and the role of ion channel dysfunction in multiple sclerosis. Mult. Scler. 2013;19:385–391. doi: 10.1177/1352458512463769. [PubMed] [CrossRef] [Google Scholar]
- ↑ Bowe C.M., Kocsis J.D., Targ E.F., Waxman S.G. Physiological effects of 4-aminopyridine on demyelinated mammalian motor and sensory fibers. Ann. Neurol. 1987;22:264–268. doi: 10.1002/ana.410220212. [PubMed] [CrossRef] [Google Scholar]
- ↑ Sakurai M., Kanazawa I. Positive symptoms in multiple sclerosis: Their treatment with sodium channel blockers, lidocaine and mexiletine. J. Neurol. Sci. 1999;162:162–168. doi: 10.1016/S0022-510X(98)00322-0. [PubMed]
- ↑ Mattson M.P., Guthrie P.B., Kater S.B. A role for Na+-dependent Ca2+extrusion in protection against neuronal excitotoxicity. FASEB J. 1989;3:2519–2526. [PubMed] [Google Scholar]
- ↑ Moll N.M., Rietsch A.M., Thomas S., Ransohoff A.J., Lee J.C., Fox R., Chang A., Ransohoff R.M., Fisher E. Multiple sclerosis normal-appearing white matter: Pathology-imagig correlations. Ann. Neurol. 2011;70:764–773. doi: 10.1002/ana.22521. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ 46.0 46.1 Lucchinetti C., Brück W., Parisi J., Scheithauer B., Rodriguez M., Lassmann H. Heterogeneity of multiple sclerosis lesions: Implications for the pathogenesis of demyelination. Ann. Neurol. 2000;47:707–717. doi: 10.1002/1531-8249(200006)47:6<707::AID-ANA3>3.0.CO;2-Q. [PubMed] [CrossRef] [Google Scholar]
- ↑ Kassmann C.M., Nave K.A. Oligodendroglial impact on axonal function and survival— A hypothesis. Curr. Opin. Neurol. 2008;21:235–241. doi: 10.1097/WCO.0b013e328300c71f. [PubMed] [CrossRef] [Google Scholar]
- ↑ Scolding N., Franklin R. Axon loss in multiple sclerosis. Lancet. 1998;352:340–341. doi: 10.1016/S0140-6736(05)60463-1. [PubMed] [CrossRef] [Google Scholar]
- ↑ Mi S., Miller R.H., Lee X., Scott M.L., Shulag-Morskaya S., Shao Z., Chang J., Thill G., Levesque M., Zhang M., et al. LINGO-1 negatively regulates myelination by oligodendrocytes. Nat. Neurosci. 2005;8:745–751. doi: 10.1038/nn1460. [PubMed] [CrossRef] [Google Scholar]
- ↑ Bittner S., Ruck T., Schuhmann M.K., Herrmann A.M., Maati H.M., Bobak N., Göbel K., Langhauser F., Stegner D., Ehling P., et al. 2013 Endothelial TWIK-related potassium channel-1 (TREK1) regulates immune-cell trafficking into the CNS. Nat. Med. 2013;19:1161–1165. doi: 10.1038/nm.3303. [PubMed]
- ↑ Viglietta V., Baecher-Allan C., Weiner H.L., Hafler D.A. Loss of functional suppression by CD4+CD25+ regulatory T cells in patients with multiple sclerosis. J. Exp. Med. 2004;199:971–999. doi: 10.1084/jem.20031579.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Zajicek J.P., Wing M., Scolding N.J., Compston D.A. Interactions between oligodendrocytes and microglia. A major role for complement and tumour necrosis factor in oligodendrocyte adherence and killing. Brain. 1992;115:1611–1631. [PubMed] [Google Scholar]
- ↑ 53.0 53.1 53.2 Nikić I., Merkler D., Sorbara C., Brinkoetter M., Kreutzfeldt M., Bareyre F.M., Brück W., Bishop D., Misgeld T., Kerschensteiner M. A reversible form of axon damage in experimental autoimmune encephalomyelitis and multiple sclerosis. Nat. Med. 2011;17:495–499. doi: 10.1038/nm.2324. [PubMed] [CrossRef] [Google Scholar]
- ↑ Barnett M.H., Prineas J.W. Relapsing and remitting multiple sclerosis: Pathology of the newly forming lesion. Ann. Neurol. 2004;55:458–468. doi: 10.1002/ana.20016. [PubMed] [CrossRef] [Google Scholar]
- ↑ Van der Laan L.J., Ruuls S.R., Weber K.S., Lodder I.J., Döpp E.A., Dijkstra C.D. Macrophage phagocytosis of myelin in vitro determined by flow cytometry: Phagocytosis is mediated by CR3 and induces production of tumor necrosis factor-α and nitric oxide. J. Neuroimmunol. 1996;70:145–152. doi: 10.1016/S0165-5728(96)00110-5. [PubMed] [CrossRef] [Google Scholar]
- ↑ Wang G., Thompson S.M. Maladaptive homeostatic plasticity in a rodent model of central pain syndrome: Thalamic hyperexcitability after spinothalamic tract lesions. J. Neurosci. 2008;28:11959–11969. doi: 10.1523/JNEUROSCI.3296-08.2008. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ 57.0 57.1 Coggan J.S., Prescott S.A., Bartol T.M., Sejnowski T.J. Imbalance of ionic conductances contributes to diverse symptoms of demyelination. Proc. Natl. Acad. Sci. USA. 2010;107:20602–20609. doi: 10.1073/pnas.1013798107.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ 58.0 58.1 Coggan J.S., Ocker G.K., Sejnowski T.J., Prescott S.A. Explaining pathological changes in axonal excitability through dynamical analysis of conductance-based models. J. Neural Eng. 2011;8 doi: 10.1088/1741-2560/8/6/065002. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ 59.0 59.1 59.2 Coggan J.S., Prescott S.A., Sejnowski T.J. Cooperativity between remote sites of ectopic spiking allows afterdischarge to be initiated and maintained at different locations. J. Comput. Neurosci. 2015;39:17–28. doi: 10.1007/s10827-015-0562-8. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ 60.0 60.1 Aon M.A., Cortassa S., Akar F.G., Brown D.A., Zhou L., O’Rourke B. From mitochondrial dynamics to arrhythmias. Int. J. Biochem. Cell Biol. 2009;41:1940–1948. doi: 10.1016/j.biocel.2009.02.016. [PMC free article][PubMed] [CrossRef] [Google Scholar]
- ↑ 61.0 61.1 Su K., Bourdette D., Forte M. Mitochondrial dysfunction and neurodegeneration in multiple sclerosis. Front. Physiol. 2013;4doi: 10.3389/fphys.2013.00169. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Soltesz I., Staley K. Computational Neuroscience in Epilepsy. 1st ed. Elsevier; London, UK: 2008. [Google Scholar]
- ↑ Hodgkin A.L., Huxley A.F. The components of membrane conductance in the giant axon of Loligo. J. Physiol. 1952;116:473–496. doi: 10.1113/jphysiol.1952.sp004718. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Hodgkin A.L., Huxley A.F. Currents carried by sodium and potassium ions through the membrane of the giant axon of Loligo. J. Physiol. 1952;116:449–472. doi: 10.1113/jphysiol.1952.sp004717. [PMC free article] [PubMed]
- ↑ Fitzhugh R. Computation of impulse initiation and saltatory conduction in a myelinated nerve fiber. Biophys. J. 1962;2:11–21. doi: 10.1016/S0006-3495(62)86837-4. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Goldman L., Albus J.S. Computation of impulse conduction in myelinated fibers; theoretical basis of the velocity-diameter relation. Biophys. J. 1968;8:596–607. doi: 10.1016/S0006-3495(68)86510-5. [PMC free article][PubMed] [CrossRef] [Google Scholar]
- ↑ Frankenhaeuser B., Huxley A.F. The action potential in the myelinated nerve fiber of Xenopus laevis as computed on the basis of voltage clamp data. J. Physiol. 1964;171:302–315. doi: 10.1113/jphysiol.1964.sp007378.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Smith R.S., Koles Z.J. Myelinated nerve fibers: Computed effect of myelin thickness on conduction velocity. Am. J. Physiol. 1970;219:1256–1258.[PubMed] [Google Scholar]
- ↑ Hutchinson N.A., Koles Z.J., Smith R.S. Conduction velocity in myelinated nerve fibres of Xenopus laevis. J. Physiol. 1970;208:279–289. doi: 10.1113/jphysiol.1970.sp009119. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Koles Z.J., Rasminsky M. A computer simulation of conduction in demyelinated nerve fibres. J. Physiol. 1972;227:351–364. doi: 10.1113/jphysiol.1972.sp010036. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Hardy W.L. Propagation speed in myelinated nerve. II. Theoretical dependence on external Na and on temperature. Biophys. J. 1973;13:1071–1089. doi: 10.1016/S0006-3495(73)86046-1. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Schauf C.L., Davis F.A. Impulse conduction in multiple sclerosis: A theoretical basis for modification by temperature and pharmacological agents. J. Neurol. Neurosurg. Psychiatry. 1974;37:152–161. doi: 10.1136/jnnp.37.2.152.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Brill M.H., Waxman S.G., Moore J.W., Joyner R.W. Conduction velocity and spike configuration in myelinated fibres: Computed dependence on internode distance. J. Neurol. Neurosurg. Psychiatry. 1977;40:769–774. doi: 10.1136/jnnp.40.8.769. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Waxman S.G., Brill M.H. Conduction through demyelinated plaques in multiple sclerosis: Computer simulations of facilitation by short internodes. J. Neurol. Neurosurg. Psychiatry. 1978;41:408–416. doi: 10.1136/jnnp.41.5.408.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Wood S.L., Waxman S.G., Kocsis J.D. Conduction of trans of impulses in uniform myelinated fibers: Computed dependence on stimulus frequency. Neuroscience. 1982;7:423–430. doi: 10.1016/0306-4522(82)90276-7. [PubMed] [CrossRef] [Google Scholar]
- ↑ Goldfinger M.D. Computation of high safety factor impulse propagation at axonal branch points. Neuroreport. 2000;11:449–456. doi: 10.1097/00001756-200002280-00005. [PubMed] [CrossRef] [Google Scholar]
- ↑ 77.0 77.1 Blight A.R. Computer simulation of action potentials and afterpotentials in mammalian myelinated axons: The case for a lower resistance myelin sheath. Neuroscience. 1985;15:13–31. doi: 10.1016/0306-4522(85)90119-8. [PubMed] [CrossRef] [Google Scholar]
- ↑ 78.0 78.1 Halter J.A., Clark J.W., Jr. A distributed-parameter model of the myelinated nerve fiber. J. Theor. Biol. 1991;148:345–382. doi: 10.1016/S0022-5193(05)80242-5. [PubMed] [CrossRef] [Google Scholar]
- ↑ Schwarz J.R., Eikhof G. Na currents and action potentials in rat myelinated nerve fibres at 20 and 37 °C. Pflugers Arch. 1987;409:569–577. doi: 10.1007/BF00584655. [PubMed] [CrossRef] [Google Scholar]
- ↑ 80.0 80.1 Stephanova D.I. Myelin as longitudinal conductor: A multi-layered model of the myelinated human motor nerve fibre. Biol. Cybern. 2001;84:301–308. doi: 10.1007/s004220000213. [PubMed] [CrossRef] [Google Scholar]
- ↑ 81.0 81.1 McIntyre C.C., Richardson A.G., Grill W.M. Modeling the excitability of mammalian nerve fibers: Influence of afterpotentials on the recovery cycle. J. Neurophysiol. 2002;87:995–1006. [PubMed] [Google Scholar]
- ↑ 82.0 82.1 Einziger P.D., Livshitz L.M., Mizrahi J. Generalized cable equation model for myelinated nerve fiber. IEEE Trans. Biomed. Eng. 2005;52:1632–1642. doi: 10.1109/TBME.2005.856031. [PubMed] [CrossRef] [Google Scholar]
- ↑ Volman V., Ng L. Primary paranode demyelination modulates slowly developing axonal depolarization in a model of axonal injury. J. Neural Comput. 2014;37:439–457. [PubMed] [Google Scholar]
- ↑ Stephanova D.I., Bostock H. A Distributed-parameter model of the myelinated human motor nerve fibre: Temporal and spatial distributions of action potentials and ionic currents. Biol. Cybern. 1995;73:275–280. doi: 10.1007/BF00201429. [PubMed] [CrossRef] [Google Scholar]
- ↑ Chiu S.Y., Ritchie J.M. On the physiological role of internodal potassium channels and the security of conduction in myelinated nerve fibres. Proc. R. Soc. Lond. B Biol. Sci. 1984;220:415–422. doi: 10.1098/rspb.1984.0010.[PubMed] [CrossRef] [Google Scholar]
- ↑ Brismar T., Schwarz J.R. Potassium permeability in rat myelinated nerve fibres. Acta Physiol. Scand. 1985;124:141–148. doi: 10.1111/j.1748-1716.1985.tb07645.x. [PubMed] [CrossRef] [Google Scholar]
- ↑ Chiu S.Y., Schwarz W. Sodium and potassium currents in acutely demyelinated internodes of rabbit sciatic nerves. J. Physiol. 1987;391:631–649. doi: 10.1113/jphysiol.1987.sp016760. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Baker M., Bostock H., Grafe P., Martius P. Function and distribution of three types of rectifying channel in rat spinal root myelinated axons. J. Physiol. 1987;383:45–67. [PMC free article] [PubMed] [Google Scholar
- ↑ Röper J., Schwarz J.R. Heterogeneous distribution of fast and slow potassium channels in myelinated rat nerve fibres. J. Physiol. 1989;416:93–110. doi: 10.1113/jphysiol.1989.sp017751. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Bittner S., Meuth S.G. Targeting ion channels for the treatment of autoimmune neuroinflammation. Ther. Adv. Neurol. Disord. 2013;6:322–336. doi: 10.1177/1756285613487782. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Waxman S.G., Ritchie J.M. Molecular dissection of the myelinated axon. Ann. Neurol. 1993;33:121–136. doi: 10.1002/ana.410330202. [PubMed] [CrossRef] [Google Scholar]
- ↑ Bittner S., Budde T., Wiendl H., Meuth S.G. From the background to the spotlight: TASK channels in pathological conditions. Brain Pathol. 2010;20:999–1009. doi: 10.1111/j.1750-3639.2010.00407.x. [PMC free article][PubMed] [CrossRef] [Google Scholar]
- ↑ Ehling P., Bittner S., Budde T., Wiendl H., Meuth S.G. Ion channels in autoimmune neurodegeneration. FEBS Lett. 2011;585:3836–3842. doi: 10.1016/j.febslet.2011.03.065. [PubMed] [CrossRef] [Google Scholar]
- ↑ 94.0 94.1 Hübel N., Dahlem M.A. Dynamics from seconds to hours in Hodgkin-Huxley model with time-dependent ion concentrations and buffer reservoirs. PLoS Comput. Biol. 2014;10:e1003941. doi: 10.1371/journal.pcbi.1003941.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Ganapathy L., Clark J.W. Extracellular currents and potentials of the active myelinated nerve fibre. Biophys. J. 1987;52:749–761. doi: 10.1016/S0006-3495(87)83269-1. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Prescott S.A. Pathological changes in peripheral nerve excitability. In: Jaeger D., Jung R., editors. Encyclopedia of Computational Neurosci. 1st ed. Springer-Verlag; New York, NY, USA: 2015. [Google Scholar]
- ↑ Barrett E.F., Barrett J.N. Intracellular recording from vertebrate myelinated axons: Mechanism of the depolarizing afterpotential. J. Physiol. 1982;323:117–144. doi: 10.1113/jphysiol.1982.sp014064. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Blight A.R., Someya S. Depolarizing afterpotentials in myelinated axons of mammalian spinal cord. Neuroscience. 1985;15:1–12. doi: 10.1016/0306-4522(85)90118-6. [PubMed] [CrossRef] [Google Scholar]
- ↑ Richardson A.G., McIntyre C.C., Grill W.M. Modelling the effects of electric fields on nerve fibres: Influence of the myelin sheath. Med. Biol. Eng. Comput. 2000;38:438–446. doi: 10.1007/BF02345014. [PubMed] [CrossRef] [Google Scholar]
- ↑ Zlochiver S. Persistent reflection underlies ectopic activity in multiple sclerosis: A numerical study. Biol. Cybern. 2010;102:181–196. doi: 10.1007/s00422-009-0361-2. [PubMed] [CrossRef] [Google Scholar]
- ↑ Ratté S., Zhu Y., Lee K.Y., Prescott S.A. Criticality and degeneracy in injury-induced changes in primary afferent excitability and the implications for neuropathic pain. Elife. 2014;3:e02370. doi: 10.7554/eLife.02370.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Zhu Y., Feng B., Schwartz E.S., Gebhart G.F., Prescott S.A. Novel method to assess axonal excitability using channelrhodopsin-based photoactivation. J. Neurophysiol. 2015;113:2242–2249. doi: 10.1152/jn.00982.2014.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Tagoe T., Barker M., Jones A., Allcock N., Hamann M. Auditory nerve perinodal dysmyelination in noise-induced hearing loss. J. Neurosci. 2014;12:2684–2688. doi: 10.1523/JNEUROSCI.3977-13.2014.
- ↑ Brown A.M., Hamann M. Computational modeling of the effects of auditory nerve dysmyelination. Front. Neuroanat. 2014;8doi: 10.3389/fnana.2014.00073. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Stephanova D.I., Daskalova M. Electrotonic potentials in simulated chronic inflammatory demyelinating polyneuropathy at 20 °C–42 °C. J. Integr. Neurosci. 2015;27:1–18. doi: 10.1142/S0219635215500119. [PubMed] [CrossRef] [Google Scholar]
- ↑ Rasminsky M. Hyperexcitability of pathologically myelinated axons and positive symptoms in multiple sclerosis. Adv. Neurol. 1981;31:289–297.[PubMed] [Google Scholar]
- ↑ Ulrich J., Groebke-Lorenz W. The optic nerve in multiple sclerosis: A morphological study with retrospective clinicopathological correlation. Neuro-Ophthalmology. 1983;3:149–159. doi: 10.3109/01658108309009732.[CrossRef] [Google Scholar]
- ↑ Hamada M.S., Kole M.H. Myelin loss and axonal ion channel adaptations associated with gray matter neuronal hyperexcitability. J. Neurosci. 2015;35:7272–7786. [PMC free article] [PubMed] [Google Scholar]
- ↑ Yu N., Morris C.E., Joós B., Longtin A. Spontaneous excitation patterns computed for axons with injury-like impairments of sodium channels and Na/K pumps. PLoS Comput. Biol. 2012;8:e1002664. doi: 10.1371/journal.pcbi.1002664. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Lopreore C.L., Bartol T.M., Coggan J.S., Keller D.X., Sosinsky G.E., Ellisman M.H., Sejnowski T.J. Computational modeling of three-dimensional electrodiffusion in biological systems: Application to the node of Ranvier. Biophys. J. 2008;95:2624–2635. doi: 10.1529/biophysj.108.132167.
- ↑ Broome T.M., Cole.man R.A. A mathematical model of cell death in multiple sclerosis. J. Neurosci. Methods. 2011;201:420–425. doi: 10.1016/j.jneumeth.2011.08.008. [PubMed] [CrossRef] [Google Scholar]
- ↑ Ridsdale R.A., Beniac D.R., Tompkins T.A., Moscarello M.A., Harauz G. Three-dimensional structure of myelin basic protein. II. Molecular modeling and considerations of predicted structures in multiple sclerosis. J. Biol. Chem. 1997;272:4269–4275. doi: 10.1074/jbc.272.7.4269. [PubMed] [CrossRef] [Google Scholar]
- ↑ Pigozzo A.B., Macedo G.C., Santos R.W., Lobosco M. On the computational modeling of the innate immune system. BMC Bioinform. 2013;14 doi: 10.1186/1471-2105-14-S6-S7. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Doerck S., Göbel K., Weise G., Schneider-Hohendorf T., Reinhardt M., Hauff P., Schwab N., Linker R., Mäurer M., Meuth S.G., et al. Temporal pattern of ICAM-I mediated regulatory T cell recruitment to sites of inflammation in adoptive transfer model of multiple sclerosis. PLoS ONE. 2010;5:e15478. doi: 10.1371/journal.pone.0015478. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ De Mendizábal N.V., Carneiro J., Solé R.V., Goñi J., Bragard J., Martinez-Forero I., Martinez-Pasamar S., Sepulcre J., Torrealdea J., Bagnato F., et al. Modeling the effector-regulatory T cell cross-regulation reveals the intrinsic character of relapses in Multiple Sclerosis. BMC Syst. Biol. 2011;5doi: 10.1186/1752-0509-5-114. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Jolivet R., Coggan J.S., Allaman I., Magistretti P.J. Multi-timescale modeling of activity-dependent metabolic coupling in the neuron-glia-vasculature ensemble. PLoS Comput. Biol. 2015;11:e1004036. doi: 10.1371/journal.pcbi.1004036. [PMC free article] [PubMed] [CrossRef]
- ↑ Zeis T., Allaman I., Gentner M., Schroder K., Tschopp J., Magistretti P.J., Schaeren-Wiemers N. Metabolic gene expression changes in astrocytes in Multiple Sclerosis cerebral cortex are indicative of immune-mediated signaling. Brain Behav. Immun. 2015;48:315–325. doi: 10.1016/j.bbi.2015.04.013.[PubMed] [CrossRef] [Google Scholar]








