Difference between revisions of "Dynamique physiologique dans les maladies démyélinisantes : démêler les relations complexes grâce à la modélisation informatique"
Tags: Mobile web edit Mobile edit Visual edit |
|||
| (14 intermediate revisions by the same user not shown) | |||
| Line 14: | Line 14: | ||
{{FR | {{FR | ||
| Title = | | Title = Dynamique physiologique dans les maladies démyélinisantes : démêler les relations complexes grâce à la modélisation informatique | ||
| author1 = Jay S. Coggan | | author1 = Jay S. Coggan | ||
| author2 = Stefan Bittner | | author2 = Stefan Bittner | ||
| Line 45: | Line 45: | ||
Additional article information | Additional article information | ||
== | == Abstrait == | ||
Malgré des recherches intenses, peu de traitements sont disponibles pour la plupart des troubles neurologiques. Les maladies démyélinisantes ne font pas exception. Ce n'est peut-être pas surprenant compte tenu de la nature multifactorielle de ces maladies, qui impliquent des interactions complexes entre les cellules du système immunitaire, la glie et les neurones. Dans le cas de la sclérose en plaques, par exemple, il n'y a pas d'unanimité parmi les chercheurs sur la cause ou même sur le système ou le type de cellule qui pourrait être le point zéro. Cette situation empêche le développement et l'application stratégique de thérapies basées sur les mécanismes. Nous discuterons de la manière dont la modélisation computationnelle appliquée à des questions à différents niveaux biologiques peut aider à relier des observations disparates et à déchiffrer des mécanismes complexes dont les solutions ne se prêtent pas au simple réductionnisme. En faisant des prédictions vérifiables et en révélant des lacunes critiques dans les connaissances existantes, ces modèles peuvent aider à orienter la recherche et fourniront un cadre rigoureux dans lequel intégrer de nouvelles données au fur et à mesure de leur collecte. De nos jours, les données ne manquent pas ; le défi est de donner un sens à tout cela. À cet égard, la modélisation informatique est un outil inestimable qui pourrait, à terme, transformer la façon dont nous comprenons, diagnostiquons et traitons les maladies démyélinisantes. | |||
Mots-clés : myéline, démyélinisation, sclérose en plaques, maladie neurodégénérative, modèle informatique, découverte de médicaments | |||
== Introduction == | == Introduction == | ||
Les systèmes nerveux des vertébrés sont souvent divisés en matière grise et blanche en fonction de leur apparence et des rôles fonctionnels correspondants. Alors que la matière grise se compose en grande partie de corps cellulaires et de dendrites, la matière blanche contient principalement des axones et tire son nom des feuilles de membrane lipidique appelées myéline qui sont étroitement enroulées autour de ces axones..<ref>Virchow R. Uber das ausgebreitete Vorkommen einer dem Nervenmark analogen Substanz in den tierischen Geweben. Virchows Arch. Pathol. Anat. 1854;6:562–572. doi: 10.1007/BF02116709. [CrossRef] [Google Scholar]</ref> La myéline provient de différentes classes de cellules gliales appelées oligodendrocytes dans le système nerveux central (SNC) et cellules de Schwann dans le système nerveux périphérique (SNP). | |||
L'isolation électrique fournie par les feuilles de myéline améliore la fonction axonale en augmentant à la fois l'efficacité énergétique et la vitesse de conduction des potentiels d'action (PA). Ces deux fonctions peuvent avoir changé d'importance relative au cours de l'évolution.<ref>Stiefel K.M., Torben-Nielsen B., Coggan J.S. Proposed evolutionary changes in the role of myelin. Front. Neurosci. 2013;8 doi: 10.3389/fnins.2013.00202.[PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> La myéline est apparue pour la première fois à l'Ordovicien (485 à 443 ma, soit des millions d'années avant le présent) après la scission des ancêtres de la lamproie et de la myxine du reste des lignées de vertébrés.<ref>Bullock T.H., Moore J.K., Fields R.D. Evolution of myelin sheaths: Both lamprey and hagfish lack myelin. Neurosci. Lett. 1984;48:145–148. doi: 10.1016/0304-3940(84)90010-7. [PubMed] [CrossRef] [Google Scholar]</ref> Avec quelques exceptions intéressantes,<ref>Davis A.D., Weatherby T.M., Hartline D.K., Lenz P.H. Myelin-like sheaths in copepod axons. Nature. 1999;398:571–571. doi: 10.1038/19212. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Hartline D.K., Colman D.R. Rapid conduction and the evolution of giant axons and myelinated fibers. Curr. Biol. 2007;17:R29–R35. doi: 10.1016/j.cub.2006.11.042. [PubMed] [CrossRef] [Google Scholar]</ref>la myéline ou des structures analogues se trouvent chez tous les vertébrés et sont essentielles au bon fonctionnement de leur système nerveux. Le temps approximatif de l'évolution de la myéline peut être déduit du temps connu de divergence entre les accords sans (agnatha) et avec (tous les autres vertébrés) myéline. | |||
L'enveloppe de myéline est interrompue par des tronçons non myélinisés régulièrement espacés connus sous le nom de nœuds de Ranvier. La myéline accélère la conduction en limitant le flux de charge transmembranaire à travers les canaux ioniques situés dans les nœuds. Dans les soi-disant entre-nœuds, le courant circule le long de l'axone avec peu de passage à travers la membrane cellulaire isolée. Le PA est régénéré à chaque nœud où la densité des canaux sodiques et potassiques voltage-dépendants est très élevée. Ce processus est appelé "conduction saltatoire" car le point d'accès semble sauter d'un nœud à l'autre. Les perturbations de ce système de communication rapide peuvent être associées à un éventail de dysfonctionnements du système nerveux.<ref>Arancibia-Carcamo I.L., Attwell D. The node of ranvier in CNS pathology. Acta Neuropathol. 2014;128:161–175. doi: 10.1007/s00401-014-1305-z.[PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> | |||
À plusieurs égards, les axones semblent fonctionner à des limites physiques. Un exemple intéressant est que la taille des axones semble être contrainte par le bruit thermique intrinsèque aux protéines des canaux ioniques ; tout axone plus fin que 0,1 μm serait inutile pour le transfert d'informations en raison de ses niveaux de bruit élevés.<ref>Faisal A.A., White J.A., Laughlin S.B. Ion-channel noise places limits on the miniaturization of the brain’s wiring. Curr. Biol. 2005;15:1143–1149. doi: 10.1016/j.cub.2005.05.056. [PubMed] [CrossRef] [Google Scholar]</ref> Curieusement, 0,1 μm est également à peu près le plus petit diamètre d'axone observé dans les systèmes nerveux [7]. Ceci et des découvertes similaires suggèrent que les axones et leurs sous-structures sont des dispositifs biologiques finement réglés, mais que le réglage peut évidemment être perturbé dans des conditions pathologiques..<ref>Babbs C.F., Riyi S. Subtle paranodal injury slows impulse conduction in a mathematical model of myelinated axons. PLoS ONE. 2013;8:e67767. doi: 10.1371/journal.pone.0067767. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> | |||
La démyélinisation met en mouvement des changements fonctionnels qui sont importants pour les caractéristiques cliniques mais qui ne sont pas facilement expliqués par des changements immunologiques ou radiologiques. L'emplacement d'une plaque prédit quel système sera affecté (moteur vs sensoriel, visuel vs tactile) mais pas comment il sera affecté. Cela met en évidence l'importance d'évaluer la fonction (en plus de la structure) et comment elle change après la démyélinisation. Après avoir présenté les maladies démyélinisantes, nous discuterons de la manière dont les manifestations cliniques de ces maladies reflètent divers changements pathologiques dans la fonction des axones. Nous soutiendrons que comprendre ces changements et tirer pleinement parti de cette compréhension à des fins diagnostiques et thérapeutiques peut bénéficier énormément de la modélisation informatique. | |||
== | == Maladies démyélinisantes == | ||
[[File:Jay S. Coggan1.jpeg|thumb|Figure 1: | [[File:Jay S. Coggan1.jpeg|thumb|Figure 1 : Affections démyélinisantes du système nerveux périphérique (SNP). '''(A''') Polyneuropathies démyélinisantes primaires et ('''B''') Polyneuropathies avec lésions axonales. Abréviations : CMT 1, 2 et 4 : maladie de Charcot-Marie-Tooth ; CMTX : maladie de Charcot-Marie-Tooth liée à l'X ; HNPP : neuropathie héréditaire avec risque de paralysie de pression ; AIDP : polyneuropathie démyélinisante inflammatoire aiguë ; SGB : syndrome de Guillain-Barré. PIDC : polyneuropathie démyélinisante inflammatoire chronique ; MGUS : gammapathie monoclonale de signification indéterminée ; POEMS : polyneuropathie, organomégalie, endocrinopathie ou œdème de la protéine M et anomalies cutanées ; HSAN I–IV : neuropathie sensorielle et autonome héréditaire.|500x500px]]Il existe un grand nombre de maladies démyélinisantes affectant à la fois le SNP (Figure 1) et le SNC (Figure 2). Les étiologies sont hétérogènes, allant des troubles génétiques aux mécanismes métaboliques, infectieux ou auto-immuns. La sclérose en plaques (SEP) est la plus répandue de ces maladies, avec environ 3 millions de patients dans le monde. Sa cause sous-jacente est incertaine, mais on pense qu'elle implique une prédisposition génétique aux agents environnementaux<ref name=":0">Trapp B.D., Nave K.A. Multiple sclerosis: An immune or neurodegenerative disorder? Annu. Rev. Neurosci. 2008;31:247–69. doi: 10.1146/annurev.neuro.30.051606.094313. [PubMed] [CrossRef] [Google Scholar]</ref><ref name=":1">Compston A., Coles A. Multiple sclerosis. Lancet. 2008;372:1502–1517. doi: 10.1016/S0140-6736(08)61620-7. [PubMed] [CrossRef] [Google Scholar]</ref>et peut impliquer des composants immunologiques, de réactivité aux traumatismes, biophysiques, génétiques et/ou métaboliques.<ref name=":1" /> Les symptômes et les lésions doivent être multiples dans le temps et dans l'espace. Autrement dit, il doit y avoir plusieurs épisodes dans le temps, impliquant des parties déconnectées du système nerveux central. Il n'est pas clair si la démyélinisation inflammatoire est un événement primaire ou secondaire dans le processus de la maladie.<ref name=":0" /><ref>Ostermann P.O., Westerberg C.E. Paroxysmal attacks in multiple sclerosis. Brain. 1975;98:189–202. doi: 10.1093/brain/98.2.189. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Twomey J.A., Espir M.L. Paroxysmal symptoms as the first manifestations of multiple sclerosis. J. Neurol. Neurosurg. Psychiatry. 1980;43:296–304. doi: 10.1136/jnnp.43.4.296. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref>La plupart des traitements ciblent le système immunitaire ou la barrière hémato-encéphalique, mais la gestion des symptômes neurologiques par la modulation de l'excitabilité axonale joue également un rôle important (voir ci-dessous). | ||
[[File:Jay S. Coggan 2.jpeg|left|thumb|Figure 2: | [[File:Jay S. Coggan 2.jpeg|left|thumb|Figure 2 : Troubles démyélinisants du système nerveux central (SNC). Abréviations : SEP : sclérose en plaques ; ADEM : encéphalomyélite aiguë disséminée ; VIH : virus de l'immunodéficience humaine ; LMP : leucoencéphalopathie multifocale progressive ; HTLV-1 : virus T-lymphotrope humain 1 ; PRES : syndrome d'encéphalopathie postérieure réversible.]] | ||
=== | === Évaluation clinique de la sclérose en plaques === | ||
Les symptômes sont divers et peuvent survenir dans toutes les combinaisons au sein d'un même patient. Le diagnostic exige qu'il y ait plusieurs lésions et épisodes symptomatiques au fil du temps, impliquant des parties déconnectées du SNC. De plus, les symptômes ont tendance à être peu corrélés aux mesures radiologiques. Dans la grande majorité des cas, les caractéristiques cliniques individuelles ne sont pas bien corrélées avec les résultats de l'IRM, en particulier pour les lésions cérébrales.<ref>Seewann A., Vrenken H., van der Valk P., Blezer E.L., Knol D.L., Castelijns J.A., Polman C.H., Pouwels P.J., Barkhof F., Geurts J.J. Diffusely abnormal white matter in chronic multiple sclerosis: Imaging and histopathologic analysis. Arch. Neurol. 2009;66:601–609. doi: 10.1001/archneurol.2009.57. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Ceccarelli A., Bakshi R., Neema M. MRI in multiple sclerosis: A review of the current literature. Curr. Opin. Neurol. 2012;25:402–409. doi: 10.1097/WCO.0b013e328354f63f. [PubMed] [CrossRef] [Google Scholar]</ref><ref name=":2">Moore J.W., Joyner R.W., Brill M.H., Waxman S.D., Najar-Joa M. Simulations of conduction in uniform myelinated fibers. Relative sensitivity to changes in nodal and internodal parameters. Biophys. J. 1978;21:147–160. doi: 10.1016/S0006-3495(78)85515-5. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref>Cette dissociation clinico-radiologique demande une meilleure compréhension théorique des symptômes de démyélinisation et des changements biophysiques sous-jacents qui les accompagnent, ce qui soulève bien sûr la question de ce qu'il advient exactement des axones affectés. | |||
Les symptômes sont souvent intermittents et peuvent inclure à la fois une perte de fonction (symptômes négatifs tels qu'engourdissement, faiblesse musculaire, picotements, cécité, incontinence, perte de la fonction sexuelle, perte d'équilibre, troubles de l'élocution, constipation, fatigue invalidante, dépression, dysfonctionnement cognitif , incapacité à avaler, perturbation de la marche et perte de contrôle de la respiration) et gain de fonction (symptômes positifs tels que spasmes, spasticité, crampes, douleur, vision floue ou double, urgence ou hésitation urinaire, nausées, entre autres).<ref>Waxman S.G., Kocsis J.D., Stys P.K. The Axon: Structure, Function and Pathophysiology. Oxford University Press; New York, NY, USA: 1995. [Google Scholar]</ref>Les critères diagnostiques différentiels précoces incluent le signe de Lhermitte (sensations liées à la flexion du cou) et le phénomène d'Uhthoff (aggravation des symptômes liée à la température). Le diagnostic différentiel de la SEP suit de près les critères de McDonald.<ref>Polman C.H., Reingold S.C., Banwell B., Clanet M., Cohen J.A., Filippi M., Fujihara K., Havrdova E., Hutchinson M., Kappos L., et al. Diagnostic criteria for multiple sclerosis: 2010 revisions to the McDonald criteria. Ann. Neurol. 2011;69:292–302. doi: 10.1002/ana.22366. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> | |||
Dans les études diagnostiques humaines des potentiels évoqués visuels, sensoriels ou moteurs (VEP, SEP, MEP), seule la latence ou la vitesse de conduction peut être mesurée avec précision (avec des variations d'environ 30 % à 40 % entre les différents laboratoires). Mais ces mesures donnent peu d'indices sur les mécanismes sous-jacents qui impliquent un ralentissement ou un blocage de la conduction, ou des facteurs morphologiques ou fonctionnels tels que la ramification, la démyélinisation, la remyélinisation, l'effilement axonal (diminution de la section transversale), l'atténuation ou la repousse, les changements de conduction liés à la température. , ou malpolarisation (hyper ou hypo). Néanmoins, le type de lésion démyélinisante peut fournir des indices sur l'étiologie et donc orienter le traitement ; par exemple, les facteurs génétiques semblent être plus fortement corrélés aux processus pathologiques internodaux et les dysfonctionnements immunologiques provoquent des anomalies paranodales.<ref name=":3">Stephanova D.I., Dimitrov B. Computational Neuroscience: Simulated Demyelinating Neuropathies and Neuronopathies. CRC Press; Boca Raton, FL, USA: 2013. [Google Scholar]</ref> | |||
Un certain nombre de tests sont couramment utilisés pour évaluer la fonction neurale. En électroneurographie, un bref stimulus électrique est appliqué à un nerf périphérique à une position anatomiquement prédéfinie afin de mesurer la latence et l'amplitude du potentiel d'action composé à un autre endroit le long du nerf. Les résultats doivent être interprétés en combinaison avec les résultats cliniques et les tests (par exemple, l'électromyographie) mais, ce qui est important, différentes maladies présentent différents modèles de changements électroneurographiques. Ceci est important non seulement à des fins de diagnostic, mais peut également indiquer des changements pathologiques spécifiques dans la fonction axonale qui pourraient, à leur tour, aider à guider le choix de la thérapie (si la pathobiologie axonale était comprise ; voir ci-dessous). À l'aide d'un suivi de seuil, l'excitabilité a été mesurée chez l'homme pour plusieurs maladies démyélinisantes périphériques, notamment la maladie de Charcot-Marie-Tooth de type 1A (CMT1A), la polyneuropathie démyélinisante inflammatoire chronique (PDIC), le syndrome de Guillain-Barré (SGB) et la neuropathie motrice multifocale (MMN). ).<ref name=":4">Bostock H., Baker M., Reid G. Changes in excitability of human motor axons underlying post-ischaemic fasciculations: Evidence for two stable states. J. Physiol. 1991;441:537–557. doi: 10.1113/jphysiol.1991.sp018766.[PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>Mogyoros I., Kiernan M.C., Burke D., Bostock H. Strength-duration properties of sensory and motor axons in amyotrophic lateral sclerosis. Brain. 1998;121:851–859. doi: 10.1093/brain/121.5.851. [PubMed] [CrossRef] [Google Scholar]</ref><ref name=":5">Kiernan M.C., Burke D., Andersen K.V., Bostock H. Multiple measures of axonal excitability: A new approach in clinical testing. Muscle Nerve. 2000;23:399–409. doi: 10.1002/(SICI)1097-4598(200003)23:3<399::AID-MUS12>3.0.CO;2-G. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Cappelen-Smith C., Kuwabara S., Lin C.S., Mogyoros I., Burke D. Membrane properties in chronic inflammatory demyelinating polyneuropathy. Brain. 2001;124:2439–2447. doi: 10.1093/brain/124.12.2439. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Kuwabara S., Ogawara K., Sung J.Y., Mori M., Kanai K., Hattori T., Yuki N., MLin C.S., Burke D., Bostock H. Differences in membrane properties of axonal and demyelinating Guillain-Barré syndromes. Ann. Neurol. 2002;52:180–187. doi: 10.1002/ana.10275. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Nodera H., Bostock H., Kuwabara S., Sakamoto T., Asanuma K., Jia-Ying S., Ogawara K., Hattori N., Hirayama M., Sobue G., et al. Nerve excitability properties in Charcot-Marie-Tooth disease type 1A. Brain. 2004;127:203–211. doi: 10.1093/brain/awh020. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Sung M.H., Simon R. In silico simulation of inhibitor drug effects on nuclear factor-κB pathway dynamics. Mol. Pharmacol. 2004;66:70–75. doi: 10.1124/mol.66.1.70. [PubMed] [CrossRef] [Google Scholar]</ref> The Le défi réside dans l'interprétation de ces observations. À cette fin, le groupe de Stephanova a simulé des degrés progressivement plus élevés de démyélinisation systématique et focale des fibres motrices pour tenter d'expliquer les changements physiologiques observés.<ref>Stephanova D.I., Daskalova M. Differences in potentials and excitability properties in simulated cases of demyelinating neuropathies. Part III. Paranodal internodal demyelination. Clin. Neurophysiol. 2005;116:2334–2341. doi: 10.1016/j.clinph.2005.07.013. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Stephanova D.I., Daskalova M.S. Differences between the channels, currents and mechanisms of conduction slowing/block and accommodative processes in simulated cases of focal demyelinating neuropathies. Eur. Biophys. J. 2008;37:829–842. doi: 10.1007/s00249-008-0284-1. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Stephanova D.I., Alexandrov A.S. Simulating mild systematic and focal demyelinating neuropathies: Membrane property abnormalities. J. Integr. Neurosci. 2006;5:595–623. doi: 10.1142/S0219635206001331. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Stephanova D.I., Daskalova M., Alexandrov A.S. Channels, currents and mechanisms of accommodative processes in simulated cases of systematic demyelinating neuropathies. Brain Res. 2007;1171:138–151. doi: 10.1016/j.brainres.2007.07.029. [PubMed] [CrossRef] [Google Scholar]</ref><ref name=":6">Stephanova D.I., Krustev S.M., Negrev N., Daskalova M. The myelin sheath aqueous layers improve the membrane properties of simulated chronic demyelinating neuropathies. J. Integr. Neurosci. 2011;10:105–120. doi: 10.1142/S0219635211002646. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Stephanova D.I., Alexandrov A.S., Kossev A., Christova L. Simulating focal demyelinating neuropathies: Membrane property abnormalities. Biol. Cybern. 2007;96:195–208. doi: 10.1007/s00422-006-0113-5. [PubMed] [CrossRef] [Google Scholar]</ref> (voir la section Modélisation ci-dessous). | |||
=== | === Implication des corps cellulaires === | ||
La progression de la SEP récurrente-rémittente (RRMS) à la SEP progressive secondaire (SPMS) est associée à une plus grande implication de la pathologie de la matière grise, bien que l'implication axonale/de la matière grise puisse déjà être observée dans les premiers stades de la maladie.<ref>Bø L., Geurts J.J., Mörk S.J., van der Valk P. Grey matter pathology in multiple sclerosis. Acta Neurol. Scand. Suppl. 2006;183:48–50. doi: 10.1111/j.1600-0404.2006.00615.x. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Geurts J.J., Barkhof F. Grey matter pathology in multiple sclerosis. Lancet Neurol. 2008;7:841–851. doi: 10.1016/S1474-4422(08)70191-1. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Zivadinov R., Pirko I. Advances in understanding gray matter pathology in multiple sclerosis: Are we ready to redefine disease pathogenesis? BMC Neurol. 2012;12 doi: 10.1186/1471-2377-12-9. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>Popescu B.F., Lucchinetti C.F. Pathology of demyelinating diseases. Annu. Rev. Pathol. 2012;7:185–217. doi: 10.1146/annurev-pathol-011811-132443.[PubMed] [CrossRef] [Google Scholar]</ref> Les dommages à la matière grise sont considérés comme le mécanisme sous-jacent de la progression de la maladie et de l'invalidité permanente chez les patients atteints de SEP, et sont mesurés par la perte de la fraction parenchymateuse cérébrale ou du volume cérébral par IRM ou cliniquement par la progression sur l'échelle élargie d'état d'invalidité (EDSS).<ref>Kurtzke J.F., Beebe G.W., Nagler B., Nefzger M.D., Auth T.L., Kurland L.T. Studies on the natural history of multiple sclerosis: V. Long-term survival in young men. Arch. Neurol. 1970;22:215–225. doi: 10.1001/archneur.1970.00480210025003. [PubMed] [CrossRef] [Google Scholar]</ref>La transition de RRMS à SPMS est inquiétante en raison du manque de traitements pour lutter contre la détérioration physique et cognitive exacerbée à laquelle la plupart des patients SPMS sont confrontés.<ref name=":0" /><ref>Rao S.M., Leo G.J., Bernardin L., Unverzagt F. Cognitive dysfunction in multiple sclerosis. I. Frequency, patterns, and prediction. Neurology. 1991;41:685–691. doi: 10.1212/WNL.41.5.685. [PubMed] [CrossRef] [Google Scholar]</ref> | |||
==== | ==== Traitement ==== | ||
Les principales interventions dans la SEP consistent à moduler la réponse immunitaire avec, par exemple, la méthy-prednisolone, l'interféron bêta, l'acétate de glatiramère ou le fingolimod, ou en empêchant les cellules inflammatoires de traverser la BHE (anticorps monoclonaux, par exemple Tysabri (anti α4-intégrine, Natalizumab )). Très récemment, les deux premiers agents oraux (fumarate et tériflunomide) ainsi que l'anticorps anti-CD52 Natalizumab ont été approuvés pour le traitement de la SEP-RR, qui peuvent être traités avec succès par des thérapies de première ligne comme les interférons, l'acétate de glatiramère ou le fingolimod, ou par thérapeutiques de seconde intention, mais les formes progressives (PPMS, SPMS) représentent encore un besoin biomédical non satisfait.<ref>Meuth S.G., Bittner S., Ulzheimer J.C., Kleinschnitz C., Kieseier B.C., Wiendl H. Therapeutic approaches to multiple sclerosis: An update on failed, interrupted, or inconclusive trials of neuroprotective and alternative treatment strategies. BioDrugs. 2010;24:317–330. doi: 10.2165/11537190-000000000-00000. [PubMed] [CrossRef] [Google Scholar]</ref>Les antinéoplasiques sont utilisés dans les cas extrêmement avancés ou difficiles.<ref>Goldenberg M.M. Multiple sclerosis review. Pharm. Ther. 2012;37:137–139.[PMC free article] [PubMed] [Google Scholar]</ref> | |||
Les médicaments modificateurs de la maladie sont essentiels pour arrêter ou au moins atténuer le processus de démyélinisation, mais il est également essentiel de gérer les symptômes résultant de la démyélinisation qui s'est déjà produite. La modulation des canaux ioniques est de plus en plus prometteuse avec l'avènement de nouveaux bloqueurs de canaux ioniques comme l'Ampyra (blocage des canaux K).<ref>Göbel K., Wedell J.H., Herrmann A.M., Wachsmuth L., Pankratz S., Bittner S., Budde T., Kleinschnitz C., Faber C., Wiendl H., et al. 4-Aminopyridine ameliorates mobility but not disease course in an animal model of multiple sclerosis. Exp. Neurol. 2013;248:62–71. doi: 10.1016/j.expneurol.2013.05.016.[PubMed] [CrossRef] [Google Scholar]</ref><ref>Krishnan A.V., Kiernan M.C. Sustained-release fampridine and the role of ion channel dysfunction in multiple sclerosis. Mult. Scler. 2013;19:385–391. doi: 10.1177/1352458512463769. [PubMed] [CrossRef] [Google Scholar]</ref> Le blocage des canaux potassiques vise à améliorer l'excitabilité des axones. Le problème est que de telles interventions, bien qu'efficaces pour traiter les symptômes négatifs et restaurer la fonction, ont tendance à exacerber les symptômes positifs..<ref>Bowe C.M., Kocsis J.D., Targ E.F., Waxman S.G. Physiological effects of 4-aminopyridine on demyelinated mammalian motor and sensory fibers. Ann. Neurol. 1987;22:264–268. doi: 10.1002/ana.410220212. [PubMed] [CrossRef] [Google Scholar]</ref>À l'inverse, le traitement des symptômes positifs tels que les spasmes avec des antiépileptiques comme la carbamazépine, par exemple, peut exacerber les symptômes négatifs.<ref>Sakurai M., Kanazawa I. Positive symptoms in multiple sclerosis: Their treatment with sodium channel blockers, lidocaine and mexiletine. J. Neurol. Sci. 1999;162:162–168. doi: 10.1016/S0022-510X(98)00322-0. [PubMed] </ref> En fait, le blocage des canaux Na+ réduit non seulement les symptômes positifs, mais peut également être neuroprotecteur (car l'accumulation de Na+ provoque des mécanismes d'échange Na+/Ca2+ pour charger les neurones avec Ca2+, qui est excitotoxique)<ref>Mattson M.P., Guthrie P.B., Kater S.B. A role for Na+-dependent Ca2+extrusion in protection against neuronal excitotoxicity. FASEB J. 1989;3:2519–2526. [PubMed] [Google Scholar]</ref> (Figure 3) mais ces avantages se font au détriment des symptômes négatifs. Par conséquent, et en particulier chez un patient présentant un mélange de symptômes positifs et négatifs, les options de traitement sont limitées. | |||
[[File:Jay S. Coggan 3.jpeg|center|thumb|600x600px| | [[File:Jay S. Coggan 3.jpeg|center|thumb|600x600px|Mécanismes de la neurodégénérescence liée à la démyélinisation. La démyélinisation peut entraîner progressivement des déséquilibres ioniques, une crise énergétique, un blocage de la conduction et éventuellement une neurodégénérescence. (A) un nœud normal de Ranvier avec des régions juxtaparanodales, paranodales et nodales intactes, représentant <math>Na^+,K^+,Ca^+</math>ions circulant à travers leurs canaux respectifs avec des mitochondries fournissant l'ATP pour l'énergie dépendante <math>Na^+,K^+ ATP</math>ases qui rétablissent les gradients ioniques appauvris par le flux ionique à travers les canaux. De nombreux canaux ioniques différents sont présents dans l'axone, mais seul un petit sous-ensemble est représenté ici ; (B) la démyélinisation partielle entraîne la dispersion des canaux ioniques nodaux, une insuffisance énergétique et des déséquilibres des gradients ioniques ; (C) une démyélinisation complète peut entraîner un blocage de la conduction et une dégénérescence axonale en raison de l'accumulation de <math>Ca^+</math>qui résulte de la crise énergétique et de la perturbation des équilibres ioniques. Abbreviations <math>K_v1</math>:: canal potassique de type 1 <math>Na_{v}1.6</math> et <math>Na_{v}1.2</math>: : canaux sodiques types 1.6 et 1.2 ; <math>Na^+,Ca^+</math> Echangeur : <math>Na^+,Ca^+</math>pompe d'échange ; <math>Na^+,K^+ ATP</math>ase : dépendant de l'ATP (énergie) <math>Na^+,K^+</math>pompe d'échange ; CASPR1 : protéine 1 associée à la contactine (molécule d'interaction entre cellule myélinisante et axone) ;; <math>NF55</math>: neurofascine 155 (molécule d'interaction prédominante entre la myéline et l'axone au niveau de la jonction axo-gliale paranodale)..]] | ||
La discussion ci-dessus soulève le point important que bien que beaucoup de bruit ait été fait sur les mécanismes immunitaires, leur lien avec les changements cliniques est largement corrélationnel. Il faut considérer les effets intermédiaires sur la fonction axonale, à savoir les modifications primaires et secondaires (compensatoires) de l'excitabilité axonale, afin d'apprécier comment la fonction neurologique est altérée. Ces changements ne sont pas des conséquences simples et directes de la démyélinisation, mais suggèrent plutôt que la physiologie axonale elle-même change en réponse à la démyélinisation. Certains de ces changements sont adaptatifs tandis que d'autres sont inadaptés, ou peut-être que les changements adaptatifs peuvent devenir inadaptés à mesure que la situation (état de la myélinisation) évolue. Si des changements dans la physiologie axonale dictent la manifestation de divers symptômes, la gestion des symptômes reposera en grande partie sur des traitements visant à manipuler la physiologie axonale. Le développement stratégique de tels traitements nécessite une compréhension approfondie et mécaniste de l'excitabilité axonale et de sa régulation. | |||
=== | === Pathobiologie des axones === | ||
==== | ==== Changements structurels et moléculaires ==== | ||
Les axones sont profondément affectés par la démyélinisation. La morphologie de l'axone devient irrégulière ou enflée, souvent avec un aspect perlé. Une accumulation focale de protéines (par transport axonal rapide) est également observée. Dans les plaques actives chroniques, une perte axonale de 20 % à 80 % est apparente dans la substance blanche péri-plaque et la substance blanche distante normale.<ref>Moll N.M., Rietsch A.M., Thomas S., Ransohoff A.J., Lee J.C., Fox R., Chang A., Ransohoff R.M., Fisher E. Multiple sclerosis normal-appearing white matter: Pathology-imagig correlations. Ann. Neurol. 2011;70:764–773. doi: 10.1002/ana.22521. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> Dans les plaques actives précoces et chroniques actives, on pense que les dommages sont causés par des facteurs inflammatoires et immunitaires libérés lors de la démyélinisation inflammatoire aiguë. Les médiateurs proposés comprennent les protéases, les cytokines, les excitotoxines et les radicaux libres. Les antigènes neuronaux sont les cibles d'une réaction immunitaire conduisant à une inflammation du SNC. D'autres facteurs causant un dysfonctionnement axonal ou la mort comprennent un manque de soutien trophique de la myéline et des oligodendrocytes, des dommages causés par des facteurs immunitaires solubles ou cellulaires encore présents dans la plaque inactive et une défaillance mitochondriale chronique dans le cadre de demandes énergétiques accrues.<ref name=":7">Lucchinetti C., Brück W., Parisi J., Scheithauer B., Rodriguez M., Lassmann H. Heterogeneity of multiple sclerosis lesions: Implications for the pathogenesis of demyelination. Ann. Neurol. 2000;47:707–717. doi: 10.1002/1531-8249(200006)47:6<707::AID-ANA3>3.0.CO;2-Q. [PubMed] [CrossRef] [Google Scholar]</ref> Un rôle critique des oligodendrocytes et des cellules de Schwann dans la survie des axones a également été attribué aux peroxysomes, au métabolisme des lipides et à la détoxification des espèces réactives de l'oxygène (ROS)..<ref>Kassmann C.M., Nave K.A. Oligodendroglial impact on axonal function and survival— A hypothesis. Curr. Opin. Neurol. 2008;21:235–241. doi: 10.1097/WCO.0b013e328300c71f. [PubMed] [CrossRef] [Google Scholar]</ref> | |||
La remyélinisation est souvent observée sous forme de plaques d'ombre formées par le recrutement de précurseurs d'oligodendrocytes indifférenciés qui migrent vers et entourent les lésions permettant de fines couches de remyélinisation.<ref>Scolding N., Franklin R. Axon loss in multiple sclerosis. Lancet. 1998;352:340–341. doi: 10.1016/S0140-6736(05)60463-1. [PubMed] [CrossRef] [Google Scholar]</ref>Ce processus se produit principalement dans les plaques actives aiguës, mais aussi dans les phases chroniques. Cette observation a déclenché le développement d'un nouvel anticorps monoclonal dirigé contre LINGO-1 (Anti-LINGO-1). La liaison de LINGO-1 aux récepteurs Nogo empêche les processus de remyélinisation dans le SNC ; l'inhibition de cette interaction permet ainsi une remyélinisation significative chez les animaux atteints d'encéphalomyélite auto-immune expérimentale.<ref>Mi S., Miller R.H., Lee X., Scott M.L., Shulag-Morskaya S., Shao Z., Chang J., Thill G., Levesque M., Zhang M., et al. LINGO-1 negatively regulates myelination by oligodendrocytes. Nat. Neurosci. 2005;8:745–751. doi: 10.1038/nn1460. [PubMed] [CrossRef] [Google Scholar]</ref> | |||
Au cours du processus de la maladie, les lymphocytes et les macrophages autoréactifs peuvent traverser la barrière hémato-encéphalique et s'accumuler dans le cerveau et la moelle épinière.<ref>Bittner S., Ruck T., Schuhmann M.K., Herrmann A.M., Maati H.M., Bobak N., Göbel K., Langhauser F., Stegner D., Ehling P., et al. 2013 Endothelial TWIK-related potassium channel-1 (TREK1) regulates immune-cell trafficking into the CNS. Nat. Med. 2013;19:1161–1165. doi: 10.1038/nm.3303. [PubMed] </ref> Les lymphocytes régulateurs (Tregs) ne parviennent pas à supprimer les cellules effectrices, principalement les cellules CD8+ cytotoxiques.<ref>Viglietta V., Baecher-Allan C., Weiner H.L., Hafler D.A. Loss of functional suppression by CD4+CD25+ regulatory T cells in patients with multiple sclerosis. J. Exp. Med. 2004;199:971–999. doi: 10.1084/jem.20031579.[PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> La libération de cytokines pro-inflammatoires recrute des microglies naïves, qui entrent en contact avec une unité oligodendrocyte-myéline par des interactions avec les récepteurs Fc et du complément. Un signal cytotoxique déclenchant la mort est ensuite transmis par le facteur de nécrose tumorale α (TNFα) lié à la surface.<ref>Zajicek J.P., Wing M., Scolding N.J., Compston D.A. Interactions between oligodendrocytes and microglia. A major role for complement and tumour necrosis factor in oligodendrocyte adherence and killing. Brain. 1992;115:1611–1631. [PubMed] [Google Scholar]</ref>Cela se produit de concert avec des dommages axonaux importants.<ref name=":1" /> | |||
Lucchinetti el al.<ref name=":7" /> | Lucchinetti el al.<ref name=":7" />ont proposé quatre immunopatterns distincts de formation de plaque trouvés chez des patients à différents stades de la maladie. Les plaques de type I et II sont dominées par l'inflammation des lymphocytes T et des macrophages et on pense qu'elles imitent respectivement les modèles d'encéphalomyélite auto-immune à cellules T ou à cellules T plus anticorps. La perte de myéline dans les plaques de type I peut être causée par des facteurs toxiques libérés par les macrophages activés, alors que les dépôts d'IgG et de complément suggèrent un rôle des anticorps dans les plaques de type II. En revanche, les schémas III et IV montrent une grande dystrophie oligodendrocytaire. On pense que le motif III est lié à des lésions induites par l'hypoxie qui sont entraînées par des défauts de la fonction mitochondriale,<ref name=":8">Nikić I., Merkler D., Sorbara C., Brinkoetter M., Kreutzfeldt M., Bareyre F.M., Brück W., Bishop D., Misgeld T., Kerschensteiner M. A reversible form of axon damage in experimental autoimmune encephalomyelitis and multiple sclerosis. Nat. Med. 2011;17:495–499. doi: 10.1038/nm.2324. [PubMed] [CrossRef] [Google Scholar]</ref> alors que les lésions de type IV sont associées à une mort profonde non apoptotique des oligodendrocytes dans la substance blanche périplaque. | ||
Barnett and Prineas<ref>Barnett M.H., Prineas J.W. Relapsing and remitting multiple sclerosis: Pathology of the newly forming lesion. Ann. Neurol. 2004;55:458–468. doi: 10.1002/ana.20016. [PubMed] [CrossRef] [Google Scholar]</ref> | Barnett and Prineas<ref>Barnett M.H., Prineas J.W. Relapsing and remitting multiple sclerosis: Pathology of the newly forming lesion. Ann. Neurol. 2004;55:458–468. doi: 10.1002/ana.20016. [PubMed] [CrossRef] [Google Scholar]</ref> ont analysé les lésions des patients directement après le début d'une rechute, au cours de laquelle la formation de plaque active était en cours. Leurs résultats suggèrent que l'apoptose des oligodendrocytes et l'activation gliale se produisent au cours de la formation précoce de la plaque active en l'absence de lymphocytes inflammatoires ou de phagocytes de myéline. Ils ont proposé que la vulnérabilité des oligodendrocytes, décrite dans le schéma de type III de Lucchinetti, est présente dans les premiers stades de toute formation de plaque et est le déclencheur de la nécrose post-apoptotique ultérieure qui initie la phagocytose de la myéline par les macrophages à des stades ultérieurs. Les analyses in vitro de ce processus ont impliqué des cascades du complément, des facteurs de nécrose tumorale ou des seconds messagers gazeux.<ref>Van der Laan L.J., Ruuls S.R., Weber K.S., Lodder I.J., Döpp E.A., Dijkstra C.D. Macrophage phagocytosis of myelin ''in vitro'' determined by flow cytometry: Phagocytosis is mediated by CR3 and induces production of tumor necrosis factor-α and nitric oxide. J. Neuroimmunol. 1996;70:145–152. doi: 10.1016/S0165-5728(96)00110-5. [PubMed] [CrossRef] [Google Scholar]</ref> Bien que l'identification des plaques et le suivi de leur progression aient une valeur clinique importante, il n'y a qu'une faible corrélation entre la charge des lésions démyélinisantes telle que déterminée par l'IRM conventionnelle et l'incapacité clinique des patients atteints de SEP (voir ci-dessus). | ||
==== | ==== Changements fonctionnels ==== | ||
Les mécanismes d'altération fonctionnelle lors de la démyélinisation incluent souvent la perturbation des ions transmembranaires Na+, K+ et Ca2+, la dispersion de leurs canaux ioniques correspondants, une diminution de l'efficacité de la conduction AP et une crise métabolique qui en résulte (Figure 3). La démyélinisation peut facilement expliquer l'échec de la conduction dans l'axone affecté. Si la conduction n'échoue pas complètement, la vitesse de conduction peut néanmoins être ralentie et un ralentissement différentiel entre différents axones peut entraîner des retards de conduction variables qui entraînent des pointes désynchronisées. | |||
La démyélinisation permet également aux axones dénudés de devenir étroitement apposés, ouvrant ainsi la voie aux interactions éphaptiques et à la diaphonie.<ref name=":1" /> La réflexion peut également se produire en raison d'une inadéquation d'impédance entre les longueurs d'axone myélinisées et non myélinisées. D'autre part, l'hyperexcitabilité ne peut pas être directement attribuée à la démyélinisation ; au lieu de cela, des modifications secondaires de l'excitabilité intrinsèque doivent être invoquées pour expliquer des phénomènes tels que la génération de pics ectopiques et la post-décharge (AD). Les altérations de l'excitabilité représentent probablement des changements compensatoires visant à restaurer la fonction suite à la perturbation causée directement par la démyélinisation, conformément à un processus appelé plasticité homéostatique,<ref>Wang G., Thompson S.M. Maladaptive homeostatic plasticity in a rodent model of central pain syndrome: Thalamic hyperexcitability after spinothalamic tract lesions. J. Neurosci. 2008;28:11959–11969. doi: 10.1523/JNEUROSCI.3296-08.2008. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> mais cette compensation peut évidemment être inadaptée. Chacun des résultats susmentionnés, qui ne sont pas mutuellement exclusifs, contribue à produire différents symptômes observés dans les maladies démyélinisantes. | |||
Les symptômes paroxystiques caractérisés par l'apparition soudaine ou l'intensification de symptômes tels que des spasmes ou des douleurs lancinantes résultent probablement de la MA ou de pointes inappropriées de type éclatement. De tels modèles de pointe suggèrent des interactions hautement non linéaires entre le courant ionique contributeurs<ref name=":9">Coggan J.S., Prescott S.A., Bartol T.M., Sejnowski T.J. Imbalance of ionic conductances contributes to diverse symptoms of demyelination. Proc. Natl. Acad. Sci. USA. 2010;107:20602–20609. doi: 10.1073/pnas.1013798107.[PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref name=":10">Coggan J.S., Ocker G.K., Sejnowski T.J., Prescott S.A. Explaining pathological changes in axonal excitability through dynamical analysis of conductance-based models. J. Neural Eng. 2011;8 doi: 10.1088/1741-2560/8/6/065002. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> et pourrait, en théorie du moins, impliquer des interactions entre différentes régions du neurone.<ref name=":11">Coggan J.S., Prescott S.A., Sejnowski T.J. Cooperativity between remote sites of ectopic spiking allows afterdischarge to be initiated and maintained at different locations. J. Comput. Neurosci. 2015;39:17–28. doi: 10.1007/s10827-015-0562-8. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> Contrairement aux formes plus génériques d'hyperexcitabilité (par exemple, augmentation de la cadence de déclenchement ou réduction du seuil), ces schémas spécifiques sont limités en termes de mécanismes précis par lesquels ils pourraient survenir. Par conséquent, l'identification des changements de canaux ioniques sous-jacents à ces formes spécifiques d'hyperexcitabilité peut aider à limiter la recherche de changements de canaux ioniques responsables de formes d'hyperexcitabilité associées, mais moins distinctives. | |||
La perturbation de l'équilibre énergétique dans un neurone pourrait également avoir un impact profond sur le bien-être des neurones (Figure 3). En effet, des modifications compensatoires peuvent parvenir à restaurer certaines fonctions mais, sans renverser le problème primaire, d'autres problèmes peuvent survenir. Par exemple, même si le blocage de la conduction est empêché par une modification compensatoire appropriée de l'excitabilité (c'est-à-dire une modification qui n'entraîne pas d'hyperexcitabilité), le système peut être moins efficace sur le plan énergétique. La perte des économies d'énergie offertes par la conduction saltatoire induit une production d'énergie mitochondriale compensatoire qui peut entraîner des dommages oxydatifs et une neurodégénérescence.<ref name=":8" /><ref name=":12">Aon M.A., Cortassa S., Akar F.G., Brown D.A., Zhou L., O’Rourke B. From mitochondrial dynamics to arrhythmias. Int. J. Biochem. Cell Biol. 2009;41:1940–1948. doi: 10.1016/j.biocel.2009.02.016. [PMC free article][PubMed] [CrossRef] [Google Scholar]</ref><ref name=":13">Su K., Bourdette D., Forte M. Mitochondrial dysfunction and neurodegeneration in multiple sclerosis. Front. Physiol. 2013;4doi: 10.3389/fphys.2013.00169. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> | |||
Garder une trace de cette longue liste de changements neurobiologiques, comprendre les interrelations entre ces changements et finalement lier ces changements aux manifestations cliniques et appliquer un traitement efficace n'est pas une tâche facile. À cette fin, la modélisation informatique est un outil inestimable. Les simulations ne servent pas seulement à organiser les informations déjà connues, elles identifient également des lacunes cruciales dans les connaissances. L'utilisation judicieuse de la modélisation informatique peut donc permettre une compréhension plus complète et faciliter l'application plus efficace de cette compréhension, comme indiqué ci-dessous. | |||
=== | === Modélisation informatique === | ||
Surtout lorsqu'elle est associée à des expériences traditionnelles, la modélisation informatique est indispensable pour donner un sens aux données incohérentes et aux mécanismes complexes. Ces avantages sont illustrés par l'application de simulations dans d'autres domaines, tels que l'épilepsie.<ref>Soltesz I., Staley K. Computational Neuroscience in Epilepsy. 1st ed. Elsevier; London, UK: 2008. [Google Scholar]</ref> Ici, nous passons en revue une partie de l'histoire de la modélisation informatique des axones, des conductances ioniques, de la physiologie de la myéline et de la démyélinisation, du système immunitaire, des mitochondries et d'autres facteurs biologiques essentiels à la compréhension des maladies démyélinisantes. Notre examen n'est pas exhaustif mais fournira une large introduction aux efforts passés, présents et futurs dans ce domaine. | |||
==== | ==== Modélisation des axones ==== | ||
La modélisation informatique des axones a évolué sur le plan taxonomique, du calmar aux tissus de mammifères avec une augmentation correspondante de la sophistication. Le modèle de Hodgkin et Huxley (HH), qui a fourni la première explication approfondie de la génération d'AP, a été dérivé d'expériences sur des axones géants non myélinisés de calmar,<ref>Hodgkin A.L., Huxley A.F. The components of membrane conductance in the giant axon of ''Loligo''. J. Physiol. 1952;116:473–496. doi: 10.1113/jphysiol.1952.sp004718. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>Hodgkin A.L., Huxley A.F. Currents carried by sodium and potassium ions through the membrane of the giant axon of ''Loligo''. J. Physiol. 1952;116:449–472. doi: 10.1113/jphysiol.1952.sp004717. [PMC free article] [PubMed] </ref>mais ce premier modèle s'est avéré être un outil inestimable à partir duquel des modèles ultérieurs plus sophistiqués d'axones myélinisés ont évolué. | |||
L'hétérogénéité spatiale et biophysique conférée par l'ajout de myéline, et la formation conséquente de nœuds et de régions internodales, représente une augmentation significative de la complexité des axones. Le premier modèle informatique d'un axone myélinisé était un modèle unidimensionnel qui effondrait la gaine de myéline dans l'axolemme passif sous-jacent, utilisait une taille de pas spatial uniforme pour former l'approximation discrète utilisée dans la solution numérique et employait une caractérisation HH de la membrane nodale.<ref>Fitzhugh R. Computation of impulse initiation and saltatory conduction in a myelinated nerve fiber. Biophys. J. 1962;2:11–21. doi: 10.1016/S0006-3495(62)86837-4. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> Goldman & Albus<ref>Goldman L., Albus J.S. Computation of impulse conduction in myelinated fibers; theoretical basis of the velocity-diameter relation. Biophys. J. 1968;8:596–607. doi: 10.1016/S0006-3495(68)86510-5. [PMC free article][PubMed] [CrossRef] [Google Scholar]</ref> modifié ce modèle pour inclure une description de la membrane nodale dérivée de données expérimentales sur les fibres nerveuses myélinisées de Xenopus laevis telles que déterminées par Frankenhaeuser & Huxley.<ref>Frankenhaeuser B., Huxley A.F. The action potential in the myelinated nerve fiber of ''Xenopus'' ''laevis'' as computed on the basis of voltage clamp data. J. Physiol. 1964;171:302–315. doi: 10.1113/jphysiol.1964.sp007378.[PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> Des études ultérieures ont utilisé la même forme de base pour le modèle avec quelques variations pour la représentation de l'axolemme.<ref name=":2" /><ref>Smith R.S., Koles Z.J. Myelinated nerve fibers: Computed effect of myelin thickness on conduction velocity. Am. J. Physiol. 1970;219:1256–1258.[PubMed] [Google Scholar]</ref><ref>Hutchinson N.A., Koles Z.J., Smith R.S. Conduction velocity in myelinated nerve fibres of ''Xenopus'' ''laevis''. J. Physiol. 1970;208:279–289. doi: 10.1113/jphysiol.1970.sp009119. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>Koles Z.J., Rasminsky M. A computer simulation of conduction in demyelinated nerve fibres. J. Physiol. 1972;227:351–364. doi: 10.1113/jphysiol.1972.sp010036. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>Hardy W.L. Propagation speed in myelinated nerve. II. Theoretical dependence on external Na and on temperature. Biophys. J. 1973;13:1071–1089. doi: 10.1016/S0006-3495(73)86046-1. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>Schauf C.L., Davis F.A. Impulse conduction in multiple sclerosis: A theoretical basis for modification by temperature and pharmacological agents. J. Neurol. Neurosurg. Psychiatry. 1974;37:152–161. doi: 10.1136/jnnp.37.2.152.[PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>Brill M.H., Waxman S.G., Moore J.W., Joyner R.W. Conduction velocity and spike configuration in myelinated fibres: Computed dependence on internode distance. J. Neurol. Neurosurg. Psychiatry. 1977;40:769–774. doi: 10.1136/jnnp.40.8.769. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>Waxman S.G., Brill M.H. Conduction through demyelinated plaques in multiple sclerosis: Computer simulations of facilitation by short internodes. J. Neurol. Neurosurg. Psychiatry. 1978;41:408–416. doi: 10.1136/jnnp.41.5.408.[PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>Wood S.L., Waxman S.G., Kocsis J.D. Conduction of trans of impulses in uniform myelinated fibers: Computed dependence on stimulus frequency. Neuroscience. 1982;7:423–430. doi: 10.1016/0306-4522(82)90276-7. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Goldfinger M.D. Computation of high safety factor impulse propagation at axonal branch points. Neuroreport. 2000;11:449–456. doi: 10.1097/00001756-200002280-00005. [PubMed] [CrossRef] [Google Scholar]</ref>Le modèle à câble unique, décrivant l'axone et toutes ses propriétés de conductance et de capacité dans une équation de câble, a dominé le domaine jusqu'à nos jours malgré l'introduction de modèles à double câble par Blight.<ref name=":14">Blight A.R. Computer simulation of action potentials and afterpotentials in mammalian myelinated axons: The case for a lower resistance myelin sheath. Neuroscience. 1985;15:13–31. doi: 10.1016/0306-4522(85)90119-8. [PubMed] [CrossRef] [Google Scholar]</ref> Dans les modèles à double câble, l'axolemme internodal et la gaine de myéline sont représentés indépendamment. Le modèle à double câble a été élargi par Halter et Clark<ref name=":15">Halter J.A., Clark J.W., Jr. A distributed-parameter model of the myelinated nerve fiber. J. Theor. Biol. 1991;148:345–382. doi: 10.1016/S0022-5193(05)80242-5. [PubMed] [CrossRef] [Google Scholar]</ref>explorer les effets de la géométrie complexe des oligodendrocytes du SNC (ou cellules de Schwann dans le cas du SNP). | |||
Les modèles plus récents ont également amélioré les simplifications précédentes, y compris la complexité anatomique du nœud de Ranvier, la distribution des canaux ioniques dans l'axone sous la gaine de myéline, les différentes propriétés électriques de la gaine de myéline et de l'axolemme, et l'accommodation d'un éventuel flux de courant dans l'espace périaxonal.<ref name=":15" /><ref>Schwarz J.R., Eikhof G. Na currents and action potentials in rat myelinated nerve fibres at 20 and 37 °C. Pflugers Arch. 1987;409:569–577. doi: 10.1007/BF00584655. [PubMed] [CrossRef] [Google Scholar]</ref><ref name=":16">Stephanova D.I. Myelin as longitudinal conductor: A multi-layered model of the myelinated human motor nerve fibre. Biol. Cybern. 2001;84:301–308. doi: 10.1007/s004220000213. [PubMed] [CrossRef] [Google Scholar]</ref><ref name=":17">McIntyre C.C., Richardson A.G., Grill W.M. Modeling the excitability of mammalian nerve fibers: Influence of afterpotentials on the recovery cycle. J. Neurophysiol. 2002;87:995–1006. [PubMed] [Google Scholar]</ref><ref name=":18">Einziger P.D., Livshitz L.M., Mizrahi J. Generalized cable equation model for myelinated nerve fiber. IEEE Trans. Biomed. Eng. 2005;52:1632–1642. doi: 10.1109/TBME.2005.856031. [PubMed] [CrossRef] [Google Scholar]</ref> Les représentations anatomiques de la zone paranodale ont permis une évaluation plus détaillée des effets des lésions cérébrales traumatiques (TCC) sur les axones myélinisés.<ref>Volman V., Ng L. Primary paranode demyelination modulates slowly developing axonal depolarization in a model of axonal injury. J. Neural Comput. 2014;37:439–457. [PubMed] [Google Scholar]</ref> L'un des modèles les plus sophistiqués sur le plan anatomique comprend la représentation de la structure complexe de la gaine aqueuse des lamelles de myéline sous la forme d'une série de lamelles parallèles interconnectées dans un modèle de nerfs moteurs..<ref name=":6" /><ref name=":16" /> | |||
Des modèles plus récents ont également pris en compte la distribution non uniforme des canaux ioniques dans l'axone [19, 84, 85, 86, 87, 88, 89, 90].<ref name=":4" /><ref>Stephanova D.I., Bostock H. A Distributed-parameter model of the myelinated human motor nerve fibre: Temporal and spatial distributions of action potentials and ionic currents. Biol. Cybern. 1995;73:275–280. doi: 10.1007/BF00201429. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Chiu S.Y., Ritchie J.M. On the physiological role of internodal potassium channels and the security of conduction in myelinated nerve fibres. Proc. R. Soc. Lond. B Biol. Sci. 1984;220:415–422. doi: 10.1098/rspb.1984.0010.[PubMed] [CrossRef] [Google Scholar]</ref><ref>Brismar T., Schwarz J.R. Potassium permeability in rat myelinated nerve fibres. Acta Physiol. Scand. 1985;124:141–148. doi: 10.1111/j.1748-1716.1985.tb07645.x. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Chiu S.Y., Schwarz W. Sodium and potassium currents in acutely demyelinated internodes of rabbit sciatic nerves. J. Physiol. 1987;391:631–649. doi: 10.1113/jphysiol.1987.sp016760. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>Baker M., Bostock H., Grafe P., Martius P. Function and distribution of three types of rectifying channel in rat spinal root myelinated axons. J. Physiol. 1987;383:45–67. [PMC free article] [PubMed] [Google Scholar</ref><ref>Röper J., Schwarz J.R. Heterogeneous distribution of fast and slow potassium channels in myelinated rat nerve fibres. J. Physiol. 1989;416:93–110. doi: 10.1113/jphysiol.1989.sp017751. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>Bittner S., Meuth S.G. Targeting ion channels for the treatment of autoimmune neuroinflammation. Ther. Adv. Neurol. Disord. 2013;6:322–336. doi: 10.1177/1756285613487782. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> Au-delà des canaux ioniques, les pompes dépendantes de l'énergie et d'autres mécanismes de transport d'ions fournissent des cibles thérapeutiques importantes pour un certain nombre de troubles neurologiques.<ref>Waxman S.G., Ritchie J.M. Molecular dissection of the myelinated axon. Ann. Neurol. 1993;33:121–136. doi: 10.1002/ana.410330202. [PubMed] [CrossRef] [Google Scholar]</ref><ref>Bittner S., Budde T., Wiendl H., Meuth S.G. From the background to the spotlight: TASK channels in pathological conditions. Brain Pathol. 2010;20:999–1009. doi: 10.1111/j.1750-3639.2010.00407.x. [PMC free article][PubMed] [CrossRef] [Google Scholar]</ref><ref>Ehling P., Bittner S., Budde T., Wiendl H., Meuth S.G. Ion channels in autoimmune neurodegeneration. FEBS Lett. 2011;585:3836–3842. doi: 10.1016/j.febslet.2011.03.065. [PubMed] [CrossRef] [Google Scholar]</ref> À cet égard, la régulation des gradients ioniques transmembranaires coûte beaucoup d'énergie et devient elle-même une considération importante (voir ci-dessous).<ref name=":19">Hübel N., Dahlem M.A. Dynamics from seconds to hours in Hodgkin-Huxley model with time-dependent ion concentrations and buffer reservoirs. PLoS Comput. Biol. 2014;10:e1003941. doi: 10.1371/journal.pcbi.1003941.[PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> Cela est d'autant plus vrai que le petit volume d'axones les rend sujets à des changements de concentration d'ions qui peuvent avoir un impact considérable sur les forces motrices et peuvent devenir problématiques dans les modèles qui supposent des concentrations intracellulaires et extracellulaires constantes. Mais des modèles récents ont également traité de tels problèmes (voir ci-dessous). | |||
Tous les modèles susmentionnés se concentrent sur la simulation du changement du potentiel de membrane axonale, mais on n'a pas nécessairement accès expérimental à cette variable, ce qui complique bien sûr les efforts pour comparer les données de simulation et expérimentales. En effet, puisque les enregistrements extracellulaires sont la principale source de données électrophysiologiques de sujets humains, la description mathématique du potentiel de champ extracellulaire est d'un grand intérêt clinique. Des évaluations mathématiques basées sur les équations de Laplace et les transformées de Fourier sont utilisées pour calculer ces potentiels (parfois appelée modélisation ligne-source, par exemple,.<ref name=":18" /><ref>Ganapathy L., Clark J.W. Extracellular currents and potentials of the active myelinated nerve fibre. Biophys. J. 1987;52:749–761. doi: 10.1016/S0006-3495(87)83269-1. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> | |||
==== | ==== Modélisation de mécanismes spécifiques ==== | ||
Au-delà de la modélisation de la fonction axonale normale, les modèles peuvent être utilisés pour explorer des mécanismes particuliers de dysfonctionnement axonal, en particulier lorsqu'ils sont combinés avec des résultats expérimentaux qui pourraient mieux identifier les mécanismes..<ref>Prescott S.A. Pathological changes in peripheral nerve excitability. In: Jaeger D., Jung R., editors. Encyclopedia of Computational Neurosci. 1st ed. Springer-Verlag; New York, NY, USA: 2015. [Google Scholar]</ref> Par exemple, Barrett and Barrett<ref>Barrett E.F., Barrett J.N. Intracellular recording from vertebrate myelinated axons: Mechanism of the depolarizing afterpotential. J. Physiol. 1982;323:117–144. doi: 10.1113/jphysiol.1982.sp014064. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref>ont montré que le postpotentiel dépolarisant (DAP) est sensible aux changements de densités de conductance et aux changements capacitifs qui pourraient se produire pendant la démyélinisation. Un modèle de Blight a été conçu pour simuler ses conditions d'enregistrement expérimentales<ref name=":14" /><ref>Blight A.R., Someya S. Depolarizing afterpotentials in myelinated axons of mammalian spinal cord. Neuroscience. 1985;15:1–12. doi: 10.1016/0306-4522(85)90118-6. [PubMed] [CrossRef] [Google Scholar]</ref>et représente un seul entre-nœud avec de multiples segments discrets et des nœuds et entre-nœuds adjacents dans des segments à paramètres localisés uniques. Ce modèle incluait les canaux K+ dans l'axolemme de l'unique entre-nœud multisegmenté et traitait le reste comme purement passif. | |||
S'appuyant sur ce travail, avec une attention particulière aux détails anatomiques et électrophysiologiques, McIntyre et al.<ref name=":17" /> ont abordé le rôle du DAP et de la post-hyperpolarisation (AHP) dans le cycle de récupération - le schéma distinct de fluctuation de seuil suivant un potentiel d'action unique présenté par les nerfs humains. Les simulations ont suggéré des rôles distincts pour les canaux Na + et K + actifs et passifs dans les deux postpotentiels et ont proposé que les différences dans la forme AP, la relation force-durée et le cycle de récupération des fibres nerveuses motrices et sensorielles puissent être attribuées aux différences cinétiques dans les conductances nodales Na + . Richardson et al.<ref>Richardson A.G., McIntyre C.C., Grill W.M. Modelling the effects of electric fields on nerve fibres: Influence of the myelin sheath. Med. Biol. Eng. Comput. 2000;38:438–446. doi: 10.1007/BF02345014. [PubMed] [CrossRef] [Google Scholar]</ref> ont également constaté que la modification du modèle standard "d'isolant parfait" est nécessaire pour reproduire les DAP lors d'une stimulation à haute fréquence. | |||
La sensibilité à la température des effets de démyélinisation a également été étudiée par ordinateur. Zlochiver<ref>Zlochiver S. Persistent reflection underlies ectopic activity in multiple sclerosis: A numerical study. Biol. Cybern. 2010;102:181–196. doi: 10.1007/s00422-009-0361-2. [PubMed] [CrossRef] [Google Scholar]</ref>modélisé la réflexion résonnante persistante à travers une seule plaque de démyélinisation focale et a constaté que cet effet était sensible à la température et au diamètre de l'axone. Tous ces exemples ont démontré la puissance des simulations pour examiner des mécanismes spécifiques afin d'expliquer les phénomènes observés en clinique et offrir des orientations pour les recherches futures. | |||
Comme mentionné ci-dessus, des changements distincts dans la fonction des axones sont susceptibles de manifester certains symptômes de gain ou de perte de fonction. Si l'on pouvait reproduire ces changements dans un modèle informatique, les changements de paramètres nécessaires pour convertir le modèle entre un fonctionnement normal et anormal pourraient être utilisés pour prédire la pathologie sous-jacente. Idéalement, cela peut conduire à des expériences spécifiques dans lesquelles le canal ionique suspect, par exemple, est directement manipulé pour voir si son altération aiguë est suffisante pour reproduire ou inverser certains changements pathologiques. Des études récentes du laboratoire Prescott illustrent ce processus.<ref>Ratté S., Zhu Y., Lee K.Y., Prescott S.A. Criticality and degeneracy in injury-induced changes in primary afferent excitability and the implications for neuropathic pain. Elife. 2014;3:e02370. doi: 10.7554/eLife.02370.[PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>Zhu Y., Feng B., Schwartz E.S., Gebhart G.F., Prescott S.A. Novel method to assess axonal excitability using channelrhodopsin-based photoactivation. J. Neurophysiol. 2015;113:2242–2249. doi: 10.1152/jn.00982.2014.[PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref>Le succès de ces études dépendait de techniques avancées, notamment la technique de serrage dynamique, utilisée pour basculer entre les schémas de dopage normaux et anormaux et les outils optogénétiques. L'étape suivante consiste à établir un lien entre les modifications de la fonction axonale et les symptômes de la maladie (ou leurs corrélats comportementaux dans les modèles animaux). | |||
Dans des expériences sur le nerf auditif, Tagoe et ses collègues<ref>Tagoe T., Barker M., Jones A., Allcock N., Hamann M. Auditory nerve perinodal dysmyelination in noise-induced hearing loss. J. Neurosci. 2014;12:2684–2688. doi: 10.1523/JNEUROSCI.3977-13.2014.</ref> ont démontré que la perte auditive liée aux changements morphologiques au niveau des paranodes et des juxtaparanodes, y compris l'allongement du nerf auditif autour des nœuds de Ranvier, peut résulter de l'exposition au bruit sonore. En prolongeant ce travail, Hamann et ses collègues ont construit un modèle informatique pour examiner les mécanismes possibles. Leur modèle suggère qu'il est plus probable qu'une diminution de la densité des canaux Na, plutôt qu'une redistribution des canaux Na ou K en général, soit responsable de l'inhibition de la conduction associée à une surexposition acoustique..<ref>Brown A.M., Hamann M. Computational modeling of the effects of auditory nerve dysmyelination. Front. Neuroanat. 2014;8doi: 10.3389/fnana.2014.00073. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref>Ce tandem expérience-modèle démontre le potentiel révélateur de l'association de modèles informatiques et d'expériences en laboratoire. | |||
Avec un modèle multicouche d'axone myélinisé, Stephanova et ses collègues ont réussi à identifier les déficiences anatomiques et physiologiques probables sous-jacentes à divers symptômes et conditions liés à la démyélinisation en effectuant des comparaisons avec les mesures de suivi du seuil des patients, y compris les latences, la réfractaire (l'augmentation du seuil courant pendant la période réfractaire relative), la période réfractaire, la supernormalité et les valeurs seuils d'électrotonus, y compris les mesures stimulus-réponse telles que la relation courant-seuils.<ref name=":5" /> Par exemple, ils ont découvert que la démyélinisation systématique internodale légère (ISD) est un indicateur spécifique de CMT1A. La démyélinisation systématique paranodale légère (PSD) et la démyélinisation systématique paranodale (PISD) sont des indicateurs spécifiques de la CIPD et de ses sous-types. Les démyélinisations focales sévères, internodales et paranodales, paranodales-internodales (IFD et PFD, PIFD) sont des indicateurs spécifiques des neuropathies démyélinisantes acquises telles que GBS et MMN [18] (voir Figure 1). | |||
Les démyélinisations focales légères systématiques et sévères correspondent aux neuropathies héréditaires (CMT1A) et acquises (CIDP, GBS et MMN) (Tableau 1). Il a également été constaté qu'une démyélinisation systématique de 70 % est insuffisante pour provoquer des symptômes et que 96 % est nécessaire pour un bloc de conduction au niveau d'un seul nœud [18]. Ainsi, il existe un grand facteur de sécurité pour la démyélinisation focale. Avec leur version dépendante de la température du modèle de la fibre nerveuse motrice humaine myélinisée, Stephanova et Daskalova<ref>Stephanova D.I., Daskalova M. Electrotonic potentials in simulated chronic inflammatory demyelinating polyneuropathy at 20 °C–42 °C. J. Integr. Neurosci. 2015;27:1–18. doi: 10.1142/S0219635215500119. [PubMed] [CrossRef] [Google Scholar]</ref> ont montré que les potentiels électrotoniques chez les patients atteints de PIDC présentent un risque élevé de blocage pendant l'hypo- et même l'hyperthermie légère et suggèrent des mécanismes impliquant une amplitude accrue des potentiels électrotoniques nodaux polarisants et internodaux dépolarisants, les courants de redressement K + et de fuite K + augmentent avec la température, et le l'accommodation à l'hyperpolarisation de longue durée est plus importante qu'à la dépolarisation. | |||
<center> | <center> | ||
{| class="wikitable" | {| class="wikitable" | ||
| Line 171: | Line 172: | ||
</center> | </center> | ||
==== | ==== Modèles simples et analyse dynamique non linéaire ==== | ||
Compte tenu de la dissociation temporelle entre la manifestation des symptômes et les taux de démyélinisation et de remyélinisation, des processus homéostatiques se produisent sans aucun doute au sein des axones, qui incluent la redistribution des canaux ioniques dans les plaques démyélinisées..<ref>Rasminsky M. Hyperexcitability of pathologically myelinated axons and positive symptoms in multiple sclerosis. Adv. Neurol. 1981;31:289–297.[PubMed] [Google Scholar]</ref><ref>Ulrich J., Groebke-Lorenz W. The optic nerve in multiple sclerosis: A morphological study with retrospective clinicopathological correlation. Neuro-Ophthalmology. 1983;3:149–159. doi: 10.3109/01658108309009732.[CrossRef] [Google Scholar]</ref>Mais étant donné la diversité des canaux ioniques exprimés par différents axones et la connaissance inégale de la façon dont les niveaux d'expression changent, la construction de modèles détaillés pour étudier ces processus homéostatiques est problématique. Surtout dans ces conditions, des modèles hautement simplifiés peuvent aider à identifier les principes fondamentaux, comme en témoigne l'utilisation conjointe des modèles HH et Morris-Lecar modifiés [57,58]. Les résultats de ces études ont suggéré une explication simple de l'ampleur des symptômes rencontrés lors de la démyélinisation en révélant que le rapport entre la conductance de Na+ et celle de K+ de fuite, g(Na)/g(L), agissait comme un interrupteur à quatre voies contrôlant les schémas d'excitabilité qui inclus l'échec de la propagation AP, la propagation AP normale, l'AD et le pic spontané. | |||
D'autres études avec ce modèle ont suggéré le potentiel de compétition ou de coopération entre différentes régions du même neurone.<ref name=":11" /> La coopérativité entre les sites distants de pointes ectopiques permet à la MA d'être initiée et maintenue à différents endroits au sein d'un même axone, fournissant ainsi une explication convaincante des discontinuités temporelles et spatiales de la douleur et d'autres symptômes présentés par les patients atteints de SEP. Remarquablement, dans une étude récente sur les axones démyélinisés dans un modèle de souris cuprizone, des preuves expérimentales ont été observées pour une redistribution des canaux ioniques à partir du nœud de Ranvier, une excitabilité ectopique améliorée ainsi que des AP propagés de manière antidromique à partir de la plaque démyélinisée, ainsi qu'un décalage compensatoire. dans l'excitabilité des membranes proximales au soma.<ref>Hamada M.S., Kole M.H. Myelin loss and axonal ion channel adaptations associated with gray matter neuronal hyperexcitability. J. Neurosci. 2015;35:7272–7786. [PMC free article] [PubMed] [Google Scholar]</ref>Toutes ces observations concordent ou sont cohérentes avec les prédictions du modèle informatique de Coggan et ses collègues et impliquent le succès de l'approche informatique pour guider les études en laboratoire. | |||
De plus, ces modèles simplifiés ont permis l'application d'outils mathématiques pour examiner les mécanismes non linéaires par lesquels la DA est initiée et terminée..<ref name=":9" /><ref name=":10" /><ref name=":11" /> L'analyse de la bifurcation a révélé la bistabilité sous-jacente de l'excitabilité des axones dans des conditions pathologiques, ainsi que les facteurs contrôlant la transition d'un état d'attracteur à un autre. La MA, par exemple, nécessite un courant entrant lent qui permet deux états d'attracteur stables, l'un correspondant à la quiescence et l'autre à des pointes répétitives (un cycle limite). La fin de la MA a été expliquée par la destruction de l'attracteur associé aux pics répétitifs. Cela s'est produit lorsque la rétroaction négative ultra-lente sous la forme d'une accumulation intracellulaire de Na + a provoqué la destruction de l'état de l'attracteur à cycle limite [58]. D'autres études utilisant l'analyse de bifurcation suggèrent que les changements de concentration d'ions peuvent introduire une dynamique lente qui peut être importante pour comprendre les résultats pathologiques [94, 109].<ref name=":19" /><ref>Yu N., Morris C.E., Joós B., Longtin A. Spontaneous excitation patterns computed for axons with injury-like impairments of sodium channels and Na/K pumps. PLoS Comput. Biol. 2012;8:e1002664. doi: 10.1371/journal.pcbi.1002664. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> | |||
==== | ==== Modélisation à petite échelle ==== | ||
Les études mentionnées ci-dessus mettent en évidence l'importance des changements de concentration d'ions, mais chacune d'entre elles n'a considéré ces changements qu'à une échelle relativement importante. Par comparaison, l'étude de Lorpreore et al.<ref>Lopreore C.L., Bartol T.M., Coggan J.S., Keller D.X., Sosinsky G.E., Ellisman M.H., Sejnowski T.J. Computational modeling of three-dimensional electrodiffusion in biological systems: Application to the node of Ranvier. Biophys. J. 2008;95:2624–2635. doi: 10.1529/biophysj.108.132167.</ref> ont abordé le redoutable problème de la modélisation de l'électrodiffusion tridimensionnelle des flux ioniques dans les micro et nano-domaines entourant les canaux ioniques au nœud de Ranvier. Dans ce modèle unique, les flux d'ions sont calculés par les équations de Poisson-Nernst-Planck avec des techniques de volumes finis. Les flux et potentiels électriques ont été évalués au sein de voxels formés par un maillage de Delaunay-Voronoi de l'intérieur et de l'extérieur des axones proches de la membrane. Il est important de noter que l'algorithme a été validé et que les résultats ont été en accord avec les prédictions du modèle de câble. La divergence par rapport aux prédictions du modèle de câble à des tailles de cluster plus petites a révélé l'importance du champ électrique propre à chaque canal. | |||
L'exemple ci-dessus met en évidence le fait que les modèles peuvent simuler plus que les canaux ioniques et le potentiel de membrane. En effet, les modèles peuvent et doivent approfondir les mécanismes biophysiques tels que l'électrodiffusion et les voies de signalisation qui servent finalement à réguler la fonction et l'expression des canaux ioniques. Une méthode prometteuse appelée théorie des systèmes biochimiques (BST) pourrait être utile à l'avenir pour présélectionner les effets des médicaments au niveau systémique. Broome et Coleman<ref>Broome T.M., Cole.man R.A. A mathematical model of cell death in multiple sclerosis. J. Neurosci. Methods. 2011;201:420–425. doi: 10.1016/j.jneumeth.2011.08.008. [PubMed] [CrossRef] [Google Scholar]</ref> ont démontré la puissance de cette technique en modélisant plusieurs voies biochimiques dans les neurones associées à la mort cellulaire au cours de la SEP, notamment la formation d'espèces réactives de l'oxygène et de l'azote, la dynamique du Ca2+, la formation du complexe de mort, la libération du facteur apoptotique et les réponses inflammatoires avec trois états différents : normal, SEP maladie et traitement. Au niveau atomique, un modèle informatique de la structure de la protéine basique de la myéline (MBP) a été réalisé car les modifications post-traductionnelles de la MBP peuvent contribuer à la démyélinisation dans la SEP..<ref>Ridsdale R.A., Beniac D.R., Tompkins T.A., Moscarello M.A., Harauz G. Three-dimensional structure of myelin basic protein. II. Molecular modeling and considerations of predicted structures in multiple sclerosis. J. Biol. Chem. 1997;272:4269–4275. doi: 10.1074/jbc.272.7.4269. [PubMed] [CrossRef] [Google Scholar]</ref> Il est important de comprendre sa structure 3D pour prédire les sites d'interaction avec d'autres molécules, mais la structure cristalline de cette protéine pourrait ne jamais être mesurée directement. Ce type de modélisation peut donc représenter un moyen efficace de prédire la structure en combinant la connaissance de la séquence d'acides aminés avec des informations provenant de protéines similaires. Le défi et le véritable pouvoir de la modélisation résident dans la connexion de mécanismes qui fonctionnent à des échelles très différentes, de la structure moléculaire au système nerveux dans son ensemble, et au-delà, pour déterminer comment le système nerveux interagit avec le système immunitaire. | |||
Modèles de facteurs immunitaires. Bien qu'il existe de nombreux modèles informatiques du système immunitaire,<ref>Pigozzo A.B., Macedo G.C., Santos R.W., Lobosco M. On the computational modeling of the innate immune system. BMC Bioinform. 2013;14 doi: 10.1186/1471-2105-14-S6-S7. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref> ceux liés à la SEP modélisent généralement des réseaux d'interactions génétiques, représentés soit par des ensembles d'équations différentielles ordinaires (ODE), soit par des réseaux booléens. Un modèle de biologie des systèmes d'un mécanisme cellulaire possible de RRMS a révélé une rupture de l'homéostasie des cellules effectrices (Teff) et T régulatrices (Treg).<ref>Doerck S., Göbel K., Weise G., Schneider-Hohendorf T., Reinhardt M., Hauff P., Schwab N., Linker R., Mäurer M., Meuth S.G., et al. Temporal pattern of ICAM-I mediated regulatory T cell recruitment to sites of inflammation in adoptive transfer model of multiple sclerosis. PLoS ONE. 2010;5:e15478. doi: 10.1371/journal.pone.0015478. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref><ref>De Mendizábal N.V., Carneiro J., Solé R.V., Goñi J., Bragard J., Martinez-Forero I., Martinez-Pasamar S., Sepulcre J., Torrealdea J., Bagnato F., et al. Modeling the effector-regulatory T cell cross-regulation reveals the intrinsic character of relapses in Multiple Sclerosis. BMC Syst. Biol. 2011;5doi: 10.1186/1752-0509-5-114. [PMC free article] [PubMed] [CrossRef] [Google Scholar]</ref>En modifiant les paramètres de la boucle de rétroaction Teff-Treg, sous un stimulus externe stochastique continu des antigènes, le modèle a reproduit des rechutes immunitaires spontanées et apparemment stochastiques. Les dommages irréversibles de chaque épisode s'accumulent au fil du temps. Les nouvelles prédictions incluent la suggestion que le moment de l'immunothérapie Treg dans le cycle de réponse immunitaire est essentiel pour déterminer si l'intervention est bénéfique ou délétère. | |||
Modèles de dysfonctionnement mitochondrial. Comme mentionné ci-dessus, la myéline permet une conduction AP plus économe en énergie le long de l'axone. Les demandes énergétiques accrues placées sur l'axone démyélinisé représentent encore un autre défi pour le neurone affligé. Au-delà de la perte de conduction saltatoire, il existe de plus en plus de preuves du rôle critique des astrocytes et des oligodendrocytes dans la fourniture d'énergie aux neurones et ce processus a également fait l'objet d'une modélisation informatique..<ref>Jolivet R., Coggan J.S., Allaman I., Magistretti P.J. Multi-timescale modeling of activity-dependent metabolic coupling in the neuron-glia-vasculature ensemble. PLoS Comput. Biol. 2015;11:e1004036. doi: 10.1371/journal.pcbi.1004036. [PMC free article] [PubMed] [CrossRef]</ref> | |||
Il existe de nombreuses façons dont la fonction mitochondriale peut mal tourner et les voies compensatoires sont tout aussi compliquées.<ref name=":8" /><ref name=":12" /><ref name=":13" />Par exemple, le dysfonctionnement mitochondrial peut être enraciné dans la signalisation Ca2+ perturbée dans les mitochondries, les gradients de protons ou la chaîne électronique perturbés, le déséquilibre réduction-oxydation ainsi que les conséquences de la disponibilité réduite de l'ATP, localement et globalement. Des modèles multi-échelles du cœur, par exemple, ont été utilisés pour lier la signalisation mitochondriale altérée du Ca2+ à l'arythmie [60]. En utilisant la modélisation du réseau mitochondrial, cette étude a démontré comment même un peu trop d'espèces réactives de l'oxygène peut déclencher un effondrement à l'échelle cellulaire du potentiel de la membrane mitochondriale. C'est un excellent exemple de la façon dont un modèle informatique peut relier des processus se produisant à différents niveaux, et ce sont précisément ces liens qui doivent être établis dans le domaine des maladies de démyélinisation. | |||
=== | === Liens manquants et besoin d'intégration === | ||
Dans le domaine des maladies démyélinisantes, les efforts de modélisation se sont traditionnellement concentrés sur des modèles d'axones visant à expliquer divers aspects de l'excitabilité. Mais comme indiqué ci-dessus, ces modèles ont subi une évolution considérable en termes de complexité. Dans le processus, des modèles à différentes échelles biologiques ont commencé à fusionner. Par exemple, les modèles ont maintenant commencé à aborder la régulation des concentrations d'ions et leurs conséquences sur les changements lents d'excitabilité, la consommation d'énergie et la toxicité. Une approche informatique sera nécessaire pour intégrer les étiologies parallèles et multifactorielles associées au déclin cognitif telles que la signalisation du système immunitaire, le métabolisme énergétique, les interactions entre la matière grise et la matière blanche et les réseaux génétiques [117].<ref>Zeis T., Allaman I., Gentner M., Schroder K., Tschopp J., Magistretti P.J., Schaeren-Wiemers N. Metabolic gene expression changes in astrocytes in Multiple Sclerosis cerebral cortex are indicative of immune-mediated signaling. Brain Behav. Immun. 2015;48:315–325. doi: 10.1016/j.bbi.2015.04.013.[PubMed] [CrossRef] [Google Scholar]</ref> Ces efforts continus commencent à découvrir les vastes boucles de rétroaction interconnectées qui fonctionnent sur une large gamme d'échelles spatiales et temporelles. Cela dit, ces efforts en sont encore à leurs balbutiements et de grandes lacunes subsistent dans la modélisation des maladies démyélinisantes. Il est plus facile de décrire ce qui a été modélisé que ce qui ne l'a pas été. Un modèle véritablement intégré impliquant plusieurs types de cellules qui aborde tous les facteurs étiologiques hypothétiques reste non réalisé. Parmi les cibles inexplorées ou sous-explorées mais potentiellement utiles pour la modélisation figurent la pathologie de la matière grise, les couches aqueuses de la gaine de myéline, le métabolisme énergétique et peut-être le plus important, la modélisation multi-échelle ou intégrée. Il faut reconnaître que les outils nécessaires existent dans d'autres domaines d'étude et peuvent donc être facilement appliqués à l'étude des maladies de démyélinisation. | |||
=== | === conclusion === | ||
La fonction physiologique normale du SNC ou du SNP repose sur une interaction hautement régulée des neurones, de la glie, du système vasculaire et des cellules immunitaires. Ce processus englobe et intègre de nombreux composants cellulaires et de signalisation qui produisent un ensemble dynamique et informatique. Lorsqu'une partie tourne mal, l'ensemble du système est obligé de compenser. Même lorsque la compensation parvient à sauver les conséquences les plus évidentes de la démyélinisation, certains processus peuvent ne pas revenir à un état complètement normal, ce qui peut entraîner des problèmes sur des échelles de temps plus longues. Les symptômes qui en résultent sont un mélange déroutant de changements directs et compensatoires qui évoluent continuellement. La complexité globale s'est avérée insoluble pour une dissection expérimentale efficace. L'application de techniques de modélisation informatique représente une approche inestimable pour aider à sortir de l'impasse et engendrer une nouvelle ère de compréhension et de découverte. | |||
== | == Remerciements == | ||
Soutien fourni par la Bourse de nouveau chercheur des Instituts de recherche en santé du Canada et la Bourse de nouveau chercheur de l'Ontario (SAP). Nous remercions Heiki Blum pour son aide à la préparation de la figure. | |||
== | == Contributions d'auteur == | ||
Tous les auteurs ont contribué à la rédaction de ce manuscrit. Les chiffres ont été fournis par Sven G. Meuth. | |||
== | == Les conflits d'intérêts == | ||
Les auteurs ne déclarent aucun conflit d'intérêt. | |||
== | == Informations sur l'article == | ||
Int J Mol Sci. 2015 Sep; 16(9): 21215–21236. | Int J Mol Sci. 2015 Sep; 16(9): 21215–21236. | ||
Published online 2015 Sep 7. doi: 10.3390/ijms160921215 | Published online 2015 Sep 7. doi: 10.3390/ijms160921215 | ||
| Line 215: | Line 216: | ||
3Neurosciences and Mental Health, the Hospital for Sick Children, Toronto, ON M5G 1X8, Canada; E-Mail: ac.sdikkcis@ttocserp.evets | 3Neurosciences and Mental Health, the Hospital for Sick Children, Toronto, ON M5G 1X8, Canada; E-Mail: ac.sdikkcis@ttocserp.evets | ||
4Department of Physiology and the Institute of Biomaterials and Biomedical Engineering, University of Toronto, Toronto, ON M5G 1X8, Canada | 4Department of Physiology and the Institute of Biomaterials and Biomedical Engineering, University of Toronto, Toronto, ON M5G 1X8, Canada | ||
* | *Auteur à qui la correspondance doit être adressée; E-Mail: gro.xniloruen@yaj; Tel.: +1-858-243-6720. | ||
Received 2015 May 26; Accepted 2015 Aug 25. | Received 2015 May 26; Accepted 2015 Aug 25. | ||
Copyright © 2015 by the authors; licensee MDPI, Basel, Switzerland. | Copyright © 2015 by the authors; licensee MDPI, Basel, Switzerland. | ||
Latest revision as of 17:37, 3 May 2023
| Title | Dynamique physiologique dans les maladies démyélinisantes : démêler les relations complexes grâce à la modélisation informatique |
| Authors | Jay S. Coggan · Stefan Bittner · Klaus M. Stiefel · Sven G. Meuth · Steven A. Prescott |
| Source | Document |
| Date | 2021 |
| Journal | Int J Mol Sci. |
| DOI | 10.3390/ijms160921215 |
| PUBMED | https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4613250/#!po=53.5714 |
| PDF copy | |
| License | CC BY |
| This resource has been identified as a Free Scientific Resource, this is why Masticationpedia presents it here as a mean of gratitude toward the Authors, with appreciation for their choice of releasing it open to anyone's access | |
This is free scientific content. It has been released with a free license, this is why we can present it here now, for your convenience. Free knowledge, free access to scientific knowledge is a right of yours; it helps Science to grow, it helps you to have access to Science
This content was relased with a 'CC BY' license.
You might perhaps wish to thank the Author/s
Dynamique physiologique dans les maladies démyélinisantes : démêler les relations complexes grâce à la modélisation informatique
Free resource by Jay S. Coggan · Stefan Bittner · Klaus M. Stiefel · Sven G. Meuth · Steven A. Prescott
|
Physiological Dynamics in Demyelinating Diseases: Unraveling Complex Relationships through Computer Modeling
Jay S. Coggan, Stefan Bittner, [...], and Steven A. Prescott
Additional article information
Abstrait
Malgré des recherches intenses, peu de traitements sont disponibles pour la plupart des troubles neurologiques. Les maladies démyélinisantes ne font pas exception. Ce n'est peut-être pas surprenant compte tenu de la nature multifactorielle de ces maladies, qui impliquent des interactions complexes entre les cellules du système immunitaire, la glie et les neurones. Dans le cas de la sclérose en plaques, par exemple, il n'y a pas d'unanimité parmi les chercheurs sur la cause ou même sur le système ou le type de cellule qui pourrait être le point zéro. Cette situation empêche le développement et l'application stratégique de thérapies basées sur les mécanismes. Nous discuterons de la manière dont la modélisation computationnelle appliquée à des questions à différents niveaux biologiques peut aider à relier des observations disparates et à déchiffrer des mécanismes complexes dont les solutions ne se prêtent pas au simple réductionnisme. En faisant des prédictions vérifiables et en révélant des lacunes critiques dans les connaissances existantes, ces modèles peuvent aider à orienter la recherche et fourniront un cadre rigoureux dans lequel intégrer de nouvelles données au fur et à mesure de leur collecte. De nos jours, les données ne manquent pas ; le défi est de donner un sens à tout cela. À cet égard, la modélisation informatique est un outil inestimable qui pourrait, à terme, transformer la façon dont nous comprenons, diagnostiquons et traitons les maladies démyélinisantes.
Mots-clés : myéline, démyélinisation, sclérose en plaques, maladie neurodégénérative, modèle informatique, découverte de médicaments
Introduction
Les systèmes nerveux des vertébrés sont souvent divisés en matière grise et blanche en fonction de leur apparence et des rôles fonctionnels correspondants. Alors que la matière grise se compose en grande partie de corps cellulaires et de dendrites, la matière blanche contient principalement des axones et tire son nom des feuilles de membrane lipidique appelées myéline qui sont étroitement enroulées autour de ces axones..[1] La myéline provient de différentes classes de cellules gliales appelées oligodendrocytes dans le système nerveux central (SNC) et cellules de Schwann dans le système nerveux périphérique (SNP).
L'isolation électrique fournie par les feuilles de myéline améliore la fonction axonale en augmentant à la fois l'efficacité énergétique et la vitesse de conduction des potentiels d'action (PA). Ces deux fonctions peuvent avoir changé d'importance relative au cours de l'évolution.[2] La myéline est apparue pour la première fois à l'Ordovicien (485 à 443 ma, soit des millions d'années avant le présent) après la scission des ancêtres de la lamproie et de la myxine du reste des lignées de vertébrés.[3] Avec quelques exceptions intéressantes,[4][5]la myéline ou des structures analogues se trouvent chez tous les vertébrés et sont essentielles au bon fonctionnement de leur système nerveux. Le temps approximatif de l'évolution de la myéline peut être déduit du temps connu de divergence entre les accords sans (agnatha) et avec (tous les autres vertébrés) myéline.
L'enveloppe de myéline est interrompue par des tronçons non myélinisés régulièrement espacés connus sous le nom de nœuds de Ranvier. La myéline accélère la conduction en limitant le flux de charge transmembranaire à travers les canaux ioniques situés dans les nœuds. Dans les soi-disant entre-nœuds, le courant circule le long de l'axone avec peu de passage à travers la membrane cellulaire isolée. Le PA est régénéré à chaque nœud où la densité des canaux sodiques et potassiques voltage-dépendants est très élevée. Ce processus est appelé "conduction saltatoire" car le point d'accès semble sauter d'un nœud à l'autre. Les perturbations de ce système de communication rapide peuvent être associées à un éventail de dysfonctionnements du système nerveux.[6]
À plusieurs égards, les axones semblent fonctionner à des limites physiques. Un exemple intéressant est que la taille des axones semble être contrainte par le bruit thermique intrinsèque aux protéines des canaux ioniques ; tout axone plus fin que 0,1 μm serait inutile pour le transfert d'informations en raison de ses niveaux de bruit élevés.[7] Curieusement, 0,1 μm est également à peu près le plus petit diamètre d'axone observé dans les systèmes nerveux [7]. Ceci et des découvertes similaires suggèrent que les axones et leurs sous-structures sont des dispositifs biologiques finement réglés, mais que le réglage peut évidemment être perturbé dans des conditions pathologiques..[8]
La démyélinisation met en mouvement des changements fonctionnels qui sont importants pour les caractéristiques cliniques mais qui ne sont pas facilement expliqués par des changements immunologiques ou radiologiques. L'emplacement d'une plaque prédit quel système sera affecté (moteur vs sensoriel, visuel vs tactile) mais pas comment il sera affecté. Cela met en évidence l'importance d'évaluer la fonction (en plus de la structure) et comment elle change après la démyélinisation. Après avoir présenté les maladies démyélinisantes, nous discuterons de la manière dont les manifestations cliniques de ces maladies reflètent divers changements pathologiques dans la fonction des axones. Nous soutiendrons que comprendre ces changements et tirer pleinement parti de cette compréhension à des fins diagnostiques et thérapeutiques peut bénéficier énormément de la modélisation informatique.
Maladies démyélinisantes
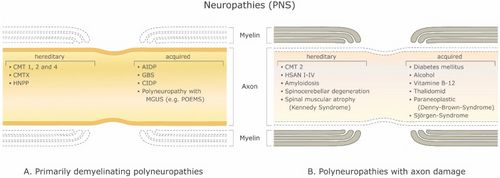
Il existe un grand nombre de maladies démyélinisantes affectant à la fois le SNP (Figure 1) et le SNC (Figure 2). Les étiologies sont hétérogènes, allant des troubles génétiques aux mécanismes métaboliques, infectieux ou auto-immuns. La sclérose en plaques (SEP) est la plus répandue de ces maladies, avec environ 3 millions de patients dans le monde. Sa cause sous-jacente est incertaine, mais on pense qu'elle implique une prédisposition génétique aux agents environnementaux[9][10]et peut impliquer des composants immunologiques, de réactivité aux traumatismes, biophysiques, génétiques et/ou métaboliques.[10] Les symptômes et les lésions doivent être multiples dans le temps et dans l'espace. Autrement dit, il doit y avoir plusieurs épisodes dans le temps, impliquant des parties déconnectées du système nerveux central. Il n'est pas clair si la démyélinisation inflammatoire est un événement primaire ou secondaire dans le processus de la maladie.[9][11][12]La plupart des traitements ciblent le système immunitaire ou la barrière hémato-encéphalique, mais la gestion des symptômes neurologiques par la modulation de l'excitabilité axonale joue également un rôle important (voir ci-dessous).
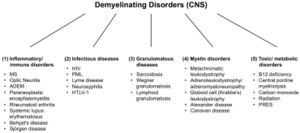
Évaluation clinique de la sclérose en plaques
Les symptômes sont divers et peuvent survenir dans toutes les combinaisons au sein d'un même patient. Le diagnostic exige qu'il y ait plusieurs lésions et épisodes symptomatiques au fil du temps, impliquant des parties déconnectées du SNC. De plus, les symptômes ont tendance à être peu corrélés aux mesures radiologiques. Dans la grande majorité des cas, les caractéristiques cliniques individuelles ne sont pas bien corrélées avec les résultats de l'IRM, en particulier pour les lésions cérébrales.[13][14][15]Cette dissociation clinico-radiologique demande une meilleure compréhension théorique des symptômes de démyélinisation et des changements biophysiques sous-jacents qui les accompagnent, ce qui soulève bien sûr la question de ce qu'il advient exactement des axones affectés.
Les symptômes sont souvent intermittents et peuvent inclure à la fois une perte de fonction (symptômes négatifs tels qu'engourdissement, faiblesse musculaire, picotements, cécité, incontinence, perte de la fonction sexuelle, perte d'équilibre, troubles de l'élocution, constipation, fatigue invalidante, dépression, dysfonctionnement cognitif , incapacité à avaler, perturbation de la marche et perte de contrôle de la respiration) et gain de fonction (symptômes positifs tels que spasmes, spasticité, crampes, douleur, vision floue ou double, urgence ou hésitation urinaire, nausées, entre autres).[16]Les critères diagnostiques différentiels précoces incluent le signe de Lhermitte (sensations liées à la flexion du cou) et le phénomène d'Uhthoff (aggravation des symptômes liée à la température). Le diagnostic différentiel de la SEP suit de près les critères de McDonald.[17]
Dans les études diagnostiques humaines des potentiels évoqués visuels, sensoriels ou moteurs (VEP, SEP, MEP), seule la latence ou la vitesse de conduction peut être mesurée avec précision (avec des variations d'environ 30 % à 40 % entre les différents laboratoires). Mais ces mesures donnent peu d'indices sur les mécanismes sous-jacents qui impliquent un ralentissement ou un blocage de la conduction, ou des facteurs morphologiques ou fonctionnels tels que la ramification, la démyélinisation, la remyélinisation, l'effilement axonal (diminution de la section transversale), l'atténuation ou la repousse, les changements de conduction liés à la température. , ou malpolarisation (hyper ou hypo). Néanmoins, le type de lésion démyélinisante peut fournir des indices sur l'étiologie et donc orienter le traitement ; par exemple, les facteurs génétiques semblent être plus fortement corrélés aux processus pathologiques internodaux et les dysfonctionnements immunologiques provoquent des anomalies paranodales.[18]
Un certain nombre de tests sont couramment utilisés pour évaluer la fonction neurale. En électroneurographie, un bref stimulus électrique est appliqué à un nerf périphérique à une position anatomiquement prédéfinie afin de mesurer la latence et l'amplitude du potentiel d'action composé à un autre endroit le long du nerf. Les résultats doivent être interprétés en combinaison avec les résultats cliniques et les tests (par exemple, l'électromyographie) mais, ce qui est important, différentes maladies présentent différents modèles de changements électroneurographiques. Ceci est important non seulement à des fins de diagnostic, mais peut également indiquer des changements pathologiques spécifiques dans la fonction axonale qui pourraient, à leur tour, aider à guider le choix de la thérapie (si la pathobiologie axonale était comprise ; voir ci-dessous). À l'aide d'un suivi de seuil, l'excitabilité a été mesurée chez l'homme pour plusieurs maladies démyélinisantes périphériques, notamment la maladie de Charcot-Marie-Tooth de type 1A (CMT1A), la polyneuropathie démyélinisante inflammatoire chronique (PDIC), le syndrome de Guillain-Barré (SGB) et la neuropathie motrice multifocale (MMN). ).[19][20][21][22][23][24][25] The Le défi réside dans l'interprétation de ces observations. À cette fin, le groupe de Stephanova a simulé des degrés progressivement plus élevés de démyélinisation systématique et focale des fibres motrices pour tenter d'expliquer les changements physiologiques observés.[26][27][28][29][30][31] (voir la section Modélisation ci-dessous).
Implication des corps cellulaires
La progression de la SEP récurrente-rémittente (RRMS) à la SEP progressive secondaire (SPMS) est associée à une plus grande implication de la pathologie de la matière grise, bien que l'implication axonale/de la matière grise puisse déjà être observée dans les premiers stades de la maladie.[32][33][34][35] Les dommages à la matière grise sont considérés comme le mécanisme sous-jacent de la progression de la maladie et de l'invalidité permanente chez les patients atteints de SEP, et sont mesurés par la perte de la fraction parenchymateuse cérébrale ou du volume cérébral par IRM ou cliniquement par la progression sur l'échelle élargie d'état d'invalidité (EDSS).[36]La transition de RRMS à SPMS est inquiétante en raison du manque de traitements pour lutter contre la détérioration physique et cognitive exacerbée à laquelle la plupart des patients SPMS sont confrontés.[9][37]
Traitement
Les principales interventions dans la SEP consistent à moduler la réponse immunitaire avec, par exemple, la méthy-prednisolone, l'interféron bêta, l'acétate de glatiramère ou le fingolimod, ou en empêchant les cellules inflammatoires de traverser la BHE (anticorps monoclonaux, par exemple Tysabri (anti α4-intégrine, Natalizumab )). Très récemment, les deux premiers agents oraux (fumarate et tériflunomide) ainsi que l'anticorps anti-CD52 Natalizumab ont été approuvés pour le traitement de la SEP-RR, qui peuvent être traités avec succès par des thérapies de première ligne comme les interférons, l'acétate de glatiramère ou le fingolimod, ou par thérapeutiques de seconde intention, mais les formes progressives (PPMS, SPMS) représentent encore un besoin biomédical non satisfait.[38]Les antinéoplasiques sont utilisés dans les cas extrêmement avancés ou difficiles.[39]
Les médicaments modificateurs de la maladie sont essentiels pour arrêter ou au moins atténuer le processus de démyélinisation, mais il est également essentiel de gérer les symptômes résultant de la démyélinisation qui s'est déjà produite. La modulation des canaux ioniques est de plus en plus prometteuse avec l'avènement de nouveaux bloqueurs de canaux ioniques comme l'Ampyra (blocage des canaux K).[40][41] Le blocage des canaux potassiques vise à améliorer l'excitabilité des axones. Le problème est que de telles interventions, bien qu'efficaces pour traiter les symptômes négatifs et restaurer la fonction, ont tendance à exacerber les symptômes positifs..[42]À l'inverse, le traitement des symptômes positifs tels que les spasmes avec des antiépileptiques comme la carbamazépine, par exemple, peut exacerber les symptômes négatifs.[43] En fait, le blocage des canaux Na+ réduit non seulement les symptômes positifs, mais peut également être neuroprotecteur (car l'accumulation de Na+ provoque des mécanismes d'échange Na+/Ca2+ pour charger les neurones avec Ca2+, qui est excitotoxique)[44] (Figure 3) mais ces avantages se font au détriment des symptômes négatifs. Par conséquent, et en particulier chez un patient présentant un mélange de symptômes positifs et négatifs, les options de traitement sont limitées.
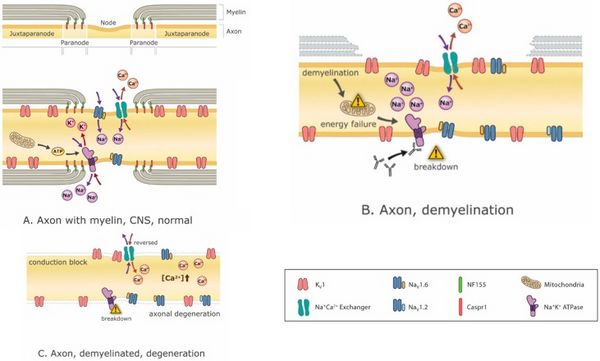
La discussion ci-dessus soulève le point important que bien que beaucoup de bruit ait été fait sur les mécanismes immunitaires, leur lien avec les changements cliniques est largement corrélationnel. Il faut considérer les effets intermédiaires sur la fonction axonale, à savoir les modifications primaires et secondaires (compensatoires) de l'excitabilité axonale, afin d'apprécier comment la fonction neurologique est altérée. Ces changements ne sont pas des conséquences simples et directes de la démyélinisation, mais suggèrent plutôt que la physiologie axonale elle-même change en réponse à la démyélinisation. Certains de ces changements sont adaptatifs tandis que d'autres sont inadaptés, ou peut-être que les changements adaptatifs peuvent devenir inadaptés à mesure que la situation (état de la myélinisation) évolue. Si des changements dans la physiologie axonale dictent la manifestation de divers symptômes, la gestion des symptômes reposera en grande partie sur des traitements visant à manipuler la physiologie axonale. Le développement stratégique de tels traitements nécessite une compréhension approfondie et mécaniste de l'excitabilité axonale et de sa régulation.
Pathobiologie des axones
Changements structurels et moléculaires
Les axones sont profondément affectés par la démyélinisation. La morphologie de l'axone devient irrégulière ou enflée, souvent avec un aspect perlé. Une accumulation focale de protéines (par transport axonal rapide) est également observée. Dans les plaques actives chroniques, une perte axonale de 20 % à 80 % est apparente dans la substance blanche péri-plaque et la substance blanche distante normale.[45] Dans les plaques actives précoces et chroniques actives, on pense que les dommages sont causés par des facteurs inflammatoires et immunitaires libérés lors de la démyélinisation inflammatoire aiguë. Les médiateurs proposés comprennent les protéases, les cytokines, les excitotoxines et les radicaux libres. Les antigènes neuronaux sont les cibles d'une réaction immunitaire conduisant à une inflammation du SNC. D'autres facteurs causant un dysfonctionnement axonal ou la mort comprennent un manque de soutien trophique de la myéline et des oligodendrocytes, des dommages causés par des facteurs immunitaires solubles ou cellulaires encore présents dans la plaque inactive et une défaillance mitochondriale chronique dans le cadre de demandes énergétiques accrues.[46] Un rôle critique des oligodendrocytes et des cellules de Schwann dans la survie des axones a également été attribué aux peroxysomes, au métabolisme des lipides et à la détoxification des espèces réactives de l'oxygène (ROS)..[47]
La remyélinisation est souvent observée sous forme de plaques d'ombre formées par le recrutement de précurseurs d'oligodendrocytes indifférenciés qui migrent vers et entourent les lésions permettant de fines couches de remyélinisation.[48]Ce processus se produit principalement dans les plaques actives aiguës, mais aussi dans les phases chroniques. Cette observation a déclenché le développement d'un nouvel anticorps monoclonal dirigé contre LINGO-1 (Anti-LINGO-1). La liaison de LINGO-1 aux récepteurs Nogo empêche les processus de remyélinisation dans le SNC ; l'inhibition de cette interaction permet ainsi une remyélinisation significative chez les animaux atteints d'encéphalomyélite auto-immune expérimentale.[49]
Au cours du processus de la maladie, les lymphocytes et les macrophages autoréactifs peuvent traverser la barrière hémato-encéphalique et s'accumuler dans le cerveau et la moelle épinière.[50] Les lymphocytes régulateurs (Tregs) ne parviennent pas à supprimer les cellules effectrices, principalement les cellules CD8+ cytotoxiques.[51] La libération de cytokines pro-inflammatoires recrute des microglies naïves, qui entrent en contact avec une unité oligodendrocyte-myéline par des interactions avec les récepteurs Fc et du complément. Un signal cytotoxique déclenchant la mort est ensuite transmis par le facteur de nécrose tumorale α (TNFα) lié à la surface.[52]Cela se produit de concert avec des dommages axonaux importants.[10]
Lucchinetti el al.[46]ont proposé quatre immunopatterns distincts de formation de plaque trouvés chez des patients à différents stades de la maladie. Les plaques de type I et II sont dominées par l'inflammation des lymphocytes T et des macrophages et on pense qu'elles imitent respectivement les modèles d'encéphalomyélite auto-immune à cellules T ou à cellules T plus anticorps. La perte de myéline dans les plaques de type I peut être causée par des facteurs toxiques libérés par les macrophages activés, alors que les dépôts d'IgG et de complément suggèrent un rôle des anticorps dans les plaques de type II. En revanche, les schémas III et IV montrent une grande dystrophie oligodendrocytaire. On pense que le motif III est lié à des lésions induites par l'hypoxie qui sont entraînées par des défauts de la fonction mitochondriale,[53] alors que les lésions de type IV sont associées à une mort profonde non apoptotique des oligodendrocytes dans la substance blanche périplaque.
Barnett and Prineas[54] ont analysé les lésions des patients directement après le début d'une rechute, au cours de laquelle la formation de plaque active était en cours. Leurs résultats suggèrent que l'apoptose des oligodendrocytes et l'activation gliale se produisent au cours de la formation précoce de la plaque active en l'absence de lymphocytes inflammatoires ou de phagocytes de myéline. Ils ont proposé que la vulnérabilité des oligodendrocytes, décrite dans le schéma de type III de Lucchinetti, est présente dans les premiers stades de toute formation de plaque et est le déclencheur de la nécrose post-apoptotique ultérieure qui initie la phagocytose de la myéline par les macrophages à des stades ultérieurs. Les analyses in vitro de ce processus ont impliqué des cascades du complément, des facteurs de nécrose tumorale ou des seconds messagers gazeux.[55] Bien que l'identification des plaques et le suivi de leur progression aient une valeur clinique importante, il n'y a qu'une faible corrélation entre la charge des lésions démyélinisantes telle que déterminée par l'IRM conventionnelle et l'incapacité clinique des patients atteints de SEP (voir ci-dessus).
Changements fonctionnels
Les mécanismes d'altération fonctionnelle lors de la démyélinisation incluent souvent la perturbation des ions transmembranaires Na+, K+ et Ca2+, la dispersion de leurs canaux ioniques correspondants, une diminution de l'efficacité de la conduction AP et une crise métabolique qui en résulte (Figure 3). La démyélinisation peut facilement expliquer l'échec de la conduction dans l'axone affecté. Si la conduction n'échoue pas complètement, la vitesse de conduction peut néanmoins être ralentie et un ralentissement différentiel entre différents axones peut entraîner des retards de conduction variables qui entraînent des pointes désynchronisées.
La démyélinisation permet également aux axones dénudés de devenir étroitement apposés, ouvrant ainsi la voie aux interactions éphaptiques et à la diaphonie.[10] La réflexion peut également se produire en raison d'une inadéquation d'impédance entre les longueurs d'axone myélinisées et non myélinisées. D'autre part, l'hyperexcitabilité ne peut pas être directement attribuée à la démyélinisation ; au lieu de cela, des modifications secondaires de l'excitabilité intrinsèque doivent être invoquées pour expliquer des phénomènes tels que la génération de pics ectopiques et la post-décharge (AD). Les altérations de l'excitabilité représentent probablement des changements compensatoires visant à restaurer la fonction suite à la perturbation causée directement par la démyélinisation, conformément à un processus appelé plasticité homéostatique,[56] mais cette compensation peut évidemment être inadaptée. Chacun des résultats susmentionnés, qui ne sont pas mutuellement exclusifs, contribue à produire différents symptômes observés dans les maladies démyélinisantes.
Les symptômes paroxystiques caractérisés par l'apparition soudaine ou l'intensification de symptômes tels que des spasmes ou des douleurs lancinantes résultent probablement de la MA ou de pointes inappropriées de type éclatement. De tels modèles de pointe suggèrent des interactions hautement non linéaires entre le courant ionique contributeurs[57][58] et pourrait, en théorie du moins, impliquer des interactions entre différentes régions du neurone.[59] Contrairement aux formes plus génériques d'hyperexcitabilité (par exemple, augmentation de la cadence de déclenchement ou réduction du seuil), ces schémas spécifiques sont limités en termes de mécanismes précis par lesquels ils pourraient survenir. Par conséquent, l'identification des changements de canaux ioniques sous-jacents à ces formes spécifiques d'hyperexcitabilité peut aider à limiter la recherche de changements de canaux ioniques responsables de formes d'hyperexcitabilité associées, mais moins distinctives.
La perturbation de l'équilibre énergétique dans un neurone pourrait également avoir un impact profond sur le bien-être des neurones (Figure 3). En effet, des modifications compensatoires peuvent parvenir à restaurer certaines fonctions mais, sans renverser le problème primaire, d'autres problèmes peuvent survenir. Par exemple, même si le blocage de la conduction est empêché par une modification compensatoire appropriée de l'excitabilité (c'est-à-dire une modification qui n'entraîne pas d'hyperexcitabilité), le système peut être moins efficace sur le plan énergétique. La perte des économies d'énergie offertes par la conduction saltatoire induit une production d'énergie mitochondriale compensatoire qui peut entraîner des dommages oxydatifs et une neurodégénérescence.[53][60][61]
Garder une trace de cette longue liste de changements neurobiologiques, comprendre les interrelations entre ces changements et finalement lier ces changements aux manifestations cliniques et appliquer un traitement efficace n'est pas une tâche facile. À cette fin, la modélisation informatique est un outil inestimable. Les simulations ne servent pas seulement à organiser les informations déjà connues, elles identifient également des lacunes cruciales dans les connaissances. L'utilisation judicieuse de la modélisation informatique peut donc permettre une compréhension plus complète et faciliter l'application plus efficace de cette compréhension, comme indiqué ci-dessous.
Modélisation informatique
Surtout lorsqu'elle est associée à des expériences traditionnelles, la modélisation informatique est indispensable pour donner un sens aux données incohérentes et aux mécanismes complexes. Ces avantages sont illustrés par l'application de simulations dans d'autres domaines, tels que l'épilepsie.[62] Ici, nous passons en revue une partie de l'histoire de la modélisation informatique des axones, des conductances ioniques, de la physiologie de la myéline et de la démyélinisation, du système immunitaire, des mitochondries et d'autres facteurs biologiques essentiels à la compréhension des maladies démyélinisantes. Notre examen n'est pas exhaustif mais fournira une large introduction aux efforts passés, présents et futurs dans ce domaine.
Modélisation des axones
La modélisation informatique des axones a évolué sur le plan taxonomique, du calmar aux tissus de mammifères avec une augmentation correspondante de la sophistication. Le modèle de Hodgkin et Huxley (HH), qui a fourni la première explication approfondie de la génération d'AP, a été dérivé d'expériences sur des axones géants non myélinisés de calmar,[63][64]mais ce premier modèle s'est avéré être un outil inestimable à partir duquel des modèles ultérieurs plus sophistiqués d'axones myélinisés ont évolué.
L'hétérogénéité spatiale et biophysique conférée par l'ajout de myéline, et la formation conséquente de nœuds et de régions internodales, représente une augmentation significative de la complexité des axones. Le premier modèle informatique d'un axone myélinisé était un modèle unidimensionnel qui effondrait la gaine de myéline dans l'axolemme passif sous-jacent, utilisait une taille de pas spatial uniforme pour former l'approximation discrète utilisée dans la solution numérique et employait une caractérisation HH de la membrane nodale.[65] Goldman & Albus[66] modifié ce modèle pour inclure une description de la membrane nodale dérivée de données expérimentales sur les fibres nerveuses myélinisées de Xenopus laevis telles que déterminées par Frankenhaeuser & Huxley.[67] Des études ultérieures ont utilisé la même forme de base pour le modèle avec quelques variations pour la représentation de l'axolemme.[15][68][69][70][71][72][73][74][75][76]Le modèle à câble unique, décrivant l'axone et toutes ses propriétés de conductance et de capacité dans une équation de câble, a dominé le domaine jusqu'à nos jours malgré l'introduction de modèles à double câble par Blight.[77] Dans les modèles à double câble, l'axolemme internodal et la gaine de myéline sont représentés indépendamment. Le modèle à double câble a été élargi par Halter et Clark[78]explorer les effets de la géométrie complexe des oligodendrocytes du SNC (ou cellules de Schwann dans le cas du SNP).
Les modèles plus récents ont également amélioré les simplifications précédentes, y compris la complexité anatomique du nœud de Ranvier, la distribution des canaux ioniques dans l'axone sous la gaine de myéline, les différentes propriétés électriques de la gaine de myéline et de l'axolemme, et l'accommodation d'un éventuel flux de courant dans l'espace périaxonal.[78][79][80][81][82] Les représentations anatomiques de la zone paranodale ont permis une évaluation plus détaillée des effets des lésions cérébrales traumatiques (TCC) sur les axones myélinisés.[83] L'un des modèles les plus sophistiqués sur le plan anatomique comprend la représentation de la structure complexe de la gaine aqueuse des lamelles de myéline sous la forme d'une série de lamelles parallèles interconnectées dans un modèle de nerfs moteurs..[30][80]
Des modèles plus récents ont également pris en compte la distribution non uniforme des canaux ioniques dans l'axone [19, 84, 85, 86, 87, 88, 89, 90].[19][84][85][86][87][88][89][90] Au-delà des canaux ioniques, les pompes dépendantes de l'énergie et d'autres mécanismes de transport d'ions fournissent des cibles thérapeutiques importantes pour un certain nombre de troubles neurologiques.[91][92][93] À cet égard, la régulation des gradients ioniques transmembranaires coûte beaucoup d'énergie et devient elle-même une considération importante (voir ci-dessous).[94] Cela est d'autant plus vrai que le petit volume d'axones les rend sujets à des changements de concentration d'ions qui peuvent avoir un impact considérable sur les forces motrices et peuvent devenir problématiques dans les modèles qui supposent des concentrations intracellulaires et extracellulaires constantes. Mais des modèles récents ont également traité de tels problèmes (voir ci-dessous).
Tous les modèles susmentionnés se concentrent sur la simulation du changement du potentiel de membrane axonale, mais on n'a pas nécessairement accès expérimental à cette variable, ce qui complique bien sûr les efforts pour comparer les données de simulation et expérimentales. En effet, puisque les enregistrements extracellulaires sont la principale source de données électrophysiologiques de sujets humains, la description mathématique du potentiel de champ extracellulaire est d'un grand intérêt clinique. Des évaluations mathématiques basées sur les équations de Laplace et les transformées de Fourier sont utilisées pour calculer ces potentiels (parfois appelée modélisation ligne-source, par exemple,.[82][95]
Modélisation de mécanismes spécifiques
Au-delà de la modélisation de la fonction axonale normale, les modèles peuvent être utilisés pour explorer des mécanismes particuliers de dysfonctionnement axonal, en particulier lorsqu'ils sont combinés avec des résultats expérimentaux qui pourraient mieux identifier les mécanismes..[96] Par exemple, Barrett and Barrett[97]ont montré que le postpotentiel dépolarisant (DAP) est sensible aux changements de densités de conductance et aux changements capacitifs qui pourraient se produire pendant la démyélinisation. Un modèle de Blight a été conçu pour simuler ses conditions d'enregistrement expérimentales[77][98]et représente un seul entre-nœud avec de multiples segments discrets et des nœuds et entre-nœuds adjacents dans des segments à paramètres localisés uniques. Ce modèle incluait les canaux K+ dans l'axolemme de l'unique entre-nœud multisegmenté et traitait le reste comme purement passif.
S'appuyant sur ce travail, avec une attention particulière aux détails anatomiques et électrophysiologiques, McIntyre et al.[81] ont abordé le rôle du DAP et de la post-hyperpolarisation (AHP) dans le cycle de récupération - le schéma distinct de fluctuation de seuil suivant un potentiel d'action unique présenté par les nerfs humains. Les simulations ont suggéré des rôles distincts pour les canaux Na + et K + actifs et passifs dans les deux postpotentiels et ont proposé que les différences dans la forme AP, la relation force-durée et le cycle de récupération des fibres nerveuses motrices et sensorielles puissent être attribuées aux différences cinétiques dans les conductances nodales Na + . Richardson et al.[99] ont également constaté que la modification du modèle standard "d'isolant parfait" est nécessaire pour reproduire les DAP lors d'une stimulation à haute fréquence.
La sensibilité à la température des effets de démyélinisation a également été étudiée par ordinateur. Zlochiver[100]modélisé la réflexion résonnante persistante à travers une seule plaque de démyélinisation focale et a constaté que cet effet était sensible à la température et au diamètre de l'axone. Tous ces exemples ont démontré la puissance des simulations pour examiner des mécanismes spécifiques afin d'expliquer les phénomènes observés en clinique et offrir des orientations pour les recherches futures.
Comme mentionné ci-dessus, des changements distincts dans la fonction des axones sont susceptibles de manifester certains symptômes de gain ou de perte de fonction. Si l'on pouvait reproduire ces changements dans un modèle informatique, les changements de paramètres nécessaires pour convertir le modèle entre un fonctionnement normal et anormal pourraient être utilisés pour prédire la pathologie sous-jacente. Idéalement, cela peut conduire à des expériences spécifiques dans lesquelles le canal ionique suspect, par exemple, est directement manipulé pour voir si son altération aiguë est suffisante pour reproduire ou inverser certains changements pathologiques. Des études récentes du laboratoire Prescott illustrent ce processus.[101][102]Le succès de ces études dépendait de techniques avancées, notamment la technique de serrage dynamique, utilisée pour basculer entre les schémas de dopage normaux et anormaux et les outils optogénétiques. L'étape suivante consiste à établir un lien entre les modifications de la fonction axonale et les symptômes de la maladie (ou leurs corrélats comportementaux dans les modèles animaux).
Dans des expériences sur le nerf auditif, Tagoe et ses collègues[103] ont démontré que la perte auditive liée aux changements morphologiques au niveau des paranodes et des juxtaparanodes, y compris l'allongement du nerf auditif autour des nœuds de Ranvier, peut résulter de l'exposition au bruit sonore. En prolongeant ce travail, Hamann et ses collègues ont construit un modèle informatique pour examiner les mécanismes possibles. Leur modèle suggère qu'il est plus probable qu'une diminution de la densité des canaux Na, plutôt qu'une redistribution des canaux Na ou K en général, soit responsable de l'inhibition de la conduction associée à une surexposition acoustique..[104]Ce tandem expérience-modèle démontre le potentiel révélateur de l'association de modèles informatiques et d'expériences en laboratoire.
Avec un modèle multicouche d'axone myélinisé, Stephanova et ses collègues ont réussi à identifier les déficiences anatomiques et physiologiques probables sous-jacentes à divers symptômes et conditions liés à la démyélinisation en effectuant des comparaisons avec les mesures de suivi du seuil des patients, y compris les latences, la réfractaire (l'augmentation du seuil courant pendant la période réfractaire relative), la période réfractaire, la supernormalité et les valeurs seuils d'électrotonus, y compris les mesures stimulus-réponse telles que la relation courant-seuils.[21] Par exemple, ils ont découvert que la démyélinisation systématique internodale légère (ISD) est un indicateur spécifique de CMT1A. La démyélinisation systématique paranodale légère (PSD) et la démyélinisation systématique paranodale (PISD) sont des indicateurs spécifiques de la CIPD et de ses sous-types. Les démyélinisations focales sévères, internodales et paranodales, paranodales-internodales (IFD et PFD, PIFD) sont des indicateurs spécifiques des neuropathies démyélinisantes acquises telles que GBS et MMN [18] (voir Figure 1).
Les démyélinisations focales légères systématiques et sévères correspondent aux neuropathies héréditaires (CMT1A) et acquises (CIDP, GBS et MMN) (Tableau 1). Il a également été constaté qu'une démyélinisation systématique de 70 % est insuffisante pour provoquer des symptômes et que 96 % est nécessaire pour un bloc de conduction au niveau d'un seul nœud [18]. Ainsi, il existe un grand facteur de sécurité pour la démyélinisation focale. Avec leur version dépendante de la température du modèle de la fibre nerveuse motrice humaine myélinisée, Stephanova et Daskalova[105] ont montré que les potentiels électrotoniques chez les patients atteints de PIDC présentent un risque élevé de blocage pendant l'hypo- et même l'hyperthermie légère et suggèrent des mécanismes impliquant une amplitude accrue des potentiels électrotoniques nodaux polarisants et internodaux dépolarisants, les courants de redressement K + et de fuite K + augmentent avec la température, et le l'accommodation à l'hyperpolarisation de longue durée est plus importante qu'à la dépolarisation.
| Table 1
Correspondence between types of demyelination and diseases according to Stephanova and Dimitrov.[18] | |
|---|---|
| Type of Demyelination | Corresponding Disease (PNS) |
| Internodal systematic demyelination (ISD) | Charcot-Marie-Tooth Disease Type 1A (CMT1A) |
| Paranodal systematic demyelination (PSD) | Chronic inflammatory demyelinating polyneuropathy (CIDP) |
| Paranodal + internodal demyelination (PISD) | Chronic inflammatory demyelinating polyneuropathy (CIPD) subtypes |
| Internodal focal demyelination (IFD) | Guillain-Barré (GBS) |
| Paranodal focal demyelination (PFD) | Multifocal Motor Neuropathy (MMN) |
| Paranodal + focal demyelination (PIFD) | Multifocal Motor Neuropathy (MMN) |
Modèles simples et analyse dynamique non linéaire
Compte tenu de la dissociation temporelle entre la manifestation des symptômes et les taux de démyélinisation et de remyélinisation, des processus homéostatiques se produisent sans aucun doute au sein des axones, qui incluent la redistribution des canaux ioniques dans les plaques démyélinisées..[106][107]Mais étant donné la diversité des canaux ioniques exprimés par différents axones et la connaissance inégale de la façon dont les niveaux d'expression changent, la construction de modèles détaillés pour étudier ces processus homéostatiques est problématique. Surtout dans ces conditions, des modèles hautement simplifiés peuvent aider à identifier les principes fondamentaux, comme en témoigne l'utilisation conjointe des modèles HH et Morris-Lecar modifiés [57,58]. Les résultats de ces études ont suggéré une explication simple de l'ampleur des symptômes rencontrés lors de la démyélinisation en révélant que le rapport entre la conductance de Na+ et celle de K+ de fuite, g(Na)/g(L), agissait comme un interrupteur à quatre voies contrôlant les schémas d'excitabilité qui inclus l'échec de la propagation AP, la propagation AP normale, l'AD et le pic spontané.
D'autres études avec ce modèle ont suggéré le potentiel de compétition ou de coopération entre différentes régions du même neurone.[59] La coopérativité entre les sites distants de pointes ectopiques permet à la MA d'être initiée et maintenue à différents endroits au sein d'un même axone, fournissant ainsi une explication convaincante des discontinuités temporelles et spatiales de la douleur et d'autres symptômes présentés par les patients atteints de SEP. Remarquablement, dans une étude récente sur les axones démyélinisés dans un modèle de souris cuprizone, des preuves expérimentales ont été observées pour une redistribution des canaux ioniques à partir du nœud de Ranvier, une excitabilité ectopique améliorée ainsi que des AP propagés de manière antidromique à partir de la plaque démyélinisée, ainsi qu'un décalage compensatoire. dans l'excitabilité des membranes proximales au soma.[108]Toutes ces observations concordent ou sont cohérentes avec les prédictions du modèle informatique de Coggan et ses collègues et impliquent le succès de l'approche informatique pour guider les études en laboratoire.
De plus, ces modèles simplifiés ont permis l'application d'outils mathématiques pour examiner les mécanismes non linéaires par lesquels la DA est initiée et terminée..[57][58][59] L'analyse de la bifurcation a révélé la bistabilité sous-jacente de l'excitabilité des axones dans des conditions pathologiques, ainsi que les facteurs contrôlant la transition d'un état d'attracteur à un autre. La MA, par exemple, nécessite un courant entrant lent qui permet deux états d'attracteur stables, l'un correspondant à la quiescence et l'autre à des pointes répétitives (un cycle limite). La fin de la MA a été expliquée par la destruction de l'attracteur associé aux pics répétitifs. Cela s'est produit lorsque la rétroaction négative ultra-lente sous la forme d'une accumulation intracellulaire de Na + a provoqué la destruction de l'état de l'attracteur à cycle limite [58]. D'autres études utilisant l'analyse de bifurcation suggèrent que les changements de concentration d'ions peuvent introduire une dynamique lente qui peut être importante pour comprendre les résultats pathologiques [94, 109].[94][109]
Modélisation à petite échelle
Les études mentionnées ci-dessus mettent en évidence l'importance des changements de concentration d'ions, mais chacune d'entre elles n'a considéré ces changements qu'à une échelle relativement importante. Par comparaison, l'étude de Lorpreore et al.[110] ont abordé le redoutable problème de la modélisation de l'électrodiffusion tridimensionnelle des flux ioniques dans les micro et nano-domaines entourant les canaux ioniques au nœud de Ranvier. Dans ce modèle unique, les flux d'ions sont calculés par les équations de Poisson-Nernst-Planck avec des techniques de volumes finis. Les flux et potentiels électriques ont été évalués au sein de voxels formés par un maillage de Delaunay-Voronoi de l'intérieur et de l'extérieur des axones proches de la membrane. Il est important de noter que l'algorithme a été validé et que les résultats ont été en accord avec les prédictions du modèle de câble. La divergence par rapport aux prédictions du modèle de câble à des tailles de cluster plus petites a révélé l'importance du champ électrique propre à chaque canal.
L'exemple ci-dessus met en évidence le fait que les modèles peuvent simuler plus que les canaux ioniques et le potentiel de membrane. En effet, les modèles peuvent et doivent approfondir les mécanismes biophysiques tels que l'électrodiffusion et les voies de signalisation qui servent finalement à réguler la fonction et l'expression des canaux ioniques. Une méthode prometteuse appelée théorie des systèmes biochimiques (BST) pourrait être utile à l'avenir pour présélectionner les effets des médicaments au niveau systémique. Broome et Coleman[111] ont démontré la puissance de cette technique en modélisant plusieurs voies biochimiques dans les neurones associées à la mort cellulaire au cours de la SEP, notamment la formation d'espèces réactives de l'oxygène et de l'azote, la dynamique du Ca2+, la formation du complexe de mort, la libération du facteur apoptotique et les réponses inflammatoires avec trois états différents : normal, SEP maladie et traitement. Au niveau atomique, un modèle informatique de la structure de la protéine basique de la myéline (MBP) a été réalisé car les modifications post-traductionnelles de la MBP peuvent contribuer à la démyélinisation dans la SEP..[112] Il est important de comprendre sa structure 3D pour prédire les sites d'interaction avec d'autres molécules, mais la structure cristalline de cette protéine pourrait ne jamais être mesurée directement. Ce type de modélisation peut donc représenter un moyen efficace de prédire la structure en combinant la connaissance de la séquence d'acides aminés avec des informations provenant de protéines similaires. Le défi et le véritable pouvoir de la modélisation résident dans la connexion de mécanismes qui fonctionnent à des échelles très différentes, de la structure moléculaire au système nerveux dans son ensemble, et au-delà, pour déterminer comment le système nerveux interagit avec le système immunitaire.
Modèles de facteurs immunitaires. Bien qu'il existe de nombreux modèles informatiques du système immunitaire,[113] ceux liés à la SEP modélisent généralement des réseaux d'interactions génétiques, représentés soit par des ensembles d'équations différentielles ordinaires (ODE), soit par des réseaux booléens. Un modèle de biologie des systèmes d'un mécanisme cellulaire possible de RRMS a révélé une rupture de l'homéostasie des cellules effectrices (Teff) et T régulatrices (Treg).[114][115]En modifiant les paramètres de la boucle de rétroaction Teff-Treg, sous un stimulus externe stochastique continu des antigènes, le modèle a reproduit des rechutes immunitaires spontanées et apparemment stochastiques. Les dommages irréversibles de chaque épisode s'accumulent au fil du temps. Les nouvelles prédictions incluent la suggestion que le moment de l'immunothérapie Treg dans le cycle de réponse immunitaire est essentiel pour déterminer si l'intervention est bénéfique ou délétère.
Modèles de dysfonctionnement mitochondrial. Comme mentionné ci-dessus, la myéline permet une conduction AP plus économe en énergie le long de l'axone. Les demandes énergétiques accrues placées sur l'axone démyélinisé représentent encore un autre défi pour le neurone affligé. Au-delà de la perte de conduction saltatoire, il existe de plus en plus de preuves du rôle critique des astrocytes et des oligodendrocytes dans la fourniture d'énergie aux neurones et ce processus a également fait l'objet d'une modélisation informatique..[116]
Il existe de nombreuses façons dont la fonction mitochondriale peut mal tourner et les voies compensatoires sont tout aussi compliquées.[53][60][61]Par exemple, le dysfonctionnement mitochondrial peut être enraciné dans la signalisation Ca2+ perturbée dans les mitochondries, les gradients de protons ou la chaîne électronique perturbés, le déséquilibre réduction-oxydation ainsi que les conséquences de la disponibilité réduite de l'ATP, localement et globalement. Des modèles multi-échelles du cœur, par exemple, ont été utilisés pour lier la signalisation mitochondriale altérée du Ca2+ à l'arythmie [60]. En utilisant la modélisation du réseau mitochondrial, cette étude a démontré comment même un peu trop d'espèces réactives de l'oxygène peut déclencher un effondrement à l'échelle cellulaire du potentiel de la membrane mitochondriale. C'est un excellent exemple de la façon dont un modèle informatique peut relier des processus se produisant à différents niveaux, et ce sont précisément ces liens qui doivent être établis dans le domaine des maladies de démyélinisation.
Liens manquants et besoin d'intégration
Dans le domaine des maladies démyélinisantes, les efforts de modélisation se sont traditionnellement concentrés sur des modèles d'axones visant à expliquer divers aspects de l'excitabilité. Mais comme indiqué ci-dessus, ces modèles ont subi une évolution considérable en termes de complexité. Dans le processus, des modèles à différentes échelles biologiques ont commencé à fusionner. Par exemple, les modèles ont maintenant commencé à aborder la régulation des concentrations d'ions et leurs conséquences sur les changements lents d'excitabilité, la consommation d'énergie et la toxicité. Une approche informatique sera nécessaire pour intégrer les étiologies parallèles et multifactorielles associées au déclin cognitif telles que la signalisation du système immunitaire, le métabolisme énergétique, les interactions entre la matière grise et la matière blanche et les réseaux génétiques [117].[117] Ces efforts continus commencent à découvrir les vastes boucles de rétroaction interconnectées qui fonctionnent sur une large gamme d'échelles spatiales et temporelles. Cela dit, ces efforts en sont encore à leurs balbutiements et de grandes lacunes subsistent dans la modélisation des maladies démyélinisantes. Il est plus facile de décrire ce qui a été modélisé que ce qui ne l'a pas été. Un modèle véritablement intégré impliquant plusieurs types de cellules qui aborde tous les facteurs étiologiques hypothétiques reste non réalisé. Parmi les cibles inexplorées ou sous-explorées mais potentiellement utiles pour la modélisation figurent la pathologie de la matière grise, les couches aqueuses de la gaine de myéline, le métabolisme énergétique et peut-être le plus important, la modélisation multi-échelle ou intégrée. Il faut reconnaître que les outils nécessaires existent dans d'autres domaines d'étude et peuvent donc être facilement appliqués à l'étude des maladies de démyélinisation.
conclusion
La fonction physiologique normale du SNC ou du SNP repose sur une interaction hautement régulée des neurones, de la glie, du système vasculaire et des cellules immunitaires. Ce processus englobe et intègre de nombreux composants cellulaires et de signalisation qui produisent un ensemble dynamique et informatique. Lorsqu'une partie tourne mal, l'ensemble du système est obligé de compenser. Même lorsque la compensation parvient à sauver les conséquences les plus évidentes de la démyélinisation, certains processus peuvent ne pas revenir à un état complètement normal, ce qui peut entraîner des problèmes sur des échelles de temps plus longues. Les symptômes qui en résultent sont un mélange déroutant de changements directs et compensatoires qui évoluent continuellement. La complexité globale s'est avérée insoluble pour une dissection expérimentale efficace. L'application de techniques de modélisation informatique représente une approche inestimable pour aider à sortir de l'impasse et engendrer une nouvelle ère de compréhension et de découverte.
Remerciements
Soutien fourni par la Bourse de nouveau chercheur des Instituts de recherche en santé du Canada et la Bourse de nouveau chercheur de l'Ontario (SAP). Nous remercions Heiki Blum pour son aide à la préparation de la figure.
Contributions d'auteur
Tous les auteurs ont contribué à la rédaction de ce manuscrit. Les chiffres ont été fournis par Sven G. Meuth.
Les conflits d'intérêts
Les auteurs ne déclarent aucun conflit d'intérêt.
Informations sur l'article
Int J Mol Sci. 2015 Sep; 16(9): 21215–21236. Published online 2015 Sep 7. doi: 10.3390/ijms160921215 PMCID: PMC4613250 PMID: 26370960 Jay S. Coggan,1,* Stefan Bittner,2 Klaus M. Stiefel,1 Sven G. Meuth,2 and Steven A. Prescott3,4 Christoph Kleinschnitz, Academic Editor 1NeuroLinx Research Institute, La Jolla, CA 92039, USA; E-Mail: gro.xniloruen@sualk 2Department of Neurology, Institute of Physiology, Universitätsklinikum Münster, 48149 Münster, Germany; E-Mails: moc.kooltuo@renttib-nafets (S.B.); ed.retsneumku@htuem.nevs (S.G.M.) 3Neurosciences and Mental Health, the Hospital for Sick Children, Toronto, ON M5G 1X8, Canada; E-Mail: ac.sdikkcis@ttocserp.evets 4Department of Physiology and the Institute of Biomaterials and Biomedical Engineering, University of Toronto, Toronto, ON M5G 1X8, Canada
- Auteur à qui la correspondance doit être adressée; E-Mail: gro.xniloruen@yaj; Tel.: +1-858-243-6720.
Received 2015 May 26; Accepted 2015 Aug 25. Copyright © 2015 by the authors; licensee MDPI, Basel, Switzerland. This article is an open access article distributed under the terms and conditions of the Creative Commons Attribution license (http://creativecommons.org/licenses/by/4.0/). Articles from International Journal of Molecular Sciences are provided here courtesy of Multidisciplinary Digital Publishing Institute (MDPI)
Bibliography
- ↑ Virchow R. Uber das ausgebreitete Vorkommen einer dem Nervenmark analogen Substanz in den tierischen Geweben. Virchows Arch. Pathol. Anat. 1854;6:562–572. doi: 10.1007/BF02116709. [CrossRef] [Google Scholar]
- ↑ Stiefel K.M., Torben-Nielsen B., Coggan J.S. Proposed evolutionary changes in the role of myelin. Front. Neurosci. 2013;8 doi: 10.3389/fnins.2013.00202.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Bullock T.H., Moore J.K., Fields R.D. Evolution of myelin sheaths: Both lamprey and hagfish lack myelin. Neurosci. Lett. 1984;48:145–148. doi: 10.1016/0304-3940(84)90010-7. [PubMed] [CrossRef] [Google Scholar]
- ↑ Davis A.D., Weatherby T.M., Hartline D.K., Lenz P.H. Myelin-like sheaths in copepod axons. Nature. 1999;398:571–571. doi: 10.1038/19212. [PubMed] [CrossRef] [Google Scholar]
- ↑ Hartline D.K., Colman D.R. Rapid conduction and the evolution of giant axons and myelinated fibers. Curr. Biol. 2007;17:R29–R35. doi: 10.1016/j.cub.2006.11.042. [PubMed] [CrossRef] [Google Scholar]
- ↑ Arancibia-Carcamo I.L., Attwell D. The node of ranvier in CNS pathology. Acta Neuropathol. 2014;128:161–175. doi: 10.1007/s00401-014-1305-z.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Faisal A.A., White J.A., Laughlin S.B. Ion-channel noise places limits on the miniaturization of the brain’s wiring. Curr. Biol. 2005;15:1143–1149. doi: 10.1016/j.cub.2005.05.056. [PubMed] [CrossRef] [Google Scholar]
- ↑ Babbs C.F., Riyi S. Subtle paranodal injury slows impulse conduction in a mathematical model of myelinated axons. PLoS ONE. 2013;8:e67767. doi: 10.1371/journal.pone.0067767. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ 9.0 9.1 9.2 Trapp B.D., Nave K.A. Multiple sclerosis: An immune or neurodegenerative disorder? Annu. Rev. Neurosci. 2008;31:247–69. doi: 10.1146/annurev.neuro.30.051606.094313. [PubMed] [CrossRef] [Google Scholar]
- ↑ 10.0 10.1 10.2 10.3 Compston A., Coles A. Multiple sclerosis. Lancet. 2008;372:1502–1517. doi: 10.1016/S0140-6736(08)61620-7. [PubMed] [CrossRef] [Google Scholar]
- ↑ Ostermann P.O., Westerberg C.E. Paroxysmal attacks in multiple sclerosis. Brain. 1975;98:189–202. doi: 10.1093/brain/98.2.189. [PubMed] [CrossRef] [Google Scholar]
- ↑ Twomey J.A., Espir M.L. Paroxysmal symptoms as the first manifestations of multiple sclerosis. J. Neurol. Neurosurg. Psychiatry. 1980;43:296–304. doi: 10.1136/jnnp.43.4.296. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Seewann A., Vrenken H., van der Valk P., Blezer E.L., Knol D.L., Castelijns J.A., Polman C.H., Pouwels P.J., Barkhof F., Geurts J.J. Diffusely abnormal white matter in chronic multiple sclerosis: Imaging and histopathologic analysis. Arch. Neurol. 2009;66:601–609. doi: 10.1001/archneurol.2009.57. [PubMed] [CrossRef] [Google Scholar]
- ↑ Ceccarelli A., Bakshi R., Neema M. MRI in multiple sclerosis: A review of the current literature. Curr. Opin. Neurol. 2012;25:402–409. doi: 10.1097/WCO.0b013e328354f63f. [PubMed] [CrossRef] [Google Scholar]
- ↑ 15.0 15.1 Moore J.W., Joyner R.W., Brill M.H., Waxman S.D., Najar-Joa M. Simulations of conduction in uniform myelinated fibers. Relative sensitivity to changes in nodal and internodal parameters. Biophys. J. 1978;21:147–160. doi: 10.1016/S0006-3495(78)85515-5. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Waxman S.G., Kocsis J.D., Stys P.K. The Axon: Structure, Function and Pathophysiology. Oxford University Press; New York, NY, USA: 1995. [Google Scholar]
- ↑ Polman C.H., Reingold S.C., Banwell B., Clanet M., Cohen J.A., Filippi M., Fujihara K., Havrdova E., Hutchinson M., Kappos L., et al. Diagnostic criteria for multiple sclerosis: 2010 revisions to the McDonald criteria. Ann. Neurol. 2011;69:292–302. doi: 10.1002/ana.22366. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ 18.0 18.1 Stephanova D.I., Dimitrov B. Computational Neuroscience: Simulated Demyelinating Neuropathies and Neuronopathies. CRC Press; Boca Raton, FL, USA: 2013. [Google Scholar]
- ↑ 19.0 19.1 Bostock H., Baker M., Reid G. Changes in excitability of human motor axons underlying post-ischaemic fasciculations: Evidence for two stable states. J. Physiol. 1991;441:537–557. doi: 10.1113/jphysiol.1991.sp018766.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Mogyoros I., Kiernan M.C., Burke D., Bostock H. Strength-duration properties of sensory and motor axons in amyotrophic lateral sclerosis. Brain. 1998;121:851–859. doi: 10.1093/brain/121.5.851. [PubMed] [CrossRef] [Google Scholar]
- ↑ 21.0 21.1 Kiernan M.C., Burke D., Andersen K.V., Bostock H. Multiple measures of axonal excitability: A new approach in clinical testing. Muscle Nerve. 2000;23:399–409. doi: 10.1002/(SICI)1097-4598(200003)23:3<399::AID-MUS12>3.0.CO;2-G. [PubMed] [CrossRef] [Google Scholar]
- ↑ Cappelen-Smith C., Kuwabara S., Lin C.S., Mogyoros I., Burke D. Membrane properties in chronic inflammatory demyelinating polyneuropathy. Brain. 2001;124:2439–2447. doi: 10.1093/brain/124.12.2439. [PubMed] [CrossRef] [Google Scholar]
- ↑ Kuwabara S., Ogawara K., Sung J.Y., Mori M., Kanai K., Hattori T., Yuki N., MLin C.S., Burke D., Bostock H. Differences in membrane properties of axonal and demyelinating Guillain-Barré syndromes. Ann. Neurol. 2002;52:180–187. doi: 10.1002/ana.10275. [PubMed] [CrossRef] [Google Scholar]
- ↑ Nodera H., Bostock H., Kuwabara S., Sakamoto T., Asanuma K., Jia-Ying S., Ogawara K., Hattori N., Hirayama M., Sobue G., et al. Nerve excitability properties in Charcot-Marie-Tooth disease type 1A. Brain. 2004;127:203–211. doi: 10.1093/brain/awh020. [PubMed] [CrossRef] [Google Scholar]
- ↑ Sung M.H., Simon R. In silico simulation of inhibitor drug effects on nuclear factor-κB pathway dynamics. Mol. Pharmacol. 2004;66:70–75. doi: 10.1124/mol.66.1.70. [PubMed] [CrossRef] [Google Scholar]
- ↑ Stephanova D.I., Daskalova M. Differences in potentials and excitability properties in simulated cases of demyelinating neuropathies. Part III. Paranodal internodal demyelination. Clin. Neurophysiol. 2005;116:2334–2341. doi: 10.1016/j.clinph.2005.07.013. [PubMed] [CrossRef] [Google Scholar]
- ↑ Stephanova D.I., Daskalova M.S. Differences between the channels, currents and mechanisms of conduction slowing/block and accommodative processes in simulated cases of focal demyelinating neuropathies. Eur. Biophys. J. 2008;37:829–842. doi: 10.1007/s00249-008-0284-1. [PubMed] [CrossRef] [Google Scholar]
- ↑ Stephanova D.I., Alexandrov A.S. Simulating mild systematic and focal demyelinating neuropathies: Membrane property abnormalities. J. Integr. Neurosci. 2006;5:595–623. doi: 10.1142/S0219635206001331. [PubMed] [CrossRef] [Google Scholar]
- ↑ Stephanova D.I., Daskalova M., Alexandrov A.S. Channels, currents and mechanisms of accommodative processes in simulated cases of systematic demyelinating neuropathies. Brain Res. 2007;1171:138–151. doi: 10.1016/j.brainres.2007.07.029. [PubMed] [CrossRef] [Google Scholar]
- ↑ 30.0 30.1 Stephanova D.I., Krustev S.M., Negrev N., Daskalova M. The myelin sheath aqueous layers improve the membrane properties of simulated chronic demyelinating neuropathies. J. Integr. Neurosci. 2011;10:105–120. doi: 10.1142/S0219635211002646. [PubMed] [CrossRef] [Google Scholar]
- ↑ Stephanova D.I., Alexandrov A.S., Kossev A., Christova L. Simulating focal demyelinating neuropathies: Membrane property abnormalities. Biol. Cybern. 2007;96:195–208. doi: 10.1007/s00422-006-0113-5. [PubMed] [CrossRef] [Google Scholar]
- ↑ Bø L., Geurts J.J., Mörk S.J., van der Valk P. Grey matter pathology in multiple sclerosis. Acta Neurol. Scand. Suppl. 2006;183:48–50. doi: 10.1111/j.1600-0404.2006.00615.x. [PubMed] [CrossRef] [Google Scholar]
- ↑ Geurts J.J., Barkhof F. Grey matter pathology in multiple sclerosis. Lancet Neurol. 2008;7:841–851. doi: 10.1016/S1474-4422(08)70191-1. [PubMed] [CrossRef] [Google Scholar]
- ↑ Zivadinov R., Pirko I. Advances in understanding gray matter pathology in multiple sclerosis: Are we ready to redefine disease pathogenesis? BMC Neurol. 2012;12 doi: 10.1186/1471-2377-12-9. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Popescu B.F., Lucchinetti C.F. Pathology of demyelinating diseases. Annu. Rev. Pathol. 2012;7:185–217. doi: 10.1146/annurev-pathol-011811-132443.[PubMed] [CrossRef] [Google Scholar]
- ↑ Kurtzke J.F., Beebe G.W., Nagler B., Nefzger M.D., Auth T.L., Kurland L.T. Studies on the natural history of multiple sclerosis: V. Long-term survival in young men. Arch. Neurol. 1970;22:215–225. doi: 10.1001/archneur.1970.00480210025003. [PubMed] [CrossRef] [Google Scholar]
- ↑ Rao S.M., Leo G.J., Bernardin L., Unverzagt F. Cognitive dysfunction in multiple sclerosis. I. Frequency, patterns, and prediction. Neurology. 1991;41:685–691. doi: 10.1212/WNL.41.5.685. [PubMed] [CrossRef] [Google Scholar]
- ↑ Meuth S.G., Bittner S., Ulzheimer J.C., Kleinschnitz C., Kieseier B.C., Wiendl H. Therapeutic approaches to multiple sclerosis: An update on failed, interrupted, or inconclusive trials of neuroprotective and alternative treatment strategies. BioDrugs. 2010;24:317–330. doi: 10.2165/11537190-000000000-00000. [PubMed] [CrossRef] [Google Scholar]
- ↑ Goldenberg M.M. Multiple sclerosis review. Pharm. Ther. 2012;37:137–139.[PMC free article] [PubMed] [Google Scholar]
- ↑ Göbel K., Wedell J.H., Herrmann A.M., Wachsmuth L., Pankratz S., Bittner S., Budde T., Kleinschnitz C., Faber C., Wiendl H., et al. 4-Aminopyridine ameliorates mobility but not disease course in an animal model of multiple sclerosis. Exp. Neurol. 2013;248:62–71. doi: 10.1016/j.expneurol.2013.05.016.[PubMed] [CrossRef] [Google Scholar]
- ↑ Krishnan A.V., Kiernan M.C. Sustained-release fampridine and the role of ion channel dysfunction in multiple sclerosis. Mult. Scler. 2013;19:385–391. doi: 10.1177/1352458512463769. [PubMed] [CrossRef] [Google Scholar]
- ↑ Bowe C.M., Kocsis J.D., Targ E.F., Waxman S.G. Physiological effects of 4-aminopyridine on demyelinated mammalian motor and sensory fibers. Ann. Neurol. 1987;22:264–268. doi: 10.1002/ana.410220212. [PubMed] [CrossRef] [Google Scholar]
- ↑ Sakurai M., Kanazawa I. Positive symptoms in multiple sclerosis: Their treatment with sodium channel blockers, lidocaine and mexiletine. J. Neurol. Sci. 1999;162:162–168. doi: 10.1016/S0022-510X(98)00322-0. [PubMed]
- ↑ Mattson M.P., Guthrie P.B., Kater S.B. A role for Na+-dependent Ca2+extrusion in protection against neuronal excitotoxicity. FASEB J. 1989;3:2519–2526. [PubMed] [Google Scholar]
- ↑ Moll N.M., Rietsch A.M., Thomas S., Ransohoff A.J., Lee J.C., Fox R., Chang A., Ransohoff R.M., Fisher E. Multiple sclerosis normal-appearing white matter: Pathology-imagig correlations. Ann. Neurol. 2011;70:764–773. doi: 10.1002/ana.22521. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ 46.0 46.1 Lucchinetti C., Brück W., Parisi J., Scheithauer B., Rodriguez M., Lassmann H. Heterogeneity of multiple sclerosis lesions: Implications for the pathogenesis of demyelination. Ann. Neurol. 2000;47:707–717. doi: 10.1002/1531-8249(200006)47:6<707::AID-ANA3>3.0.CO;2-Q. [PubMed] [CrossRef] [Google Scholar]
- ↑ Kassmann C.M., Nave K.A. Oligodendroglial impact on axonal function and survival— A hypothesis. Curr. Opin. Neurol. 2008;21:235–241. doi: 10.1097/WCO.0b013e328300c71f. [PubMed] [CrossRef] [Google Scholar]
- ↑ Scolding N., Franklin R. Axon loss in multiple sclerosis. Lancet. 1998;352:340–341. doi: 10.1016/S0140-6736(05)60463-1. [PubMed] [CrossRef] [Google Scholar]
- ↑ Mi S., Miller R.H., Lee X., Scott M.L., Shulag-Morskaya S., Shao Z., Chang J., Thill G., Levesque M., Zhang M., et al. LINGO-1 negatively regulates myelination by oligodendrocytes. Nat. Neurosci. 2005;8:745–751. doi: 10.1038/nn1460. [PubMed] [CrossRef] [Google Scholar]
- ↑ Bittner S., Ruck T., Schuhmann M.K., Herrmann A.M., Maati H.M., Bobak N., Göbel K., Langhauser F., Stegner D., Ehling P., et al. 2013 Endothelial TWIK-related potassium channel-1 (TREK1) regulates immune-cell trafficking into the CNS. Nat. Med. 2013;19:1161–1165. doi: 10.1038/nm.3303. [PubMed]
- ↑ Viglietta V., Baecher-Allan C., Weiner H.L., Hafler D.A. Loss of functional suppression by CD4+CD25+ regulatory T cells in patients with multiple sclerosis. J. Exp. Med. 2004;199:971–999. doi: 10.1084/jem.20031579.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Zajicek J.P., Wing M., Scolding N.J., Compston D.A. Interactions between oligodendrocytes and microglia. A major role for complement and tumour necrosis factor in oligodendrocyte adherence and killing. Brain. 1992;115:1611–1631. [PubMed] [Google Scholar]
- ↑ 53.0 53.1 53.2 Nikić I., Merkler D., Sorbara C., Brinkoetter M., Kreutzfeldt M., Bareyre F.M., Brück W., Bishop D., Misgeld T., Kerschensteiner M. A reversible form of axon damage in experimental autoimmune encephalomyelitis and multiple sclerosis. Nat. Med. 2011;17:495–499. doi: 10.1038/nm.2324. [PubMed] [CrossRef] [Google Scholar]
- ↑ Barnett M.H., Prineas J.W. Relapsing and remitting multiple sclerosis: Pathology of the newly forming lesion. Ann. Neurol. 2004;55:458–468. doi: 10.1002/ana.20016. [PubMed] [CrossRef] [Google Scholar]
- ↑ Van der Laan L.J., Ruuls S.R., Weber K.S., Lodder I.J., Döpp E.A., Dijkstra C.D. Macrophage phagocytosis of myelin in vitro determined by flow cytometry: Phagocytosis is mediated by CR3 and induces production of tumor necrosis factor-α and nitric oxide. J. Neuroimmunol. 1996;70:145–152. doi: 10.1016/S0165-5728(96)00110-5. [PubMed] [CrossRef] [Google Scholar]
- ↑ Wang G., Thompson S.M. Maladaptive homeostatic plasticity in a rodent model of central pain syndrome: Thalamic hyperexcitability after spinothalamic tract lesions. J. Neurosci. 2008;28:11959–11969. doi: 10.1523/JNEUROSCI.3296-08.2008. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ 57.0 57.1 Coggan J.S., Prescott S.A., Bartol T.M., Sejnowski T.J. Imbalance of ionic conductances contributes to diverse symptoms of demyelination. Proc. Natl. Acad. Sci. USA. 2010;107:20602–20609. doi: 10.1073/pnas.1013798107.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ 58.0 58.1 Coggan J.S., Ocker G.K., Sejnowski T.J., Prescott S.A. Explaining pathological changes in axonal excitability through dynamical analysis of conductance-based models. J. Neural Eng. 2011;8 doi: 10.1088/1741-2560/8/6/065002. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ 59.0 59.1 59.2 Coggan J.S., Prescott S.A., Sejnowski T.J. Cooperativity between remote sites of ectopic spiking allows afterdischarge to be initiated and maintained at different locations. J. Comput. Neurosci. 2015;39:17–28. doi: 10.1007/s10827-015-0562-8. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ 60.0 60.1 Aon M.A., Cortassa S., Akar F.G., Brown D.A., Zhou L., O’Rourke B. From mitochondrial dynamics to arrhythmias. Int. J. Biochem. Cell Biol. 2009;41:1940–1948. doi: 10.1016/j.biocel.2009.02.016. [PMC free article][PubMed] [CrossRef] [Google Scholar]
- ↑ 61.0 61.1 Su K., Bourdette D., Forte M. Mitochondrial dysfunction and neurodegeneration in multiple sclerosis. Front. Physiol. 2013;4doi: 10.3389/fphys.2013.00169. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Soltesz I., Staley K. Computational Neuroscience in Epilepsy. 1st ed. Elsevier; London, UK: 2008. [Google Scholar]
- ↑ Hodgkin A.L., Huxley A.F. The components of membrane conductance in the giant axon of Loligo. J. Physiol. 1952;116:473–496. doi: 10.1113/jphysiol.1952.sp004718. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Hodgkin A.L., Huxley A.F. Currents carried by sodium and potassium ions through the membrane of the giant axon of Loligo. J. Physiol. 1952;116:449–472. doi: 10.1113/jphysiol.1952.sp004717. [PMC free article] [PubMed]
- ↑ Fitzhugh R. Computation of impulse initiation and saltatory conduction in a myelinated nerve fiber. Biophys. J. 1962;2:11–21. doi: 10.1016/S0006-3495(62)86837-4. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Goldman L., Albus J.S. Computation of impulse conduction in myelinated fibers; theoretical basis of the velocity-diameter relation. Biophys. J. 1968;8:596–607. doi: 10.1016/S0006-3495(68)86510-5. [PMC free article][PubMed] [CrossRef] [Google Scholar]
- ↑ Frankenhaeuser B., Huxley A.F. The action potential in the myelinated nerve fiber of Xenopus laevis as computed on the basis of voltage clamp data. J. Physiol. 1964;171:302–315. doi: 10.1113/jphysiol.1964.sp007378.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Smith R.S., Koles Z.J. Myelinated nerve fibers: Computed effect of myelin thickness on conduction velocity. Am. J. Physiol. 1970;219:1256–1258.[PubMed] [Google Scholar]
- ↑ Hutchinson N.A., Koles Z.J., Smith R.S. Conduction velocity in myelinated nerve fibres of Xenopus laevis. J. Physiol. 1970;208:279–289. doi: 10.1113/jphysiol.1970.sp009119. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Koles Z.J., Rasminsky M. A computer simulation of conduction in demyelinated nerve fibres. J. Physiol. 1972;227:351–364. doi: 10.1113/jphysiol.1972.sp010036. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Hardy W.L. Propagation speed in myelinated nerve. II. Theoretical dependence on external Na and on temperature. Biophys. J. 1973;13:1071–1089. doi: 10.1016/S0006-3495(73)86046-1. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Schauf C.L., Davis F.A. Impulse conduction in multiple sclerosis: A theoretical basis for modification by temperature and pharmacological agents. J. Neurol. Neurosurg. Psychiatry. 1974;37:152–161. doi: 10.1136/jnnp.37.2.152.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Brill M.H., Waxman S.G., Moore J.W., Joyner R.W. Conduction velocity and spike configuration in myelinated fibres: Computed dependence on internode distance. J. Neurol. Neurosurg. Psychiatry. 1977;40:769–774. doi: 10.1136/jnnp.40.8.769. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Waxman S.G., Brill M.H. Conduction through demyelinated plaques in multiple sclerosis: Computer simulations of facilitation by short internodes. J. Neurol. Neurosurg. Psychiatry. 1978;41:408–416. doi: 10.1136/jnnp.41.5.408.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Wood S.L., Waxman S.G., Kocsis J.D. Conduction of trans of impulses in uniform myelinated fibers: Computed dependence on stimulus frequency. Neuroscience. 1982;7:423–430. doi: 10.1016/0306-4522(82)90276-7. [PubMed] [CrossRef] [Google Scholar]
- ↑ Goldfinger M.D. Computation of high safety factor impulse propagation at axonal branch points. Neuroreport. 2000;11:449–456. doi: 10.1097/00001756-200002280-00005. [PubMed] [CrossRef] [Google Scholar]
- ↑ 77.0 77.1 Blight A.R. Computer simulation of action potentials and afterpotentials in mammalian myelinated axons: The case for a lower resistance myelin sheath. Neuroscience. 1985;15:13–31. doi: 10.1016/0306-4522(85)90119-8. [PubMed] [CrossRef] [Google Scholar]
- ↑ 78.0 78.1 Halter J.A., Clark J.W., Jr. A distributed-parameter model of the myelinated nerve fiber. J. Theor. Biol. 1991;148:345–382. doi: 10.1016/S0022-5193(05)80242-5. [PubMed] [CrossRef] [Google Scholar]
- ↑ Schwarz J.R., Eikhof G. Na currents and action potentials in rat myelinated nerve fibres at 20 and 37 °C. Pflugers Arch. 1987;409:569–577. doi: 10.1007/BF00584655. [PubMed] [CrossRef] [Google Scholar]
- ↑ 80.0 80.1 Stephanova D.I. Myelin as longitudinal conductor: A multi-layered model of the myelinated human motor nerve fibre. Biol. Cybern. 2001;84:301–308. doi: 10.1007/s004220000213. [PubMed] [CrossRef] [Google Scholar]
- ↑ 81.0 81.1 McIntyre C.C., Richardson A.G., Grill W.M. Modeling the excitability of mammalian nerve fibers: Influence of afterpotentials on the recovery cycle. J. Neurophysiol. 2002;87:995–1006. [PubMed] [Google Scholar]
- ↑ 82.0 82.1 Einziger P.D., Livshitz L.M., Mizrahi J. Generalized cable equation model for myelinated nerve fiber. IEEE Trans. Biomed. Eng. 2005;52:1632–1642. doi: 10.1109/TBME.2005.856031. [PubMed] [CrossRef] [Google Scholar]
- ↑ Volman V., Ng L. Primary paranode demyelination modulates slowly developing axonal depolarization in a model of axonal injury. J. Neural Comput. 2014;37:439–457. [PubMed] [Google Scholar]
- ↑ Stephanova D.I., Bostock H. A Distributed-parameter model of the myelinated human motor nerve fibre: Temporal and spatial distributions of action potentials and ionic currents. Biol. Cybern. 1995;73:275–280. doi: 10.1007/BF00201429. [PubMed] [CrossRef] [Google Scholar]
- ↑ Chiu S.Y., Ritchie J.M. On the physiological role of internodal potassium channels and the security of conduction in myelinated nerve fibres. Proc. R. Soc. Lond. B Biol. Sci. 1984;220:415–422. doi: 10.1098/rspb.1984.0010.[PubMed] [CrossRef] [Google Scholar]
- ↑ Brismar T., Schwarz J.R. Potassium permeability in rat myelinated nerve fibres. Acta Physiol. Scand. 1985;124:141–148. doi: 10.1111/j.1748-1716.1985.tb07645.x. [PubMed] [CrossRef] [Google Scholar]
- ↑ Chiu S.Y., Schwarz W. Sodium and potassium currents in acutely demyelinated internodes of rabbit sciatic nerves. J. Physiol. 1987;391:631–649. doi: 10.1113/jphysiol.1987.sp016760. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Baker M., Bostock H., Grafe P., Martius P. Function and distribution of three types of rectifying channel in rat spinal root myelinated axons. J. Physiol. 1987;383:45–67. [PMC free article] [PubMed] [Google Scholar
- ↑ Röper J., Schwarz J.R. Heterogeneous distribution of fast and slow potassium channels in myelinated rat nerve fibres. J. Physiol. 1989;416:93–110. doi: 10.1113/jphysiol.1989.sp017751. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Bittner S., Meuth S.G. Targeting ion channels for the treatment of autoimmune neuroinflammation. Ther. Adv. Neurol. Disord. 2013;6:322–336. doi: 10.1177/1756285613487782. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Waxman S.G., Ritchie J.M. Molecular dissection of the myelinated axon. Ann. Neurol. 1993;33:121–136. doi: 10.1002/ana.410330202. [PubMed] [CrossRef] [Google Scholar]
- ↑ Bittner S., Budde T., Wiendl H., Meuth S.G. From the background to the spotlight: TASK channels in pathological conditions. Brain Pathol. 2010;20:999–1009. doi: 10.1111/j.1750-3639.2010.00407.x. [PMC free article][PubMed] [CrossRef] [Google Scholar]
- ↑ Ehling P., Bittner S., Budde T., Wiendl H., Meuth S.G. Ion channels in autoimmune neurodegeneration. FEBS Lett. 2011;585:3836–3842. doi: 10.1016/j.febslet.2011.03.065. [PubMed] [CrossRef] [Google Scholar]
- ↑ 94.0 94.1 Hübel N., Dahlem M.A. Dynamics from seconds to hours in Hodgkin-Huxley model with time-dependent ion concentrations and buffer reservoirs. PLoS Comput. Biol. 2014;10:e1003941. doi: 10.1371/journal.pcbi.1003941.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Ganapathy L., Clark J.W. Extracellular currents and potentials of the active myelinated nerve fibre. Biophys. J. 1987;52:749–761. doi: 10.1016/S0006-3495(87)83269-1. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Prescott S.A. Pathological changes in peripheral nerve excitability. In: Jaeger D., Jung R., editors. Encyclopedia of Computational Neurosci. 1st ed. Springer-Verlag; New York, NY, USA: 2015. [Google Scholar]
- ↑ Barrett E.F., Barrett J.N. Intracellular recording from vertebrate myelinated axons: Mechanism of the depolarizing afterpotential. J. Physiol. 1982;323:117–144. doi: 10.1113/jphysiol.1982.sp014064. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Blight A.R., Someya S. Depolarizing afterpotentials in myelinated axons of mammalian spinal cord. Neuroscience. 1985;15:1–12. doi: 10.1016/0306-4522(85)90118-6. [PubMed] [CrossRef] [Google Scholar]
- ↑ Richardson A.G., McIntyre C.C., Grill W.M. Modelling the effects of electric fields on nerve fibres: Influence of the myelin sheath. Med. Biol. Eng. Comput. 2000;38:438–446. doi: 10.1007/BF02345014. [PubMed] [CrossRef] [Google Scholar]
- ↑ Zlochiver S. Persistent reflection underlies ectopic activity in multiple sclerosis: A numerical study. Biol. Cybern. 2010;102:181–196. doi: 10.1007/s00422-009-0361-2. [PubMed] [CrossRef] [Google Scholar]
- ↑ Ratté S., Zhu Y., Lee K.Y., Prescott S.A. Criticality and degeneracy in injury-induced changes in primary afferent excitability and the implications for neuropathic pain. Elife. 2014;3:e02370. doi: 10.7554/eLife.02370.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Zhu Y., Feng B., Schwartz E.S., Gebhart G.F., Prescott S.A. Novel method to assess axonal excitability using channelrhodopsin-based photoactivation. J. Neurophysiol. 2015;113:2242–2249. doi: 10.1152/jn.00982.2014.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Tagoe T., Barker M., Jones A., Allcock N., Hamann M. Auditory nerve perinodal dysmyelination in noise-induced hearing loss. J. Neurosci. 2014;12:2684–2688. doi: 10.1523/JNEUROSCI.3977-13.2014.
- ↑ Brown A.M., Hamann M. Computational modeling of the effects of auditory nerve dysmyelination. Front. Neuroanat. 2014;8doi: 10.3389/fnana.2014.00073. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Stephanova D.I., Daskalova M. Electrotonic potentials in simulated chronic inflammatory demyelinating polyneuropathy at 20 °C–42 °C. J. Integr. Neurosci. 2015;27:1–18. doi: 10.1142/S0219635215500119. [PubMed] [CrossRef] [Google Scholar]
- ↑ Rasminsky M. Hyperexcitability of pathologically myelinated axons and positive symptoms in multiple sclerosis. Adv. Neurol. 1981;31:289–297.[PubMed] [Google Scholar]
- ↑ Ulrich J., Groebke-Lorenz W. The optic nerve in multiple sclerosis: A morphological study with retrospective clinicopathological correlation. Neuro-Ophthalmology. 1983;3:149–159. doi: 10.3109/01658108309009732.[CrossRef] [Google Scholar]
- ↑ Hamada M.S., Kole M.H. Myelin loss and axonal ion channel adaptations associated with gray matter neuronal hyperexcitability. J. Neurosci. 2015;35:7272–7786. [PMC free article] [PubMed] [Google Scholar]
- ↑ Yu N., Morris C.E., Joós B., Longtin A. Spontaneous excitation patterns computed for axons with injury-like impairments of sodium channels and Na/K pumps. PLoS Comput. Biol. 2012;8:e1002664. doi: 10.1371/journal.pcbi.1002664. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Lopreore C.L., Bartol T.M., Coggan J.S., Keller D.X., Sosinsky G.E., Ellisman M.H., Sejnowski T.J. Computational modeling of three-dimensional electrodiffusion in biological systems: Application to the node of Ranvier. Biophys. J. 2008;95:2624–2635. doi: 10.1529/biophysj.108.132167.
- ↑ Broome T.M., Cole.man R.A. A mathematical model of cell death in multiple sclerosis. J. Neurosci. Methods. 2011;201:420–425. doi: 10.1016/j.jneumeth.2011.08.008. [PubMed] [CrossRef] [Google Scholar]
- ↑ Ridsdale R.A., Beniac D.R., Tompkins T.A., Moscarello M.A., Harauz G. Three-dimensional structure of myelin basic protein. II. Molecular modeling and considerations of predicted structures in multiple sclerosis. J. Biol. Chem. 1997;272:4269–4275. doi: 10.1074/jbc.272.7.4269. [PubMed] [CrossRef] [Google Scholar]
- ↑ Pigozzo A.B., Macedo G.C., Santos R.W., Lobosco M. On the computational modeling of the innate immune system. BMC Bioinform. 2013;14 doi: 10.1186/1471-2105-14-S6-S7. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Doerck S., Göbel K., Weise G., Schneider-Hohendorf T., Reinhardt M., Hauff P., Schwab N., Linker R., Mäurer M., Meuth S.G., et al. Temporal pattern of ICAM-I mediated regulatory T cell recruitment to sites of inflammation in adoptive transfer model of multiple sclerosis. PLoS ONE. 2010;5:e15478. doi: 10.1371/journal.pone.0015478. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ De Mendizábal N.V., Carneiro J., Solé R.V., Goñi J., Bragard J., Martinez-Forero I., Martinez-Pasamar S., Sepulcre J., Torrealdea J., Bagnato F., et al. Modeling the effector-regulatory T cell cross-regulation reveals the intrinsic character of relapses in Multiple Sclerosis. BMC Syst. Biol. 2011;5doi: 10.1186/1752-0509-5-114. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- ↑ Jolivet R., Coggan J.S., Allaman I., Magistretti P.J. Multi-timescale modeling of activity-dependent metabolic coupling in the neuron-glia-vasculature ensemble. PLoS Comput. Biol. 2015;11:e1004036. doi: 10.1371/journal.pcbi.1004036. [PMC free article] [PubMed] [CrossRef]
- ↑ Zeis T., Allaman I., Gentner M., Schroder K., Tschopp J., Magistretti P.J., Schaeren-Wiemers N. Metabolic gene expression changes in astrocytes in Multiple Sclerosis cerebral cortex are indicative of immune-mediated signaling. Brain Behav. Immun. 2015;48:315–325. doi: 10.1016/j.bbi.2015.04.013.[PubMed] [CrossRef] [Google Scholar]








